METALES METALES Se llama metales a los elementos













- Slides: 20

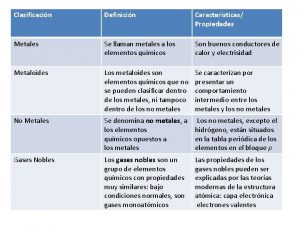
METALES

METALES Se llama metales a los elementos químicos caracterizados por ser buenos conductores del calor y la electricidad. Poseen alta densidad y son sólidos en temperaturas normales (excepto el mercurio); sus sales forman iones electropositivos (cationes) en disolución

El concepto de metal se refiere tanto a elementos puros, así como aleaciones con características metálicas, como el acero y el bronce. Los metales comprenden la mayor parte de la tabla periódica de los elementos y se separan de los no metales por una línea diagonal entre el boro y el polonio. En comparación con los no metales tienen baja electronegatividad y baja energía de ionización, por lo que es más fácil que los metales cedan electrones y más difícil que los ganen.

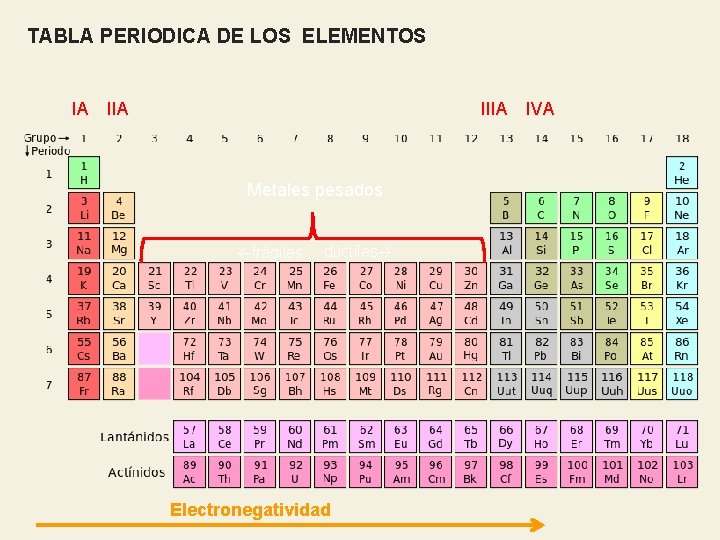
TABLA PERIODICA DE LOS ELEMENTOS IIIA IA IIA Metales pesados ←frágiles dúctiles→ Electronegatividad IVA

Dilatación es el cambio de longitud, volumen o alguna otra dimensión métrica que sufre un objeto físico debido al cambio de temperatura que se provoca en ella por cualquier medio de difusión del calor. Dilatación Lineal: L: long. Final L 0: long. Inicial : Coeficiente de dilatación lineal ΔT: incremento de T (Tf – Ti)

El coeficiente de dilatación lineal ( ) es el incremento de longitud que experimenta una varilla de determinada sustancia, con un largo inicial de un metro, cuando su temperatura se eleva un grado Celsius.

Dilatación volumétrica Es la dilatación térmica de un líquido o un gas y se observa como un cambio de volumen ΔV en una cantidad de sustancia de volumen inicial V 0, relacionado con un cambio de temperatura Δt. En este caso, la variación de volumen ΔV es directamente proporcional al volumen inicial V 0 y al cambio de temperatura Δt. = Coeficiente de dilatación volumétrica

¿Cuál será la longitud final de un espejo de vidrio que mide 2 m, si se expone a Un cambio de 15 °C (El coeficiente de dilatación lineal del vidrio a 25 °C es de 8. 72 x 10 -6 C-1) En que longitud habrá cambiado un viga de acero de 50 m que fue expuesta a un ΔT de 35 °C, sabiendo que tiene un valor de 11 x 10 -6 C-1

¿Qué variación de temperatura, habrá sufrido una estructura de aluminio que originalmente mide 68 m y que cambio su longitud en 8. 5 cm, si el coeficiente de dilatación lineal es de 23 x 10 -6 C -1? ¿Cuál será el coeficiente de dilatación volumétrico para 30 litros de agua, si hay un incremento en 1. 26 litros en un gradiente de temperatura de 200°C?

la longitud de un cable de acero es de 40 m a 22 °C. Determine su longitud en un día en que la temperatura es de 34 °C, sabiendo que el coeficiente de dilatación lineal del acero es igual a 11 x 10 -6 1/°C. A través de una barra metálica se quiere medir la temperatura de un horno para eso se coloca a una temperatura de 22 °C en el horno. Después de un cierto tiempo se retira la barra del horno y se verifica que la dilatación sufrida equivale a 1, 2 % de su longitud inicial, sabiendo que = 11 x 10 -6 1/°C. Determine: La temperatura del horno en el instante en que la barra fue retirada.

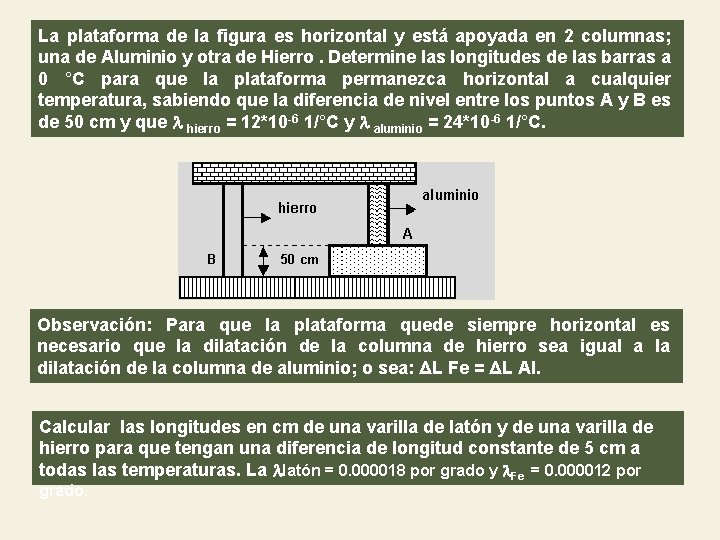
La plataforma de la figura es horizontal y está apoyada en 2 columnas; una de Aluminio y otra de Hierro. Determine las longitudes de las barras a 0 °C para que la plataforma permanezca horizontal a cualquier temperatura, sabiendo que la diferencia de nivel entre los puntos A y B es de 50 cm y que hierro = 12*10 -6 1/°C y aluminio = 24*10 -6 1/°C. Observación: Para que la plataforma quede siempre horizontal es necesario que la dilatación de la columna de hierro sea igual a la dilatación de la columna de aluminio; o sea: ΔL Fe = ΔL Al. Calcular las longitudes en cm de una varilla de latón y de una varilla de hierro para que tengan una diferencia de longitud constante de 5 cm a todas las temperaturas. La latón = 0. 000018 por grado y Fe = 0. 000012 por grado.

http: //www. jupesa. com. ec/web/s_danos_corrosion. php

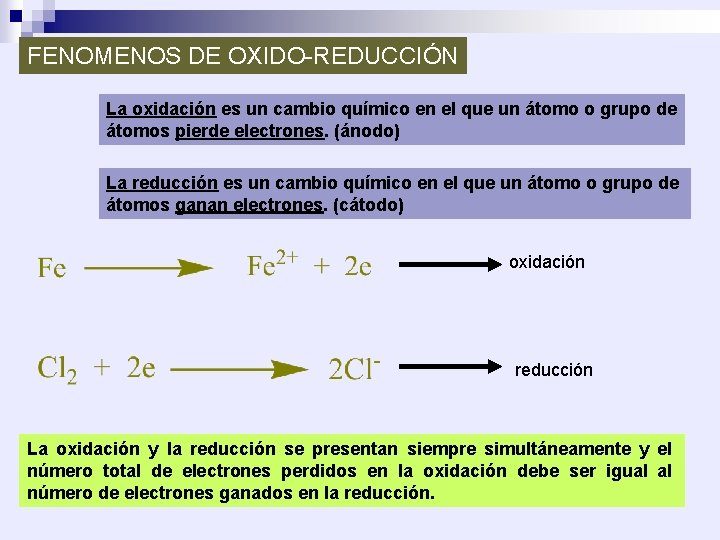
FENOMENOS DE OXIDO-REDUCCIÓN La oxidación es un cambio químico en el que un átomo o grupo de átomos pierde electrones. (ánodo) La reducción es un cambio químico en el que un átomo o grupo de átomos ganan electrones. (cátodo) oxidación reducción La oxidación y la reducción se presentan siempre simultáneamente y el número total de electrones perdidos en la oxidación debe ser igual al número de electrones ganados en la reducción.

CORROSIÓN La corrosión se define como el deterioro de un material a consecuencia de un ataque electroquímico por su entorno. De manera más general, puede entenderse como la tendencia general que tienen los materiales a buscar su forma más estable o de menor energía interna. Siempre que la corrosión esté originada por una reacción electroquímica (oxidación), la velocidad a la que tiene lugar dependerá en alguna medida de la temperatura, de la salinidad del fluido en contacto con el metal y de las propiedades de los metales en cuestión.

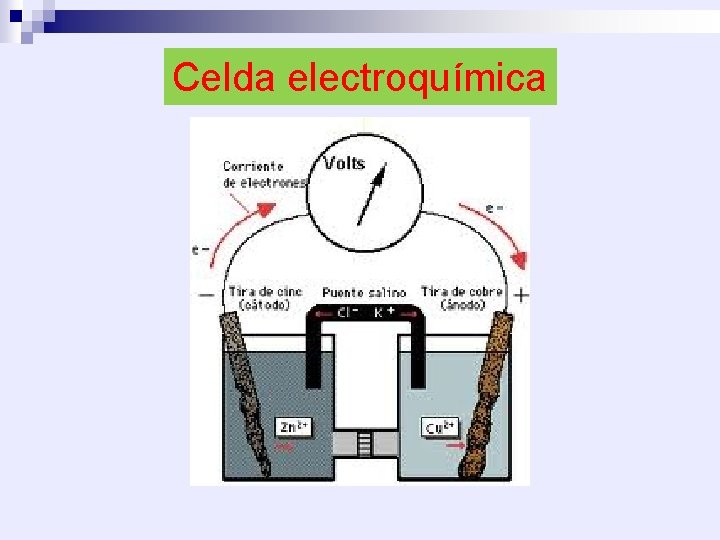
Celda electroquímica

CORROSIÓN Reacción electroquímica de la corrosión Esta reacción se puede dividir en dos semirreacciones electroquímicas Anódica OX: RED: +0. 44 V Catódica El signo + Indica que la reacción es espontánea http: //www. chem 1. com/acad/webtext/elchem/ec 7. html#CELLS +1. 23 V + 1. 67 V

El Fe (II) se sigue oxidando por la acción del oxigeno para formar “herrumbre”, esto es, óxido hidratado de Fe (III) Anódica -0. 77 V Catódica +1. 23 V

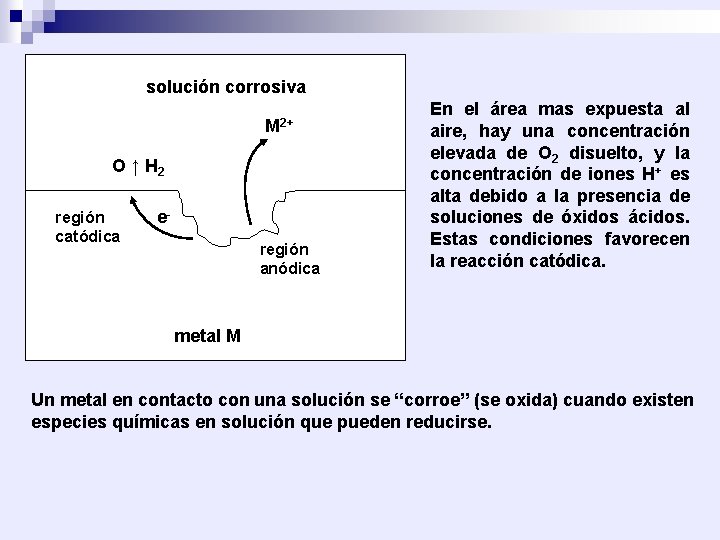
solución corrosiva M 2+ O ↑ H 2 región catódica eregión anódica En el área mas expuesta al aire, hay una concentración elevada de O 2 disuelto, y la concentración de iones H+ es alta debido a la presencia de soluciones de óxidos ácidos. Estas condiciones favorecen la reacción catódica. metal M Un metal en contacto con una solución se “corroe” (se oxida) cuando existen especies químicas en solución que pueden reducirse.

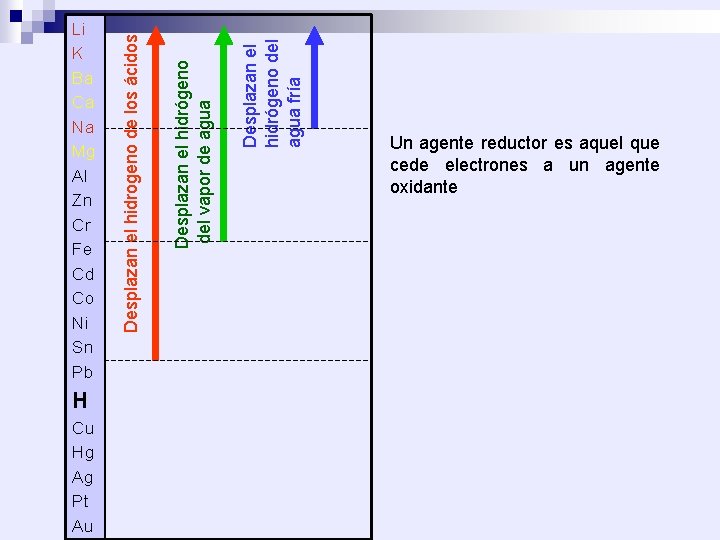
H Cu Hg Ag Pt Au Desplazan el hidrógeno del agua fría Desplazan el hidrógeno del vapor de agua Desplazan el hidrogeno de los ácidos Li K Ba Ca Na Mg Al Zn Cr Fe Cd Co Ni Sn Pb Un agente reductor es aquel que cede electrones a un agente oxidante

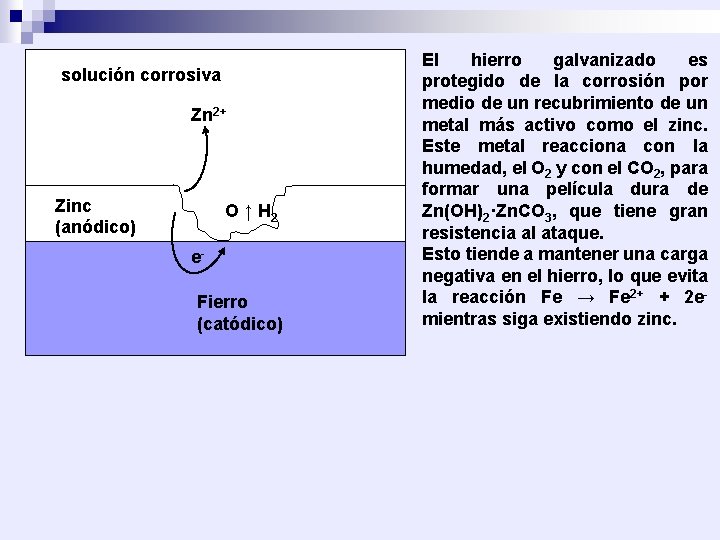
solución corrosiva Zn 2+ Zinc (anódico) O ↑ H 2 e. Fierro (catódico) El hierro galvanizado es protegido de la corrosión por medio de un recubrimiento de un metal más activo como el zinc. Este metal reacciona con la humedad, el O 2 y con el CO 2, para formar una película dura de Zn(OH)2·Zn. CO 3, que tiene gran resistencia al ataque. Esto tiende a mantener una carga negativa en el hierro, lo que evita la reacción Fe → Fe 2+ + 2 emientras siga existiendo zinc.
 Clasificación de los metales y no metales
Clasificación de los metales y no metales Llama llama red pajama summary
Llama llama red pajama summary Energía de ionización
Energía de ionización Serie de actividad de los metales
Serie de actividad de los metales Ejemplos de propiedades sensoriales de los materiales
Ejemplos de propiedades sensoriales de los materiales Astato propiedades
Astato propiedades Edad de los metales
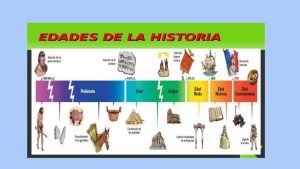
Edad de los metales Introducción
Introducción Paleoltico
Paleoltico Las edades de la historia
Las edades de la historia Ejemplos de cristales
Ejemplos de cristales Radio atomico
Radio atomico Practica 2 capacidad calorifica y calor de neutralizacion
Practica 2 capacidad calorifica y calor de neutralizacion Fogón donde se forjan los metales
Fogón donde se forjan los metales Sales nomenclatura
Sales nomenclatura Cuáles son los elementos de un texto narrativo
Cuáles son los elementos de un texto narrativo Ciencia que estudia los suelos.
Ciencia que estudia los suelos. Semejanza de sonidos que se dan entre versos
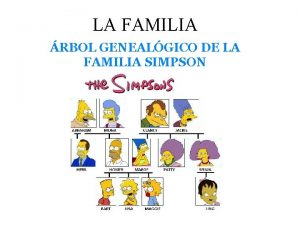
Semejanza de sonidos que se dan entre versos Primo de bart simpson
Primo de bart simpson Vídeo sobre paisagem natural e modificada
Vídeo sobre paisagem natural e modificada Tercer metal que compone los latones especiales
Tercer metal que compone los latones especiales