TEMA 5 LOS ELEMENTOS QUMICOS 1 Las primeras





- Slides: 16

TEMA 5: LOS ELEMENTOS QUÍMICOS 1. Las primeras clasificaciones de los elementos 2. ¿Cómo se mide la masa de los átomos? 3. Clasificación actual de los elementos 4. Agrupaciones de los átomos en los elementos: Átomos, moléculas y cristales. 5. Propiedades de algunas familias de elementos químicos

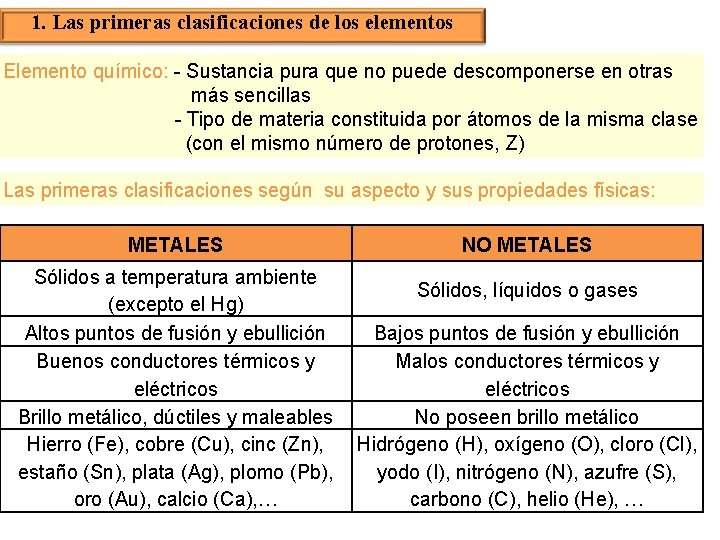
1. Las primeras clasificaciones de los elementos Elemento químico: - Sustancia pura que no puede descomponerse en otras más sencillas - Tipo de materia constituida por átomos de la misma clase (con el mismo número de protones, Z) Las primeras clasificaciones según su aspecto y sus propiedades físicas: METALES Sólidos a temperatura ambiente (excepto el Hg) Altos puntos de fusión y ebullición Buenos conductores térmicos y eléctricos Brillo metálico, dúctiles y maleables Hierro (Fe), cobre (Cu), cinc (Zn), estaño (Sn), plata (Ag), plomo (Pb), oro (Au), calcio (Ca), … NO METALES Sólidos, líquidos o gases Bajos puntos de fusión y ebullición Malos conductores térmicos y eléctricos No poseen brillo metálico Hidrógeno (H), oxígeno (O), cloro (Cl), yodo (I), nitrógeno (N), azufre (S), carbono (C), helio (He), …

2. ¿Cómo se mide la masa de los átomos? - Se elige el isótopo 12 C como referencia - Se establece que su masa es 12 u - Por eso se define la u (unidad de masa atómica) (1, 66. 10 -27 kg) como la doceava parte de la masa de un átomo de 12 C Las primeras clasificaciones según su aspecto y sus propiedades físicas: - Se miden las demás masas en comparación con la u La masa atómica de un elemento es la media ponderada de las masas de sus isótopos (media teniendo en cuenta las abundancias) *Aproximadamente dará como resultado el número másico

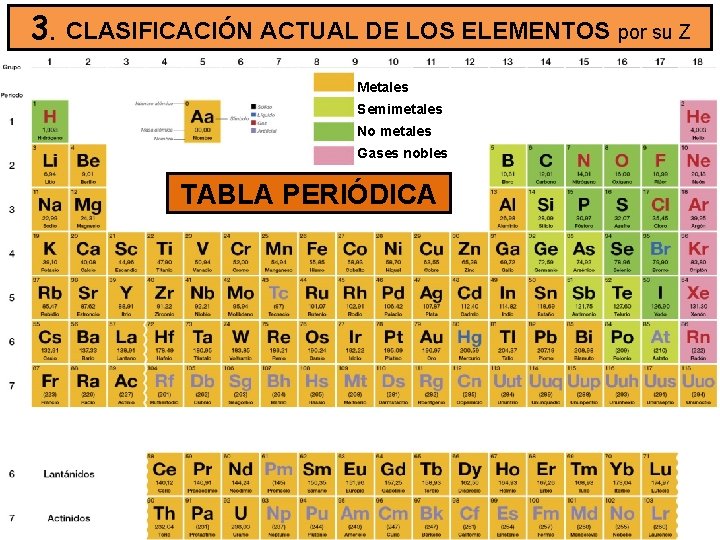
3. CLASIFICACIÓN ACTUAL DE LOS ELEMENTOS por su Z Metales Semimetales No metales Gases nobles TABLA PERIÓDICA

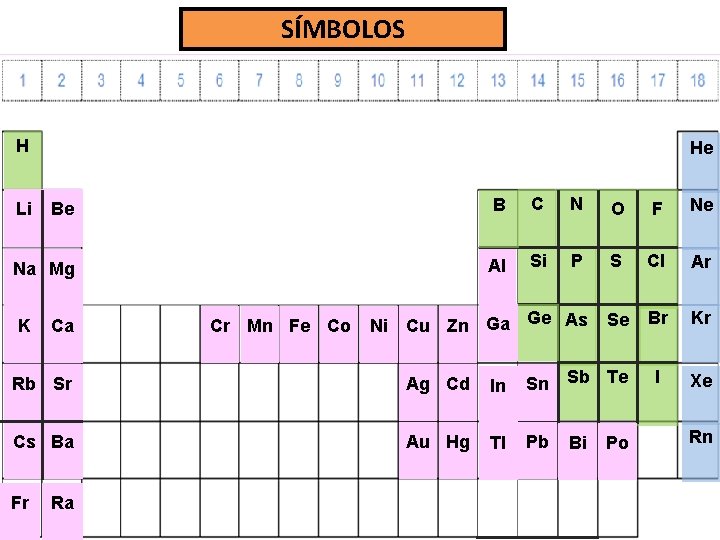
SÍMBOLOS H He Be B C N O F Ne Na Mg Al Si P S Cl Ar Se Br Kr I Xe Li K Ca Cr Mn Fe Co Ni Cu Zn Ga Ge As Rb Sr Ag Cd In Sn Sb Te Cs Ba Au Hg Tl Pb Fr Ra Bi Po Rn

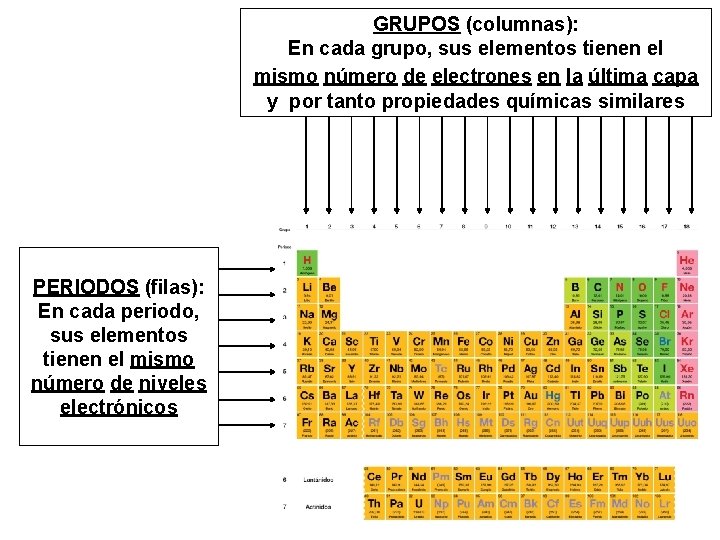
GRUPOS (columnas): En cada grupo, sus elementos tienen el mismo número de electrones en la última capa y por tanto propiedades químicas similares PERIODOS (filas): En cada periodo, sus elementos tienen el mismo número de niveles electrónicos

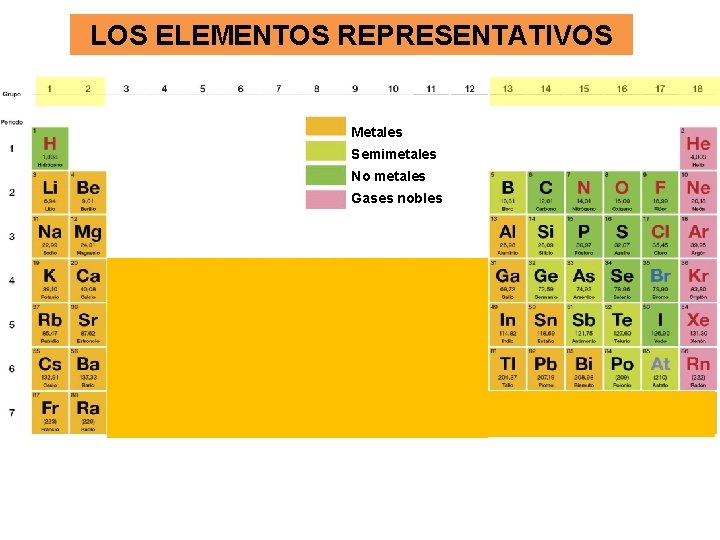
LOS ELEMENTOS REPRESENTATIVOS Metales Semimetales No metales Gases nobles

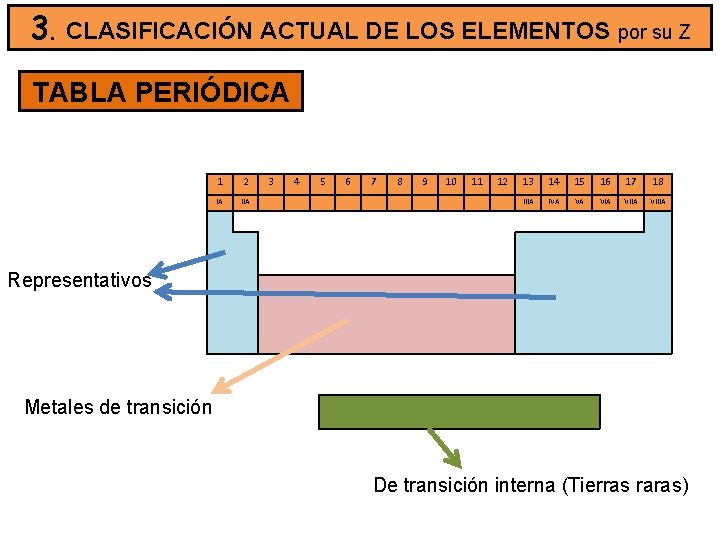
3. CLASIFICACIÓN ACTUAL DE LOS ELEMENTOS por su Z TABLA PERIÓDICA 1 2 IA IIA 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 IIIA IVA VA VIIA VIIIA Representativos Metales de transición De transición interna (Tierras raras)

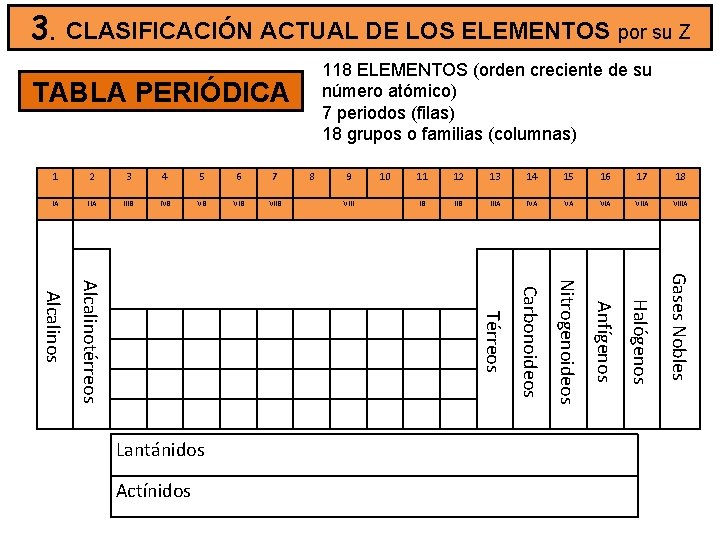
3. CLASIFICACIÓN ACTUAL DE LOS ELEMENTOS por su Z 118 ELEMENTOS (orden creciente de su número atómico) 7 periodos (filas) 18 grupos o familias (columnas) TABLA PERIÓDICA 7 IA IIIB IVB VB VIIB Alcalinotérreos Alcalinos Lantánidos Actínidos 8 9 VIII 10 11 12 13 14 15 16 17 18 IB IIIA IVA VA VIIA VIIIA Gases Nobles 6 Halógenos 5 Anfígenos 4 Nitrogenoideos 3 Carbonoideos 2 Térreos 1

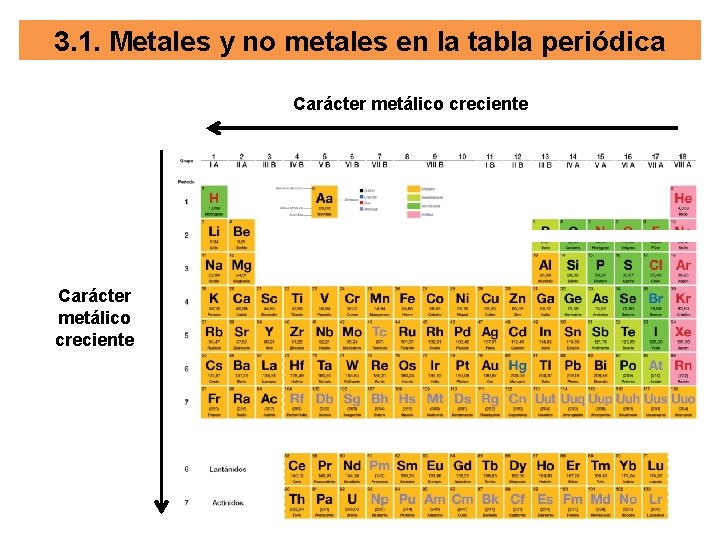
3. 1. Metales y no metales en la tabla periódica Carácter metálico creciente

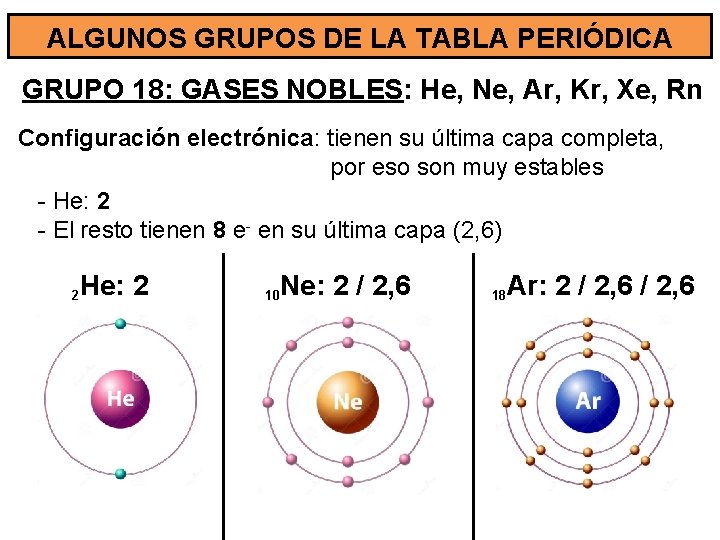
ALGUNOS GRUPOS DE LA TABLA PERIÓDICA GRUPO 18: GASES NOBLES: He, Ne, Ar, Kr, Xe, Rn Configuración electrónica: tienen su última capa completa, por eso son muy estables - He: 2 - El resto tienen 8 e- en su última capa (2, 6) 2 He: 2 10 Ne: 2 / 2, 6 18 Ar: 2 / 2, 6

ALGUNOS GRUPOS DE LA TABLA PERIÓDICA GRUPO 17: HALÓGENOS: F, Cl, Br, I Configuración electrónica: tienen en su última capa 7 e- (2, 5), es decir que les falta 1 e - para tener configuración de gas noble (estable) 9 F: 2 / 2, 5 17 +1 e- Cl: 2 / 2, 6 / 2, 5 +1 e- 9 F- : 2 / 2, 6 17 Cl- : 2 / 2, 6

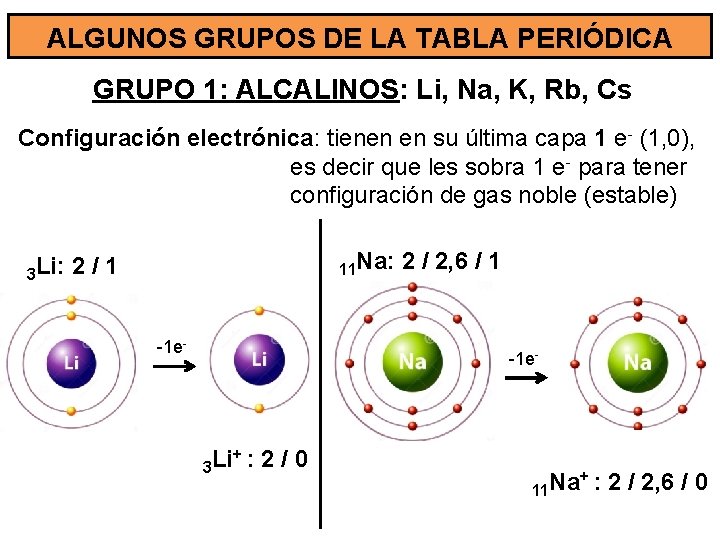
ALGUNOS GRUPOS DE LA TABLA PERIÓDICA GRUPO 1: ALCALINOS: Li, Na, K, Rb, Cs Configuración electrónica: tienen en su última capa 1 e- (1, 0), es decir que les sobra 1 e - para tener configuración de gas noble (estable) 3 Li: 11 Na: 2/1 -1 e- 2 / 2, 6 / 1 -1 e- +: 2 / 0 Li 3 11 Na +: 2 / 2, 6 / 0

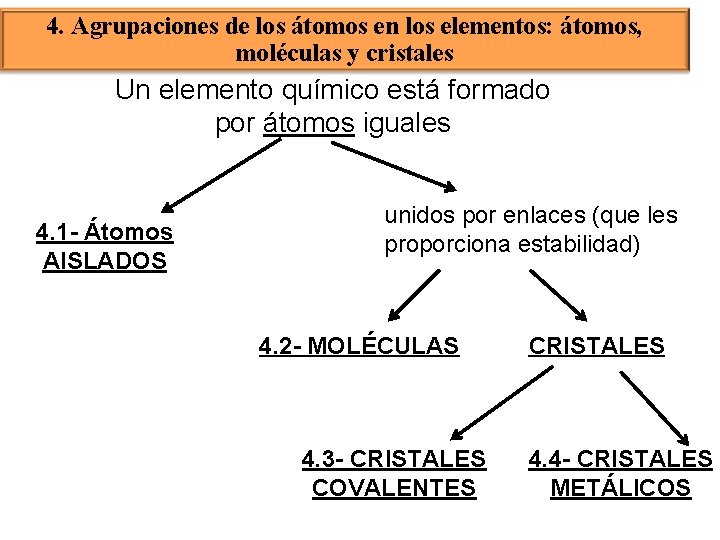
4. Agrupaciones de los átomos en los elementos: átomos, moléculas y cristales Un elemento químico está formado por átomos iguales 4. 1 - Átomos AISLADOS unidos por enlaces (que les proporciona estabilidad) 4. 2 - MOLÉCULAS 4. 3 - CRISTALES COVALENTES CRISTALES 4. 4 - CRISTALES METÁLICOS

4. Agrupaciones de los átomos en los elementos: átomos, moléculas y cristales Átomos aislados: Los gases nobles como tienen su última capa completa con 8 electrones (excepto el He que tiene 2) son muy estables y por eso no se combinan con otros elementos de la tabla periódica. Moléculas: A los elementos no metálicos les faltan electrones para completar su última capa por eso suelen hacer enlaces químicos con otros elementos no metálicos iguales o distintos, que consisten en compartir pares de electrones y se denomina enlace covalente. Ejs: H 2 O, CO 2, N 2, ( moléculas diatómicas) … Cristales covalentes: En algunos casos como el diamante o el grafito no se forma una molécula si no un cristal con infinidad de enlaces covalentes entre átomos de carbono. Cristales metálicos: Los electrones quedan deslocalizados formando un “mar de electrones”, que mantiene a los cationes unidos; es el enlace metálico. Ese mar de e- hace que los metales conduzcan la corriente eléctrica.

5. Propiedades de algunas familias de elementos químicos sodio cuchillo sodio en un vaso de agua potasio cuchillo y agua Alcalinos: Li, Na, K, Rb, Cs • Metales con un solo electrón en la última capa. • Son sólidos blandos (se rayan fácilmente). • Al cortar su superficie se puede observar el brillo metálico. • Son buenos conductores del calor y la electricidad. • Reaccionan violentamente tanto con el oxígeno como con el hidrógeno, desprendiendo llamas de distintos colores bromo yodo sublimando Halógenos: gas F 2, Cl 2, Br 2, I 2 liq s • No metales con siete electrones en la última capa. • Suelen formar moléculas diatómicas en las que comparten un par de electrones. • Gases a temperatura ambiente • Puntos de fusión y ebullición bajos. • Pueden ser corrosivas y venenosas, por lo que deben manejarse con mucho cuidado en el laboratorio.