Reaccin del oxgeno ante metales y no metales












- Slides: 12

Reacción del oxígeno ante metales y no metales Karen Elizabeth Nuñez Niño 137 A

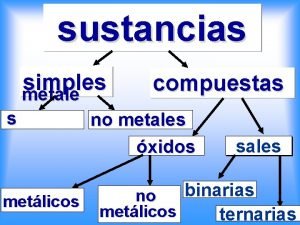
Planteamiento del problema • ¿El comportamiento químico de un metal frente al oxígeno es igual que el de un no metal? Hipótesis • El metal en presencia de oxígeno se oxida a través del tiempo mientras que un no metal no.

Objetivo • Establecer la diferencia entre los metales y los no metales con base en su comportamiento químico con el oxígeno. Materiales Sustancias Cucharilla de combustión cinta de magnesio 4 viales con tapa sodio o calcio 1 espatula azufre en polvo Mechero de alcohol carbón en polvo Pinzas agua destilada encendedor indicador universal pizeta Indicador fenolftaleína

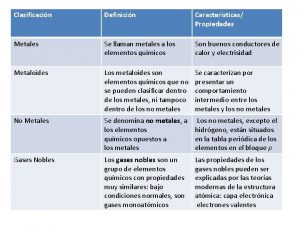
Introducción • Todos hemos visto o sentido algún objeto oxidado en nuestra vida. Esta característica de oxidación, nos ayuda a diferenciar qué elementos son metales y cuáles no, ya que sólo le ocurre a los metales.

Procedimiento 1. A un vial, agrega 3 m. L de agua destilada, después sujeta un pedazo de cinta de magnesio de aproximadamente un centímetro de largo, con unas pinzas y quémala en la flama azul del mechero; al terminar la combustión introduce en el vaso las cenizas de la cinta y adiciónale 3 gotas de indicador universal y registra tus observaciones. • Nota: Al calentar el magnesio no observes directamente la luz que se produce durante el calentamiento, ya que puede afectar a los ojos. 2. Repite la operación anterior, ahora con un

3. Coloca en la cucharilla de combustión una muestra de azufre en polvo. Calienta la cucharilla en la flama azul del mechero y cuando se produzca un gas captúralo rápidamente en un vial, tapa inmediatamente y agrega 3 m. L de agua destilada con 3 gotas de indicador universal, agita y anota tus observaciones. • Nota: No inhales los humos producidos.

Resultados Elemento Magnesio Sodio Calcio Azufre Carbono Tipo de oxido obtenido sólido o gaseoso Coloración que adquiere la disolución acuosa al combinarla con el oxido.

a) Oxidación del magnesio Mg + O Mg. O b) Oxidación del sodio o calcio Na + O Na 2 O c) Oxidación del azufre S+O SO 3 d) Oxidación del carbono C+O CO 2


Observaciones • Teníamos que colectar el gas muy rápido porque si no se escapaba. Conclusiones • Los metales reaccionaron de cierta manera ante el oxígeno, lo cual hace que nuestra hipótesis sea correcta, y eso lo comprobamos gracias a nuestros

Cuestionario 1. ¿Qué propiedades tienen en común los óxidos de magnesio, sodio y calcio? 2. ¿Qué propiedades tienen en común los óxidos de azufre y de carbón? 3. Se sabe que el magnesio y el sodio o calcio son elementos metálicos y que el azufre y el carbono son elementos no metálicos: ¿Existe alguna diferencia entre los óxidos de metales y los óxidos de los no metales? 4. ¿Se puede afirmar que los metales tienen el mismo comportamiento químico frente al oxigeno? Justifica tu respuesta. 5. ¿Se puede afirmar que los no metales tienen el mismo comportamiento químico frente al oxigeno? Justifica tu respuesta.

Bibliografía • Clases anteriores y explicación del profesor de Química I.
 Oxgeno
Oxgeno Símbolo químico del hidrógeno
Símbolo químico del hidrógeno Reaccin
Reaccin Reaccin
Reaccin Reaccin
Reaccin Del enunciado pero ante todo tienes que cumplir otro viaje
Del enunciado pero ante todo tienes que cumplir otro viaje Quali sono le fasi del ciclo cliente
Quali sono le fasi del ciclo cliente 2.7 elementos del accidente (sustentado ante stps)
2.7 elementos del accidente (sustentado ante stps) Elementos del accidente (sustentado ante stps)
Elementos del accidente (sustentado ante stps) Tercer metal que compone los latones especiales
Tercer metal que compone los latones especiales Propiedades fisicas de los metales
Propiedades fisicas de los metales Propiedades de los hidróxidos
Propiedades de los hidróxidos Reacciones de neutralización ejemplos
Reacciones de neutralización ejemplos