UTP FIMAAS Fsica Curso Fsica General Sesin N









































- Slides: 52

UTP FIMAAS Física Curso: Física General. Sesión Nº 19 : Calor y Temperatura. Profesor: Carlos Alvarado de la Portilla

Bibliografía. • Física Universitaria; Sears, Zemansky, Young, Freedman XI Edición. • Física General; Carel W. , Daniel Schaum Profesor: Carlos Alvarado de la Portilla

Objetivos: Conocer y definir los conceptos de calor, temperatura, principio cero de la termodinámica, equilibrio térmico, transmisión de calor y formas, • cambios de estado, calor sensible, calor latente de fusión y vaporización, calor específico, temperatura de equilibrio, poder calorífico; solución de problemas de calor. Profesor: Carlos Alvarado de la Portilla

Profesor: Carlos Alvarado de la Portilla

Calor y Temperatura 1. - Calor El calor es una forma de energía asociada al movimiento de los átomos , moléculas, y otras partículas que forman La materia. • El calor se puede generar: Por reacciones químicas Por reacciones nucleares Disipación electromagnética Disipación mecánica Profesor: Carlos Alvarado de la Portilla

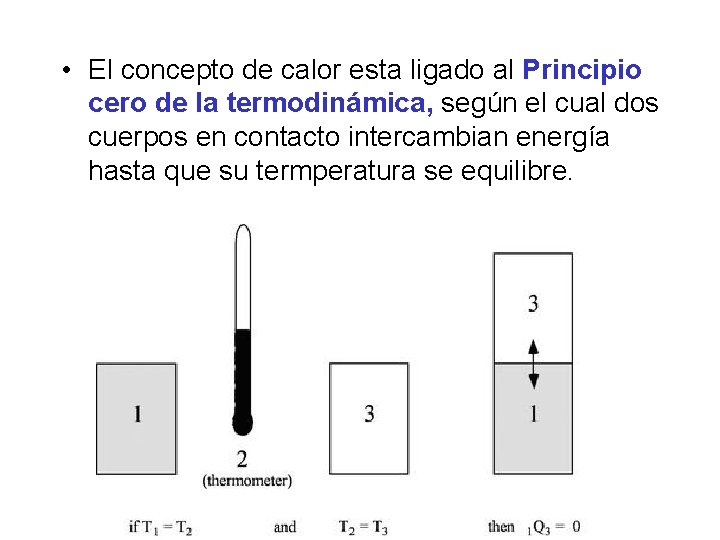
• El concepto de calor esta ligado al Principio cero de la termodinámica, según el cual dos cuerpos en contacto intercambian energía hasta que su termperatura se equilibre.

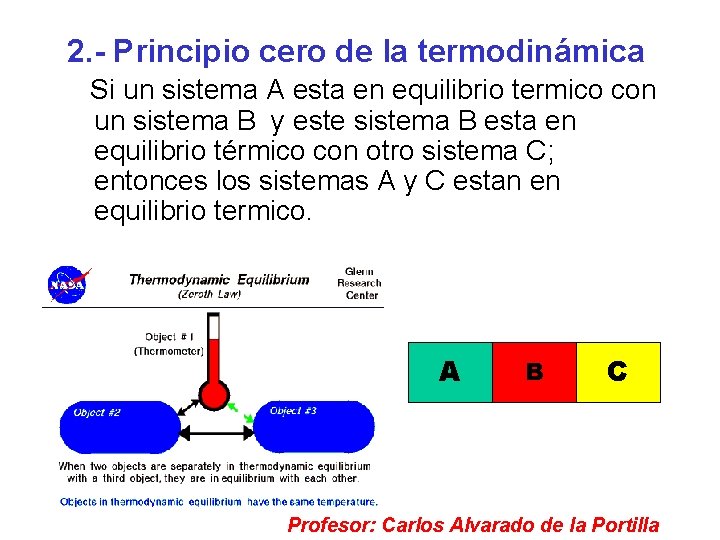
2. - Principio cero de la termodinámica Si un sistema A esta en equilibrio termico con un sistema B y este sistema B esta en equilibrio térmico con otro sistema C; entonces los sistemas A y C estan en equilibrio termico. A B C Profesor: Carlos Alvarado de la Portilla

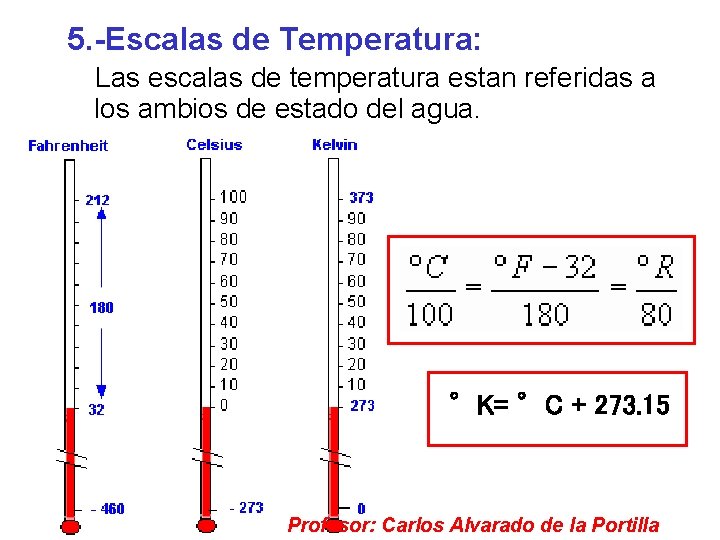
3. - Temperatura Es la propiedad física común que comparten los cuerpos que estan en equilibrio térmico en un sistema. La unidad de medida de la temoeratura en el Sistema Internacional de Unidades es el grado Celsius “°C” y en el sistema absoluto es el grado Kelvin “°K” o simplemente “K”. °K= °C + 273. 15 Profesor: Carlos Alvarado de la Portilla

• Celsius. • Anders Celsius (1701– 1744) fue un astrónomo suizo que inventó la escala centígrada en 1742. Celsius escogió el punto de fusión del hielo y el punto de ebullición del agua como sus dos temperaturas de referencia para dar con un método simple y consistente de un termómetro de calibración. • Celsius dividió la diferencia en la temperatura entre el punto de congelamiento y de ebullición del agua en 100 grados (de ahí el nombre centi, que quiere decir cien, y grado). Profesor: Carlos Alvarado de la Portilla

• La escala absoluta para medir la temperatura es comúnmente llamada Kelvin (K). Lord William Kelvin (1824– 1907) fue un físico Escosés que inventó la escala en 1854. La escala Kelvin está basada en la idea del cero absoluto, la temperatura teórica en la que todo el movimiento molecular se para y no se puede detectar ninguna energía. En teoría, el punto cero de la escala Kelvin es la temperatura más baja que existe en el universo: − 273. 15ºC. La escala Kelvin usa la misma unidad de división que la escala Celsius. Sin embargo vuelve a colocar el punto cero en el cero absoluto: − 273. 15ºC. Profesor: Carlos Alvarado de la Portilla

• Es así que el punto de congelamiento del agua es 273. 15 Kelvins (las graduaciones son llamadas Kelvins en la escala y no usa ni el término grado ni el símbolo º) y 373. 15 K es el punto de ebullición del agua. La escala Kelvin, como la escala Celsius, es una unidad de medida estandard del SI, usada comúnmente en las medidas científicas. Puesto que no hay números negativos en la escala Kelvin (porque teóricamente nada puede ser más frío que el cero absoluto), es muy conveniente usar la escala Kelvin en la investigación científica cuando se mide temperatura extremadamente baja. Profesor: Carlos Alvarado de la Portilla

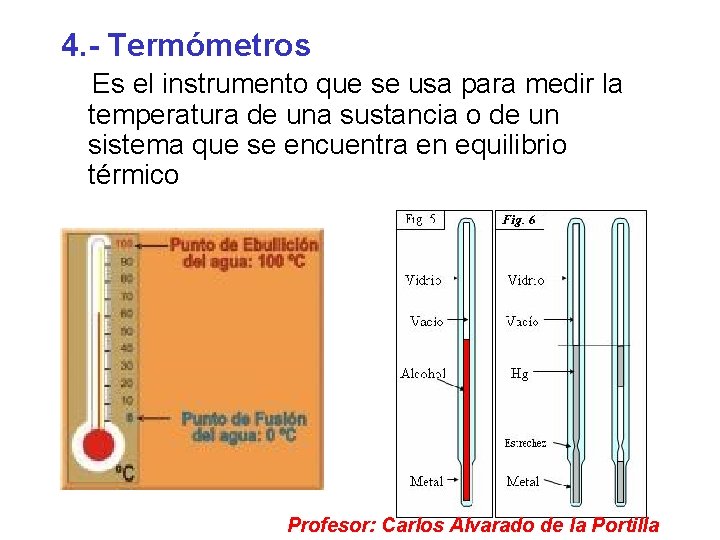
4. - Termómetros Es el instrumento que se usa para medir la temperatura de una sustancia o de un sistema que se encuentra en equilibrio térmico Profesor: Carlos Alvarado de la Portilla



Turbo Aquí se medirá una temperatura media de escape, ya que se mezclan los gases de escape de todos los cilindros. Profesor: Carlos Alvarado de la Portilla


5. -Escalas de Temperatura: Las escalas de temperatura estan referidas a los ambios de estado del agua. °K= °C + 273. 15 Profesor: Carlos Alvarado de la Portilla


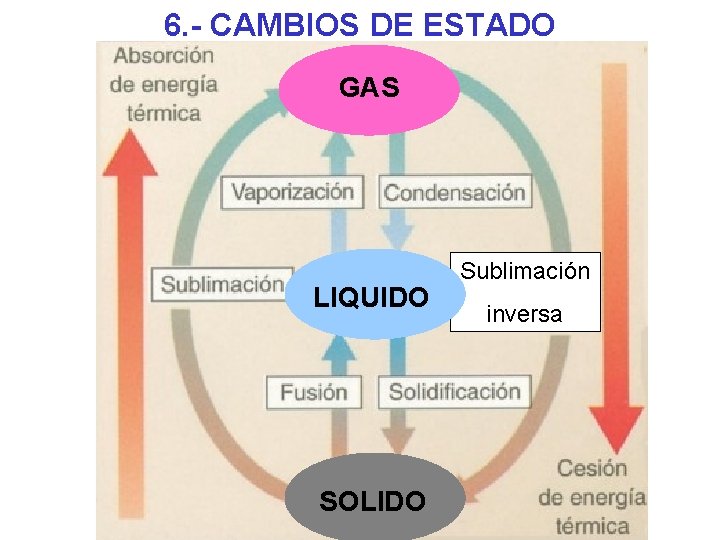
6. - CAMBIOS DE ESTADO GAS LIQUIDO SOLIDO Sublimación inversa


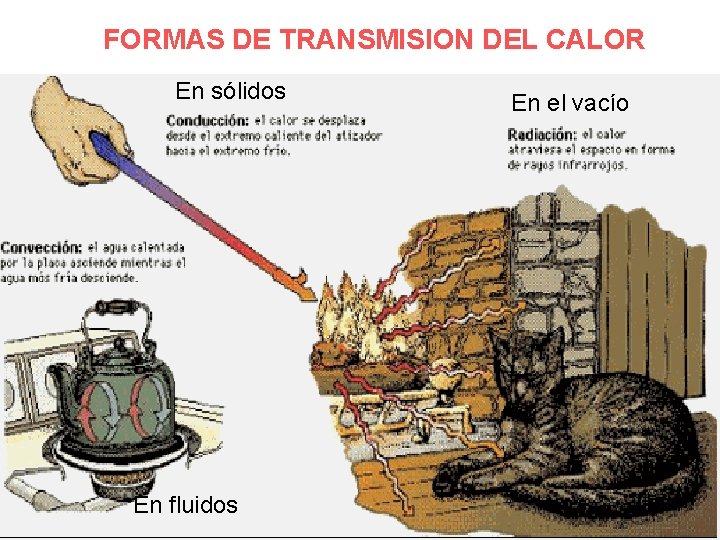
• 7. - Transmisión del calor. El calor se puede transmitir de la siguientes formas: • Por conducción: en los sólidos; las moléculas transmiten la energía a las vecinas y así sucesivamente. • Por convección: en los fluidos; se crean corrientes de convección por el movimiento de las capas calientes de las moléculas hacia arriba y así sucesivamente • Por radiación: en el vacío. Profesor: Carlos Alvarado de la Portilla

FORMAS DE TRANSMISION DEL CALOR En sólidos En fluidos En el vacío

8. - Experimento de Joule. Equivalente mecánico del calo. Profesor: Carlos Alvarado de la Portilla

Profesor: Carlos Alvarado de la Portilla

Profesor: Carlos Alvarado de la Portilla

Observamos que por efecto de la caida del bloque se mueven las aspas que estan dentro del calorímetro. El rozamiento de las aspas en movimiento dentro del agua, hace elevar la temperatura inicial. Se deja caer el bloque una altura “h” y se apunta la temperatura “T” final del agua calentada. Profesor: Carlos Alvarado de la Portilla







Profesor: Carlos Alvarado de la Portilla



Profesor: Carlos Alvarado de la Portilla

Profesor: Carlos Alvarado de la Portilla

ES EL EQUIVALENTE MECANICO DEL CALOR Profesor: Carlos Alvarado de la Portilla

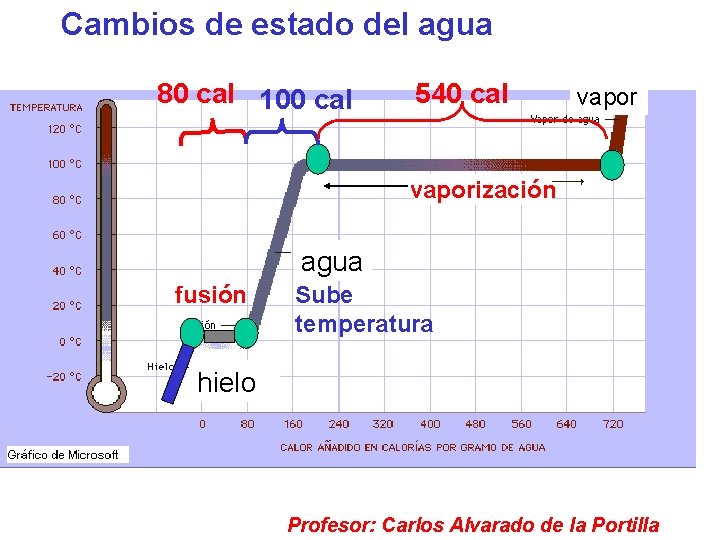
Cambios de estado del agua 80 cal 100 cal 540 cal vaporización agua fusión Sube temperatura hielo Profesor: Carlos Alvarado de la Portilla


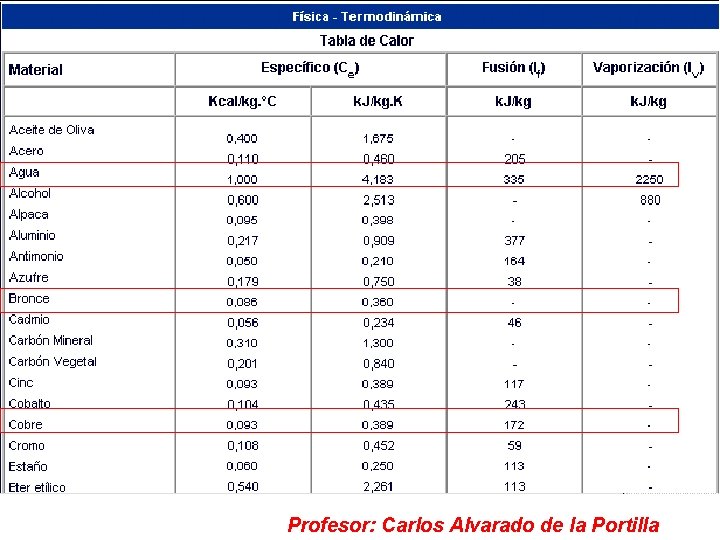
• Calor específico sustancia “Ce” Es la cantidad de calor necesaria para elevar la temperatura de un gramo de la sustancia, en un grado centígrado. Las unidades del calor específico son: cal /g °C ó Kcal /Kg °C Profesor: Carlos Alvarado de la Portilla

• Calor sensible “Q”. • Es el calor ganado o perdido por un cuerpo, siempre que no experimente ningún cambio de estado. Q = m Ce ΔT • donde: Q: es el calor aportado al sistema. m: es la masa del sistema. Ce: es el calor específico del sistema. ΔT: es el incremento de temperatura que experimenta el sistema Profesor: Carlos Alvarado de la Portilla

Calor específico del agua en sus diferentes estados. • Ce agua = 1 cal / g °C • Ce hielo = 0. 5 cal / g °C • Ce vapor = 0. 48 cal / g °C Profesor: Carlos Alvarado de la Portilla

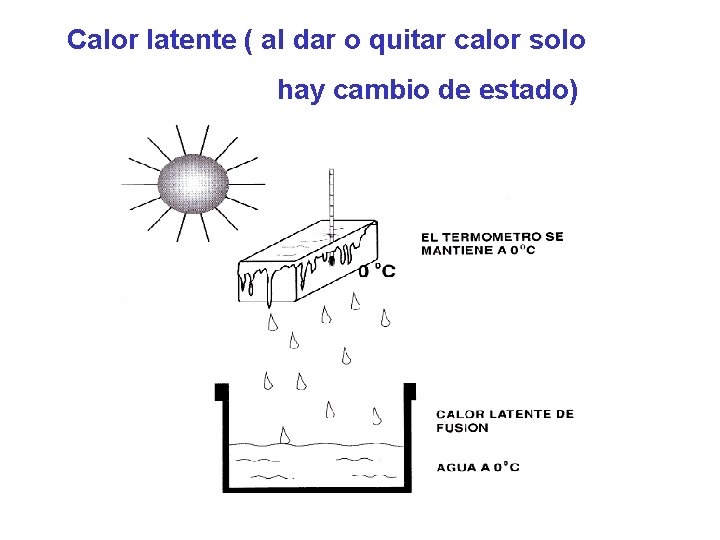
• Calor latente. Es el calor que ganado o perdido por una sustancia al experimentar un cambio de estado. Calor latente de fusión de un sólido “CLF” Es la cantidad de calor necesaria para pasar al estado líquido a la unidad de masa del cuerpo en cuestión; sin que varíe su temperatura. CLF del hielo = 80 cal / g ( a 0°C y 1 atm) Profesor: Carlos Alvarado de la Portilla

Calor latente de vaporización de un líquido “CLV” Es la cantidad de calor necesaria para pasar al estado de vapor a la unidad de masa del cuerpo en cuestión; sin que varíe su temperatura. CLv del agua = 540 cal / g (a 100°C y 1 atm) • OBSERVACIÓN La cantidad de calor necesaria total para que una sustancia de masa “m” cambie de estado, será: Q cambio estado = m CL Donde: m: es la masa de la sustancia CL: es el calor latente de la sustancia

Calor latente ( al dar o quitar calor solo hay cambio de estado)

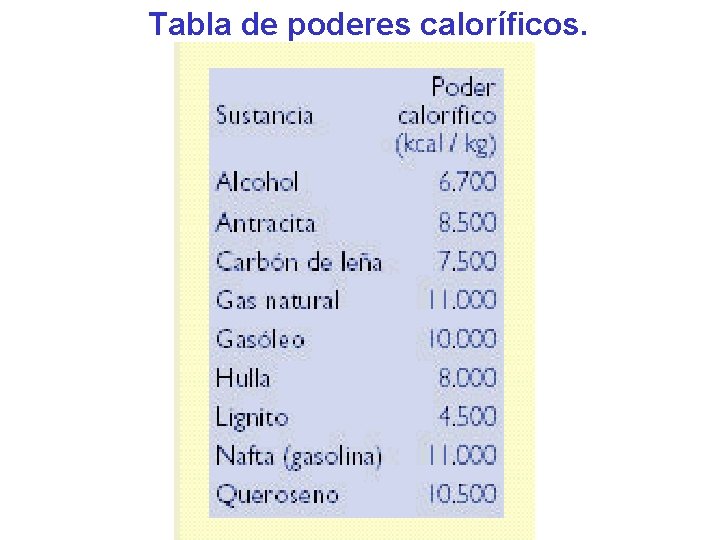
• Poder calorífico. Se llama poder calorífico al calor que se libera en el proceso de combustión de un cuerpo, llamado combustible. El poder calorífico se mide como la cantidad de calorías o kilocalorías que se desprenden en la combustión de 1 kg de masa del material combustible.

Tabla de poderes caloríficos.

Profesor: Carlos Alvarado de la Portilla


Problemas. Problema 1. Calcular la temperatura final de las siguientes mezclas: a) 20 Kg de agua a 70 ºC 5 Kg de agua a 10 ºC b) 7 Kg de hierro a 120ºC 10 litros de agua a 15 ºC

Problemas. Problema 2. Un calorímetro de 300 g y Ce = 0. 08 cal/g ºC contiene 50 g de agua a la temperatura de 20 ºC. Luego una pieza de metal de 100 g es extraída de un horno a 140 ºC y colocada dentro del calorímetro. ¿ Cuál será la temperatura final de equilibrio si el calor específico del metal es 0. 37 cal/g ºC?
 Sesin özellikleri
Sesin özellikleri Kulağın algıladığı titreşime ne denir
Kulağın algıladığı titreşime ne denir Dr sesin
Dr sesin Sesin 4
Sesin 4 Como redactar un tweet
Como redactar un tweet Iniciar sesin
Iniciar sesin Vicios de diccion
Vicios de diccion Carlos sesin
Carlos sesin Iniciar sesin
Iniciar sesin Desobel sirop
Desobel sirop Fsica
Fsica Eficiencia de carnot
Eficiencia de carnot Fsica
Fsica Muv
Muv Ramas de la física moderna
Ramas de la física moderna Fsica
Fsica Vectores unitarios
Vectores unitarios Fsica
Fsica Fsica
Fsica Fsica
Fsica Ed
Ed Fsica
Fsica Atrito
Atrito Aceleracion relativa
Aceleracion relativa Fsica
Fsica Fsica
Fsica Unidades de medida
Unidades de medida Fsica
Fsica Fsica
Fsica Movimento acelerado e retardado
Movimento acelerado e retardado Formula centripeta
Formula centripeta En que consisten estas formas de electrizar un cuerpo
En que consisten estas formas de electrizar un cuerpo Vector unitario de un vector
Vector unitario de un vector Fsica
Fsica Clases semipresenciales utp
Clases semipresenciales utp Lan
Lan Utp cable types
Utp cable types Email utp
Email utp Zielarstwo i fitoterapia magisterskie
Zielarstwo i fitoterapia magisterskie Ingeniería automotriz utp
Ingeniería automotriz utp Utp kablolarda kullanılan konnektör kodu
Utp kablolarda kullanılan konnektör kodu Saiiut utp
Saiiut utp Blog materno infantil utp
Blog materno infantil utp Email utp
Email utp Eduroam utp
Eduroam utp Utp kablolarda kullanılan konnektör kodu
Utp kablolarda kullanılan konnektör kodu Individuo y medio ambiente utp
Individuo y medio ambiente utp Ump to utp
Ump to utp Preicfes utp
Preicfes utp Utp 케이블 종류
Utp 케이블 종류 Utp wtie
Utp wtie Utp vzorec
Utp vzorec Canvas utp app
Canvas utp app









































































