Fotokimya Fotoliz Hz Fotokimya In meydana getirdii kimyasal
































![• Beklenilen ürünleri veren zincir yayılma tepkimelerini göz önüne alırsak: • -k 3[M][C • Beklenilen ürünleri veren zincir yayılma tepkimelerini göz önüne alırsak: • -k 3[M][C](https://slidetodoc.com/presentation_image_h/e1af7e5a27611892e357af4fbe883d6e/image-40.jpg)
![• 0 = k 3[M][C 2 H 5]-k 4[H][C 2 H 6] • • 0 = k 3[M][C 2 H 5]-k 4[H][C 2 H 6] •](https://slidetodoc.com/presentation_image_h/e1af7e5a27611892e357af4fbe883d6e/image-41.jpg)

![• 10. tepkimeyi sonlanma tepkimesi varsaydığımız için [H. ]<<[C 2 H 5]. [CH • 10. tepkimeyi sonlanma tepkimesi varsaydığımız için [H. ]<<[C 2 H 5]. [CH](https://slidetodoc.com/presentation_image_h/e1af7e5a27611892e357af4fbe883d6e/image-43.jpg)
![• Bu durumda: • • • [H. ] = r 3 -r 4 • Bu durumda: • • • [H. ] = r 3 -r 4](https://slidetodoc.com/presentation_image_h/e1af7e5a27611892e357af4fbe883d6e/image-44.jpg)
![• C 2 H 5. r 2=r 9 k 2[C 2 H 6][CH • C 2 H 5. r 2=r 9 k 2[C 2 H 6][CH](https://slidetodoc.com/presentation_image_h/e1af7e5a27611892e357af4fbe883d6e/image-45.jpg)

- Slides: 47

Fotokimya Fotoliz Hızı

Fotokimya • Işığın meydana getirdiği kimyasal değişimlerdir. (Photo Yunanca Işık). Atmosferdeki tepkimelerde fotokimyasal tepkimeler önemli bir yer tutar. Bir çok serbest kökün oluşmasına ve tepkin türlerin ortaya çıkmasını sağlar. Birçok önemli grubun atmosferde kalış zamanlarını etkiler.

Işıma İle İlgili Temel Konular • • Planck yasasına göre bir fotonun enerjisi ( E ) E = hv h: Planck sabiti (6. 626 x 10 -34 js) v: frekans

Mol Başına Düşen Enerji • Maddenin molu başına düşen foton enerjisini elde etmek için foton enerjisi bir moldeki molekül sayısı ile çarpılır. (6. 022 x 1023). • E = 6. 022 x 1023 hv = 6. 022 x 1023 hc/l. • c = 2. 9979 x 108 m/s

Fotokimyasal Tepkime • Fotokimyasal tepkime aşağıdaki şekilde gösterilir. • NO 2 + hv NO + O

Troposferdeki Belli Başlı Fotokimyasal Tepkimeler NO 2 + hv NO + O O 3 + hv O(‘P) + O 2 (315<l<1200 nm) O(‘D) + O 2 (l<315 nm) HNO 2 + hv NO + OH. H 2 O 2 + hv 2 OH. NO 3 +hv NO 2 + O NO + O 2 HCHO + hv HCO. + H. CO + H 2 (l>320 nm baskın)

Troposferdeki Fotokimya • l<290 nm daha troposfere gelmeden soğrulurlar. Troposferdeki fotokimyasal tepkimler için dalga boyu 290 ile 700 nm arasındaki ışınlar önemlidir.

Soğurma • Bir molekülün enerji soğurması için o molekülün yapısında bir üst enerji seviyesi olup gelen foton enerjisinin, bu üst enerji seviyesi ile alt seviyedeki enerji farkına eşit olması gerekir. • Küçük çaplı moleküller büyük moleküllere göre daha küçük dalga boylu ışınımları soğururlar. Örneğin N 2 ve H 2 100 nm’nin altındaki dalga boylarını soğururken göreceli olarak daha büyük bir molekül olan O 2 200 nm’nin altındaki ışınımları soğurur.

Aktinik Işıma • Fotokimyayı başlatan ışımaya aktinik ışıma denir. Aktinik ışıma bir küreye tüm yönlerden ulaşan ışımanın toplamını ifade eder. Daha önceki derslerde güneşten gelen ışımanın ortalama 1368 W/m 2 olduğunu gördük. • Aktinik akıyı hesaplarken 290 nm’den daha düşük dalga boylarının stratosferde tutulduğunun, arta kalan ışımanın da atmosferdeki gaz ve taneciklerin derişimine, ışının aldığı yolun uzunluğa, bulutların etkisine ve yer yüzeyinden kaynaklanan yansımaya göre değiştiğinin hesaba katılması gerekir. Tüm bu özellikler de yere, günün saatine, mevsime göre değişiklik gösterecektir.


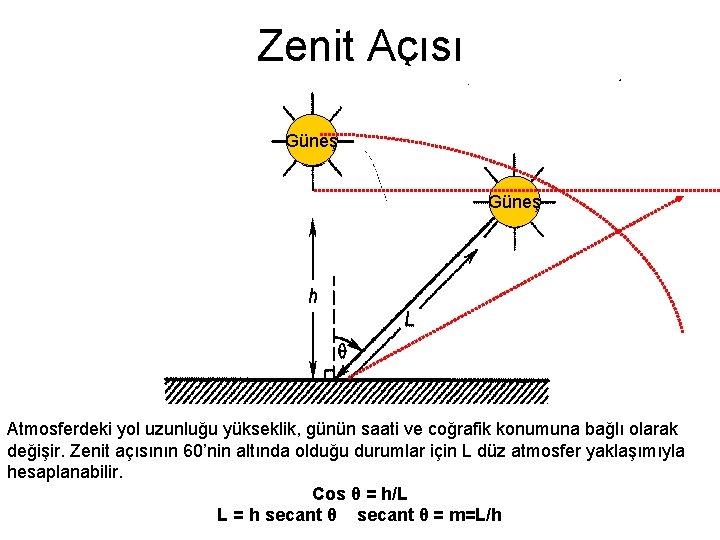
Zenit Açısı Güneş Atmosferdeki yol uzunluğu yükseklik, günün saati ve coğrafik konumuna bağlı olarak değişir. Zenit açısının 60’nin altında olduğu durumlar için L düz atmosfer yaklaşımıyla hesaplanabilir. Cos θ = h/L L = h secant θ = m=L/h

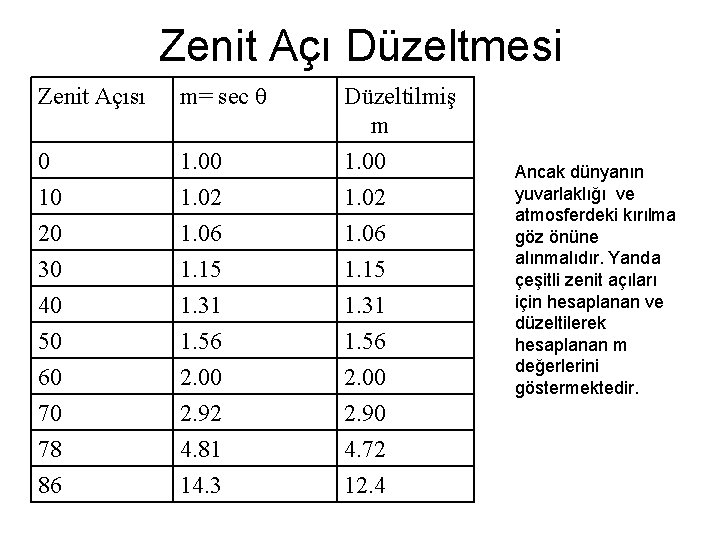
Zenit Açı Düzeltmesi Zenit Açısı m= sec θ 0 10 1. 02 Düzeltilmiş m 1. 00 1. 02 20 30 40 50 60 70 78 86 1. 06 1. 15 1. 31 1. 56 2. 00 2. 92 4. 81 14. 3 1. 06 1. 15 1. 31 1. 56 2. 00 2. 90 4. 72 12. 4 Ancak dünyanın yuvarlaklığı ve atmosferdeki kırılma göz önüne alınmalıdır. Yanda çeşitli zenit açıları için hesaplanan ve düzeltilerek hesaplanan m değerlerini göstermektedir.

• Saçılma ve soğurma nedeniyle meydana gelen azalma Beer Lambert kanunu ile ifade edilir. • I/Io = e-s. L • s: tutulma katsayısı (gaz ve taneciklerden kaynaklanan saçılma ve soğurma) • Gazlar tarafından başlıca tutulma stratosferdeki ozondan kaynaklanır. Bu nedenle ozon kolonunda gerekli varsayımlar yapılarak aktinik akı hesaplanır.

Molekülün Soğurduğu Işıma • Bir molekülün soğurduğu ışımayı (Ia foton/cm 3 s) hesaplamak içinse soğurma kesit alanı (s (l), cm 2/molekül) gelen aktinik akı (J(l) foton/cm 2. s) ve cm 3’deki molekül sayısıyla (X) ile çarpılarak bulunur. • Ia(l) = s(l) J(l) [X] • Günümüzde Peterson (1976)’da yaptığı hesaplamalar kullanılır. (Notlardaki tablolar) veya CMAQ modelinde olduğu gibi Delta-Eddington iki-yollu ışıma transfer modeli (Joseph et al. , 1976; Toon et al. , 1989) kullanılır. Hesaplamalarda dünya dışından gelen ışıma, asıltı tanecikler (Aerosol) , ozon ve oksijen tarafından soğrulma, Rayleigh saçılması ve yüzey yansımasına ait veriler yere ve zamana göre girilir.

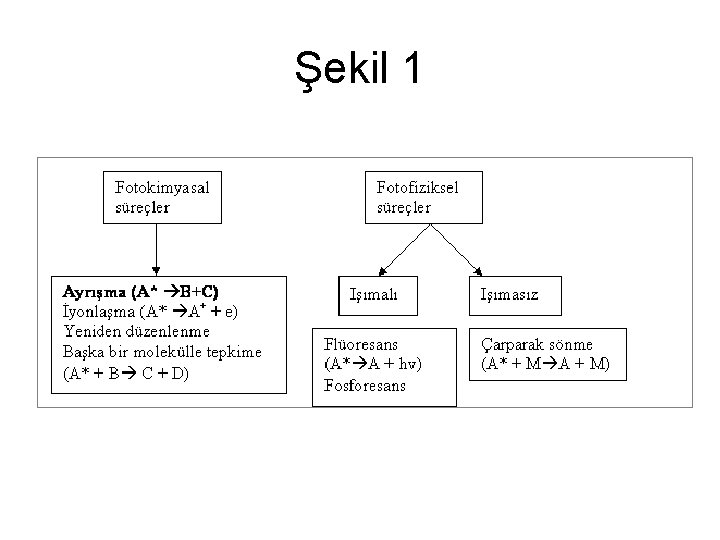
• Ancak fotoliz hızını bulmak için gelen bu ışımanın ne kadarının fotokimyasal tepkimeye neden olduğunun hesaplanması gerekir. • Gelen ışıma molekülde fotokimyasal veya fotofiziksel süreçler doğurabilir. Şekil 1’de bu süreçler gösterilmiştir. • Ayrışma, iyonlaşma, yeniden düzenlenme ve diğer bir molekülle tepkime fotokimyasal ışıma tipleridir. Işımalı ve ışımasız geçişler ise fotofiziksel süreçlerdir. Fotofiziksel süreçlerde molekül orijinal haline geri döner. • Troposferde atmosfer kimyası açısından en fazla rastlanan tepkime ayrışma şeklinde olanlardır

Şekil 1

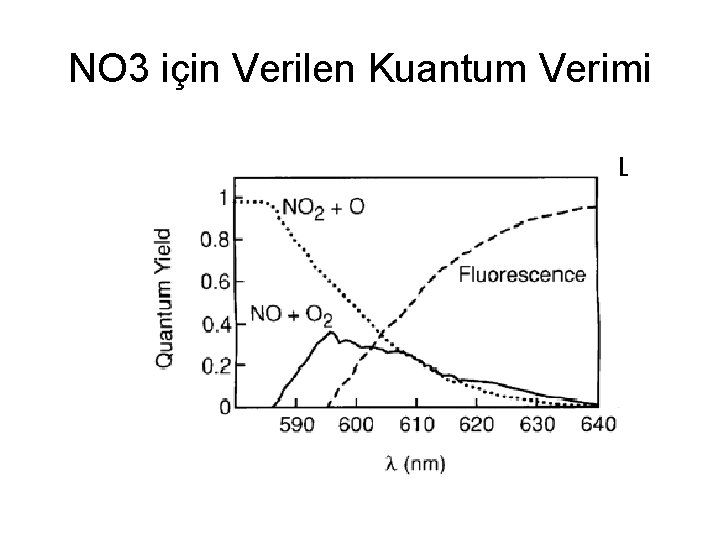
Kuantum Verimi • Toplam soğurulan enerjinin hangi süreçte kullanılacağı kuantum verimi katsayısıyla nicelendirilebilir. Herhangi bir i. süreç için kuantum verimi f (i). süreçle ilerleyecek olan uyartılmış molekül sayısının toplam soğrulan foton sayısına oranıdır. • f = i. süreçle ilerleyecek olan uyartılmış molekül sayısı/ soğrulan foton sayısı. • Örneğin ayrışmayla devam eden bir tepkime için • f = Ayrışma Tepkimesinde Kullanılan Uyartılmış Molekül Sayısı/ Soğrulan toplam foton sayısı • Her bir süreç için verilen kuantum verimlerinin toplamı 1 olacaktır. (Stark –Einstein Kanunu) • Sfi = 1

NO 3 için Verilen Kuantum Verimi

Fotoliz Hızının Hesaplanması


JA’nın Hesaplanması

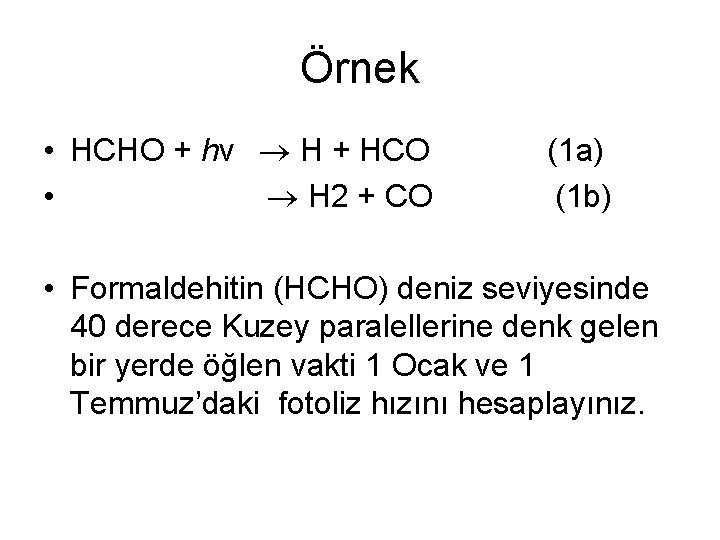
Örnek • HCHO + hν H + HCO • H 2 + CO (1 a) (1 b) • Formaldehitin (HCHO) deniz seviyesinde 40 derece Kuzey paralellerine denk gelen bir yerde öğlen vakti 1 Ocak ve 1 Temmuz’daki fotoliz hızını hesaplayınız.

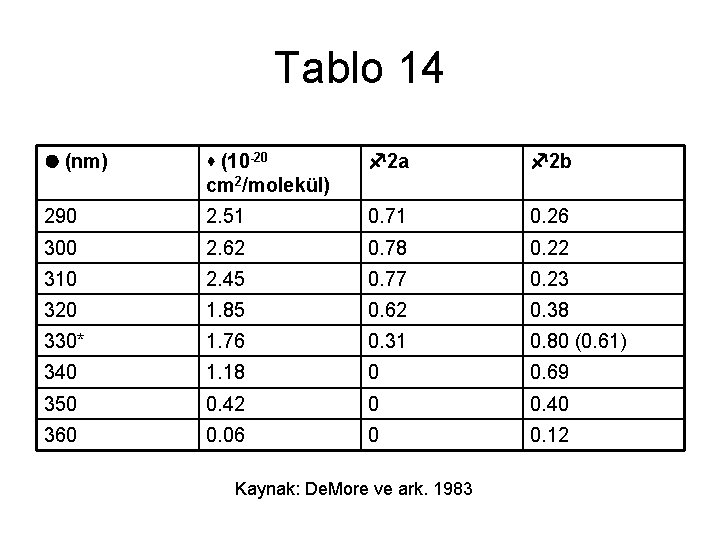
Çözüm • 1. Farklı dalga boylarına karşılık gelen soğurma kesit yüzey alanı (s) ve kuantum verimleri (f) elde edilir. (Bu değerler tabloda (Tablo 14) 300 K için verilmiş olmakla beraber sıcaklığa karşı duyarlılıkları fazla olmadığından farklı zamanlar için kullanılabilir. )

Tablo 14 l (nm) s (10 -20 cm 2/molekül) f 2 a f 2 b 290 2. 51 0. 71 0. 26 300 2. 62 0. 78 0. 22 310 2. 45 0. 77 0. 23 320 1. 85 0. 62 0. 38 330* 1. 76 0. 31 0. 80 (0. 61) 340 1. 18 0 0. 69 350 0. 42 0 0. 40 360 0. 06 0 0. 12 Kaynak: De. More ve ark. 1983

Çözüm • 2. Tablo 3. 7’den saat 12’deki Ocak 1 ve 1 Temmuz tarihine denk gelen güneş zenith açısı 63. Tablo 3. 5’deki 63’e denk gelen güneş aktinik akısı için 60 ile 70 arasında aradeğerleme yapılır. 305 ile 310 arasında aktinik akı 0. 244 x 1014 (t=60) ve 0. 064 x 1014 photon/cm 2/s (t=70). J (305 -310) 0 0. 90 x 1014 photon/cm 2 s. Diğer dalga boylarındaki aktinik akı da aynı şekilde tahmin edilir. • Zenit Açısı: http: //www. nrel. gov/midc/solpos. html • 3. Aktinik akı ortalama dünya-güneş mesafesine göre hesap edildiğinden mevsimler için de bir düzeltme yapılması gerekir. Bu düzeltme faktörleri Tablo 3. 6’da verilmiştir. Ocak 1 için düzeltme faktörü 1. 033. Bu durumda 1 Ocaktaki düzeltilmiş aktinik akı = 1. 033*0. 190 x 1014 = 0. 196 x 1014 foton/cm 2 s. Bu şekilde hesaplanan aktinik akılar Tablo 3. 15’de verilmiştir.


• Beklediğimiz gibi 1 Temmuzdaki fotoliz hızı Ocaktakinden daha hızlı. • Yukarda özetlendiği şekilde fotoliz hız sabitleri herhangi bir zaman ve yer için yapılabilir. Atmosferde yer alan bir çok tepkimenin fotokimyasal doğası göz önüne alındığında hesaplamaların doğru yapılması önemlidir.

Notlar • Daha geniş zenit açılarında daha uzun yoldan kaynaklanan hatalar oluşur. Geniş Teta açılarındaki küçük akılar daha çoklu saçılmalardan olur. Bu nedenle atmosferdeki gaz ve tanecik konsantrasyonundaki küçük yüzde değişimler hesaplanan akılarda büyük hatalara neden olur. • Hesaplanan bu fotoliz sabitleri bulutsuz gökyüzü için geçerlidir. Bulutların bulunması durumunda hesaplanan aktinik akı değerleri bulutun tipine, yüksekliğine, kapladığı alana göre değişiklik gösterecektir.

Soru • Aşağıdaki durumlar için aktinik akıları büyükten küçüğe doğru sıralayın. • A) 2 Şubat 11: 00 • B) 15 Ağustos saat 11: 00 yer yüzeyi • C) 15 Ağustos 40 km. • D) 15 Ağustos saat 17: 00 yer yüzeyi

Atmosferde Fotokimya • 1960’lara kadar kimyasal bazı gözlemler açıklanamıyordu. • 1) NO 2 Dönüşümü – 2 NO + O 2 2 NO 2 (tipik harici hava şartlarında çok yavaş) 2) Organiklerin hızlı oksidasyonu O 3 + C 3 H 6 Ürünler

• 1961’de Leighton serbest köklerin bu tepkimelerin oluşmasında bir rolü olabileceğini önerdi. • Belli başlı serbest kök grupları: • • • R. : alkil (Herhangi bir HKgrubundan oluşur) RO 2. : Alkil Peroksi RO. : Alkoksi OH. : Hidroksil HO 2. : Hidroperoksi H. : Hidrojen serbest kökü

Mekanizmalar • OH. + CO 2 (1) • H. + O 2 HO 2. (2) • HO 2 + NO OH. + NO 2 (3) • Bu mekanizmayla CO CO 2’ye, NO NO 2’ye dönüştüğü artı tepkimelerin atmosferdeki kadar hızlı ve serbest köklerin hem kullanılıp hem yeniden üretildiklerini gösterdi.

O halde Serbest Köklerin Kaynağı Nedir? • OH. Bugün hem temiz hem kirli gündüz atmosfer kimyasını belirler. • O 3 + hv O(‘D) + O 2 (l<320 nm) • O(‘D) + H 2 O 2 OH. HONO + hv OH. + NO (l<400 nm) H 2 O 2 + hv OH. + NO 2 (l<370 nm) HO 2. + NO OH. + NO 2

Serbest Kökler Kimyası • Zincirleme Tepkimeler • C 2 H 6 etan: C 2 H 6 C 2 H 4 + H 2 1. Başlatma: serbest köklerin oluşumu • (1) C 2 H 6 + M 2 CH 3. + M • 2. Zincir Yayılma (2) CH 3. + C 2 H 6 CH 4 + C 2 H 5. (3) C 2 H 5. + M C 2 H 4 + H. + M (4) H. + C 2 H 6 H 2 + C 2 H 5.

Serbest Kökler Kimyası • 3. Sonlanma (SKler kararlı bileşikler oluşturur) (5) 2 H. H 2 (6) H. + C 2 H 5. C 2 H 6 (7) H. + C 2 H 5. + M C 2 H 4 + H 2 (8) H. + CH 3 CH 4 (9) CH 3. + C 2 H 5. C 3 H 8 (10) 2 C 2 H 5. C 4 H 10 Zincirleme tepkimelerle bir Serbest Kök birçok HK molekülünü parçalar.

Zincir Uzunluğu • Zincir uzunluğu = L = radikalin bitmesinden önce zincir reaksiyonların tekrar etme süresi. (bitirme tepkimelerine oranla yayılma adımları ne kadar hızlı) Zincir yayılma hız Zincir Sonlanma SK oluşma havuzu zaman

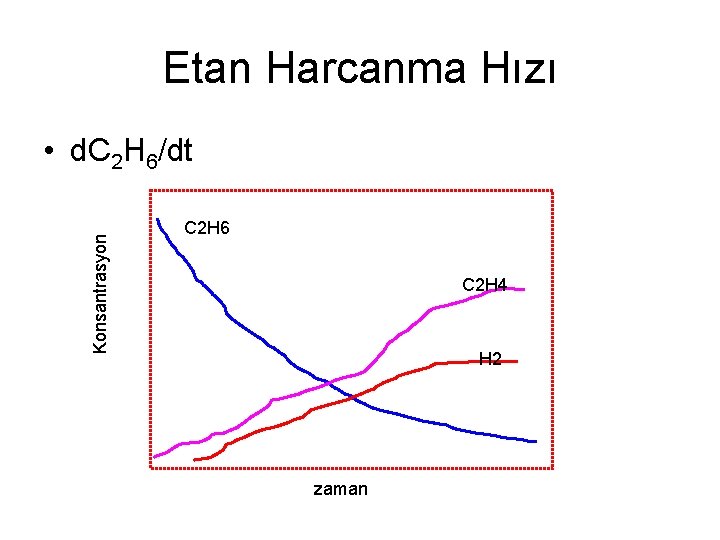
Etan Harcanma Hızı Konsantrasyon • d. C 2 H 6/dt C 2 H 6 C 2 H 4 H 2 zaman

Etan Zincirleme Tepkime • Etanın zamanla değişim hızını hesaplamak için 2 yol var: • 1. Her bir tepkiten için elementer tepkimeler kullanılarak basit formdaki diferansiyel hız denklemleri yazılıp ortaya çıkan denklem sisteminin çözülmesi • 2. Gerekli basitleştirici varsayımları yapıp C 2 H 6’yı diğer bileşenler cinsinden yazıp ortaya çıkan basit analitik denklemin çözülmesi

• Söz konusu serbest kökler olduğundan 2. seçenek uygulanabilir. • VARSAYIMLAR: • Serbest Kökler için yalancı sabit hal durumunun geçerli olduğunu • Zincir uzunluğu başlatma ve sonlanma tepkimelerini yok sayacak şekilde uzun olduğunu (sadece yayılma basamaklarını kullan) •
![Beklenilen ürünleri veren zincir yayılma tepkimelerini göz önüne alırsak k 3MC • Beklenilen ürünleri veren zincir yayılma tepkimelerini göz önüne alırsak: • -k 3[M][C](https://slidetodoc.com/presentation_image_h/e1af7e5a27611892e357af4fbe883d6e/image-40.jpg)
• Beklenilen ürünleri veren zincir yayılma tepkimelerini göz önüne alırsak: • -k 3[M][C 2 H 5] + k 4[H][C 2 H 6] =0 • Buna göre tepkime 10’un en önemli sonlanma tepkimesi olduğunu varsayalım. H. , CH 3. , ve C 2 H 5. için yaklaşık sabit hal varsayımını uygulayalım.
![0 k 3MC 2 H 5k 4HC 2 H 6 • 0 = k 3[M][C 2 H 5]-k 4[H][C 2 H 6] •](https://slidetodoc.com/presentation_image_h/e1af7e5a27611892e357af4fbe883d6e/image-41.jpg)
• 0 = k 3[M][C 2 H 5]-k 4[H][C 2 H 6] • 0 = 2 k 1[M][C 2 H 6]-k 2[CH 3][C 2 H 6] • 0 = k 2[H 3][C 2 H 6]-k 3[M][C 2 H 5] + k 4[H][C 2 H 6]-2 k 10[C 2 H 5]2

• Etanın kaybolma hızı: Başlatma
![10 tepkimeyi sonlanma tepkimesi varsaydığımız için H C 2 H 5 CH • 10. tepkimeyi sonlanma tepkimesi varsaydığımız için [H. ]<<[C 2 H 5]. [CH](https://slidetodoc.com/presentation_image_h/e1af7e5a27611892e357af4fbe883d6e/image-43.jpg)
• 10. tepkimeyi sonlanma tepkimesi varsaydığımız için [H. ]<<[C 2 H 5]. [CH 3. ]<<[C 2 H 5] Sadece (10) 2 C 2 H 5 ürünler tepkimesi önemli olur. Ancak 9. Tepkimenin [CH 3. ]>>[C 2 H 5] varsayımıyla daha önemli olduğunu iddia edebiliriz.
![Bu durumda H r 3 r 4 • Bu durumda: • • • [H. ] = r 3 -r 4](https://slidetodoc.com/presentation_image_h/e1af7e5a27611892e357af4fbe883d6e/image-44.jpg)
• Bu durumda: • • • [H. ] = r 3 -r 4 = 0 r 3 = r 4 [CH 3. ] = 2 r 1 -r 2 -r 9 = 0 [C 2 H 5. ] =r 2 -r 3+ r 4 -r 9 = 0 [CH 3. ] = 2 r 1+2 r 2 CH 3. r 2 = r 9 k 1[C 2 H 6][M] = k 2[CH 3. ][C 2 H 6]
![C 2 H 5 r 2r 9 k 2C 2 H 6CH • C 2 H 5. r 2=r 9 k 2[C 2 H 6][CH](https://slidetodoc.com/presentation_image_h/e1af7e5a27611892e357af4fbe883d6e/image-45.jpg)
• C 2 H 5. r 2=r 9 k 2[C 2 H 6][CH 3] = k 9[CH 3. ][C 2 H 5] • H. r 3=r 4

Başlatma basamağı Etanın kaybolma oranı etana göre 1. dereceden bir hız denklemi

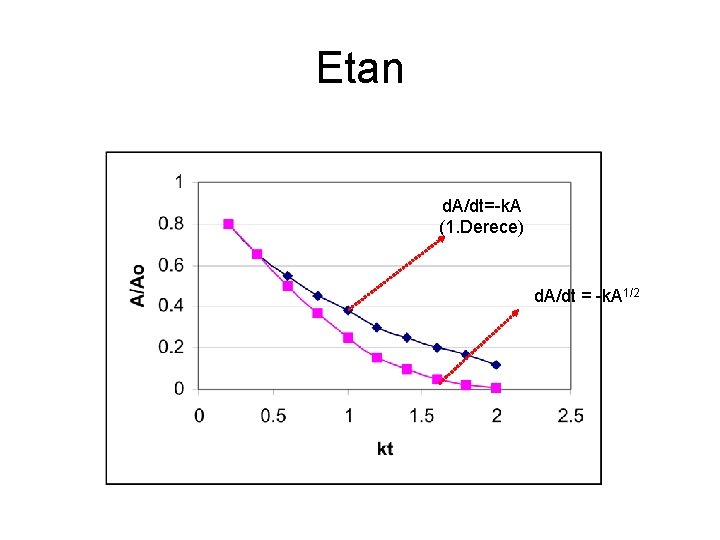
Etan d. A/dt=-k. A (1. Derece) d. A/dt = -k. A 1/2
 Fotoliz ne demek
Fotoliz ne demek Paleozoikte meydana gelen olaylar
Paleozoikte meydana gelen olaylar Yüklenilen kdv
Yüklenilen kdv Hava olaylarının oluşum süreçleri
Hava olaylarının oluşum süreçleri Yapılan ya da olan iş meydana gelen şey
Yapılan ya da olan iş meydana gelen şey Olayn
Olayn 3 tane zn atomu
3 tane zn atomu Kimyasal şift artefaktı
Kimyasal şift artefaktı Huxley'in kayan iplikler modeli
Huxley'in kayan iplikler modeli Snf güvenlik
Snf güvenlik Metallerin özellikleri
Metallerin özellikleri Etks
Etks Deney raporu örneği
Deney raporu örneği Kimyasal kinetik örnek sorular
Kimyasal kinetik örnek sorular Kimyasal boğucu gazlar
Kimyasal boğucu gazlar Depolama matrisi
Depolama matrisi Fiziksel kirlenme
Fiziksel kirlenme Derişimler türünden denge sabiti
Derişimler türünden denge sabiti Validasyon verifikasyon farkı
Validasyon verifikasyon farkı Kimyasal depolama talimatı
Kimyasal depolama talimatı Nfpa etiketleme işaretleme sistemi
Nfpa etiketleme işaretleme sistemi Redoks tepkimesi
Redoks tepkimesi Karışım problemleri formül
Karışım problemleri formül Hypera
Hypera Ergonomi konuları
Ergonomi konuları Hangi kimyasal vücuda emilme yoluyla girer
Hangi kimyasal vücuda emilme yoluyla girer Mekanik ve kimyasal sindirim nedir
Mekanik ve kimyasal sindirim nedir Element bileşik karışım
Element bileşik karışım Kimyasal tepkimelerde hız
Kimyasal tepkimelerde hız Kalsiyum sülfat hemihidrat
Kalsiyum sülfat hemihidrat Kp kc
Kp kc Kimyasal kaynaklı meslek hastalıkları
Kimyasal kaynaklı meslek hastalıkları Yanma tepkimesi
Yanma tepkimesi