ESPECTRO CONTNUO Emitido por slidos incandescentes No apresentam



















- Slides: 24


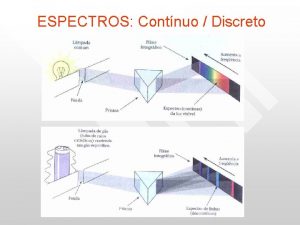
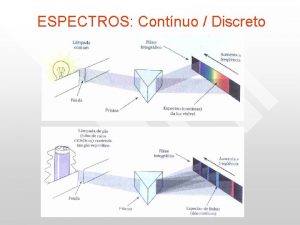
ESPECTRO CONTÍNUO: Emitido por sólidos incandescentes. Não apresentam linhas, mesmo nos espectroscópios de alta resolução.

ESPECTRO DE LINHAS: Emitido por átomos isolados. Por que aparecem as linhas?

ESPECTRO DE BANDAS: Emitido por pedaços de sólidos colocados sobre uma chama ou submetidos à descargas elétricas. Forma bandas, grupos formados por linhas muito próximas, que parecem bandas contínuas quando observadas por espectroscópios de baixa resolução.

As linhas encontradas nos espectros não podem ser explicadas pelas Física Clássica. Por quê? Toda carga acelerada irradia uma onda eletromagnética com freqüência igual a do movimento da carga. Max Planck quantizou a energia irradiada pelas paredes de um corpo negro. Albert Einstein quantizou a energia radiante. Rutherford: em seu modelo, havia um núcleo central carregado positivamente. Ele não dizia nada sobre a massa e carga do elétron. . .

Bohr combina os trabalhos de Planck, Einstein e Rutherford e propõe seu modelo atômico. Niels Bohr supôs que o elétron “orbita” o núcleo, como os planetas ao redor do Sol, sendo a força de atração elétrica a força centrípeta necessária para o movimento circular.


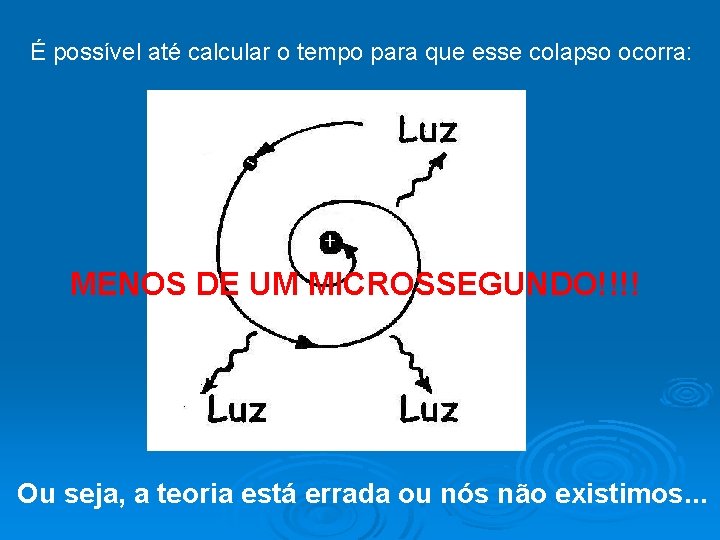
Este modelo é MECANICAMENTE ESTÁVEL, mas é ELETRICAMENTE INSTÁVEL! Vejamos porquê: Toda carga acelerada irradia uma onda eletromagnética com freqüência igual a do movimento da carga. Assim, um elétron orbitando um núcleo deveria perder energia constantemente. Quanto mais o elétron perde energia o raio de sua órbita fica cada vez menor, terminando com o elétron chocando-se com o núcleo!!

É possível até calcular o tempo para que esse colapso ocorra: elétron núcleo MENOS DE UM MICROSSEGUNDO!!!! Ou seja, a teoria está errada ou nós não existimos. . .

Felizmente, não é isso que ocorre! A menos que sejam excitados por algum agente externo, os átomos não irradiam energia. +

Ao serem excitados, irradiam apenas em determinadas freqüências, bem definidas. Totalmente em desacordo com a Física Clássica, que diz que a freqüência da radiação emitida deve ser igual à freqüência de movimento da partícula carregada.

O modelo de Bohr só vale para o Hidrogênio e átomos com a carga +Ze, com um único elétron em órbita (He+, Li 2+) A explicação das linhas espectrais do Hidrogênio foi um dos maiores trunfos da “velha” Mecânica Quântica. Além de fornecer uma explicação boa explicação para os espectros, previu com precisão o comprimento de onda de outras linhas.

Estados de relaxação e excitação Cada gás tem seu próprio padrão. Cada linha corresponde à transição eletrônica entre os níveis atômicos de energia. Por isso podem ser considerados como impressões digitais dos elementos químicos. Fóton: energia eletromagnética emitida, cuja freqüência está relacionada à variação de energia correspondente ao salto. Estas freqüências correspondem às características da luz que é emitida por cada elemento químico.

Cada elemento tem seu próprio padrão característico de camadas eletrônicas (estados de energia) Estes estados possuem apenas determinados valores de energia, por isso são discretos.

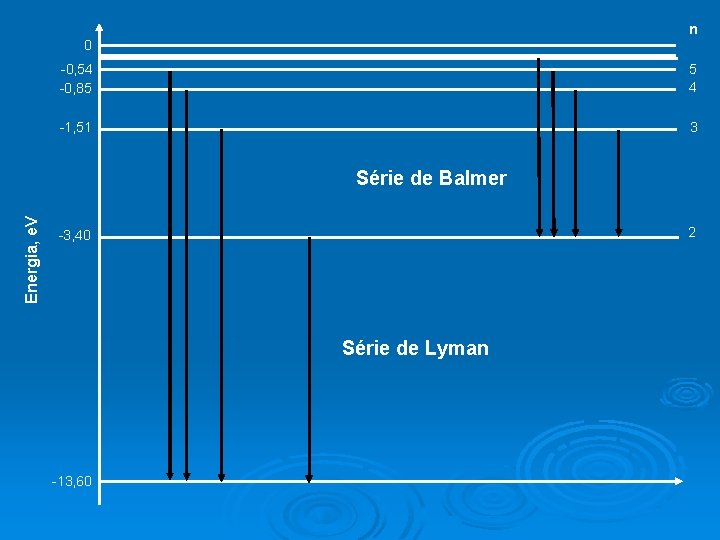
n 0 -0, 54 -0, 85 5 4 -1, 51 3 Energia, e. V Série de Balmer 2 -3, 40 Série de Lyman -13, 60

Usando o modelo de Bohr, calcule o comprimento de onda da linha H , isto é, a segunda linha da série de Balmer. Esta linha está associada à transição de ni = 4 para nf = 2. Lembre-se:

Por que o espectro de emissão tem mais linhas do que o de absorção? ?

Uma lâmpada incandescente comum emite um espectro contínuo. Um filamento de tungstênio faz com que luz e calor sejam emitidos quando percorrido por uma corrente elétrica. Pergunta: Sabemos que o filamento de tungstênio emite uma luz branca. Como será o espectro de emissão se pegarmos esse filamento e o vaporizarmos? Por quê?

Gás: os elétrons realizam transições de nível sem afetar o vizinho Sólidos: elétrons fazem transições entre seus próprios níveis de energia, mas também fazem transições com os vizinhos. O que resulta em infinitas transições possíveis!.

Substituir o gás de uma lâmpada pois a energia de seus átomos tendem a diminuir Com o contínuo processo de excitação/relaxação produzindo uma luz cada vez mais Fraca. E aí? ? Por que no espectro de absorção aparecem as linhas escuras, se a energia logo é Reemitida? Um material fluorescente pode emitir ultravioleta quando irradiado por infravermelho?

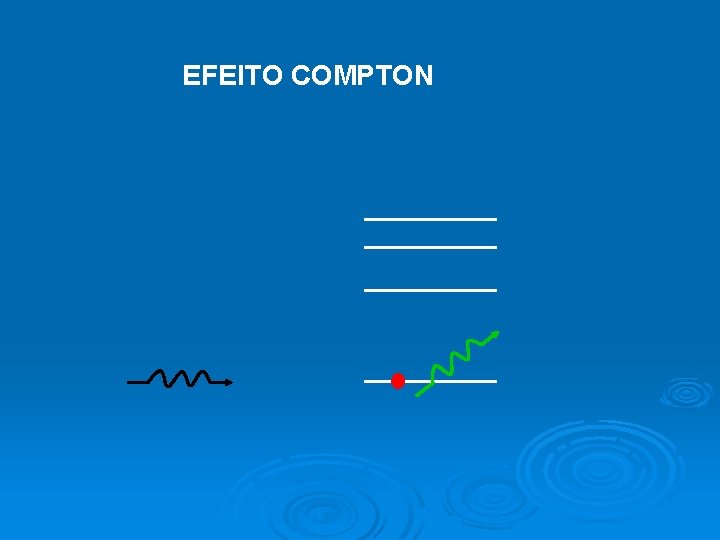
EFEITO COMPTON

EFEITO FOTOELÉTRICO

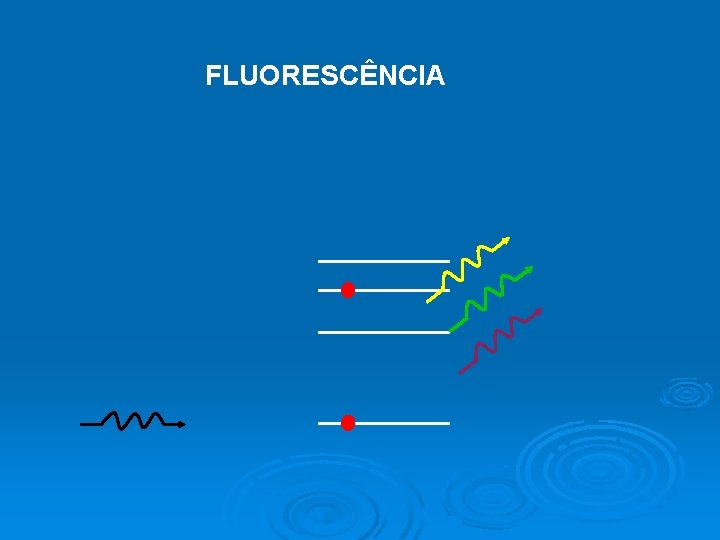
FLUORESCÊNCIA

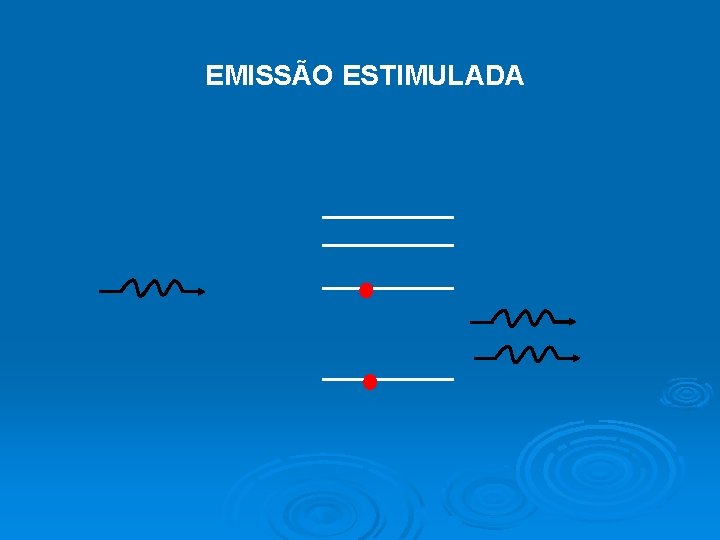
EMISSÃO ESTIMULADA
 El desagradable zumbido emitido por un zancudo
El desagradable zumbido emitido por un zancudo Slidos
Slidos Slidos
Slidos Residuos slidos
Residuos slidos Convolução
Convolução Medicina legista
Medicina legista Antipseudomonas orales
Antipseudomonas orales Espectro continuo
Espectro continuo Carbonila
Carbonila Espectrometro
Espectrometro Espectro de densidad de potencia
Espectro de densidad de potencia Espectro amikacina
Espectro amikacina Ticarcilina
Ticarcilina Fourier
Fourier Espectro luminoso
Espectro luminoso Espectro electromagnetico
Espectro electromagnetico Espectro de luz visivel
Espectro de luz visivel Espectro discreto
Espectro discreto Espectro infrarrojo del acetato de isoamilo
Espectro infrarrojo del acetato de isoamilo Espectro del arcoiris
Espectro del arcoiris Dopler
Dopler Espectro amikacina
Espectro amikacina Deutrio
Deutrio Condensacin
Condensacin Dsm 5 autismo
Dsm 5 autismo