EDUCADOR HENRIQUE CALDAS A Origem dos Elementos INTRODUO

























- Slides: 27

EDUCADOR: HENRIQUE CALDAS

A Origem dos Elementos INTRODUÇÃO Dê uma olhada à sua volta. Tudo que você vê - e não vê - envolve química; seu micro, seu corpo, sua casa, a Terra, o ar, as galáxias. . . A medida que vamos conhecendo a química dos elementos e de seus compostos em laboratório, podemos relacionar esses processos químicos a fenômenos naturais e ao nosso cotidiano. Sabemos que a hemoglobina do sangue contém Ferro (Fe), mas por que não Urânio (U) ou Rutênio (Ru)? Como pode o grafite ser tão diferente do diamante sendo feitos do mesmo elemento, o Carbono (C)? E o Universo, como surgiu? Ainda não temos respostas para todas essas questões; embora o avanço da ciência nos forneça uma teoria bem aceitável. "A história da evolução cósmica teve início em torno de 20 bilhões de anos atrás. A ciência, ao contrário da Bíblia, não tem explicação para a ocorrência desse acontecimento extraordinário". - R. Jastrw, "Until the Sun Dies", Norton, N. Y. , 1997

A Teoria do Big Bang O Big Bang é o momento da explosão que deu origem ao Universo, entre 12 e 15 bilhões de anos. A partir do primeiro centésimo de segundo após a explosão o Universo começou a evoluir. A evolução do Universo teve início, logo após a explosão de uma bola de matéria compacta, densa e quente, com um volume aproximadamente igual ao volume do nosso sistema solar. Essa explosão desencadeou uma série de eventos cósmicos, formando as Galáxias, as Estrelas, os Corpos Planetários e eventualmente, a vida na Terra. Esta evolução é consequência das reações nucleares entre as partículas fundamentais do meio cósmico, cujo efeito mais importante, foi a formação dos elementos químicos, através do processo de nucleosíntese. Pesquisas realizadas nos últimos trinta anos, consideram duas principais fontes responsáveis pela síntese dos elementos químicos: 1. Nucleosíntese durante o Big Bang; 2. Nucleosíntese durante a evolução estelar.


. Nucleosíntese Durante o Big Bang Durante a grande explosão, partículas subatômicas - como nêutrons (1 n), prótons (1 H) e elétrons (e-) - foram geradas. A partir do um centésimo do primeiro segundo, começou o resfriamento e a expansão do Universo, dando condições para as reações nucleares que formaram o elemento hidrogênio (H) e, em seguida o elemento hélio (He). Nucleosíntese Durante a Evolução Estelar Quando um núcleo de uma estrela adquire uma certa quantidade de energia, tem início uma série de reações nucleares. Com o contínuo processo de expansão e resfriamento do Universo, houve várias reações nucleares que se sucederam nas estrelas. Os elementos mais pesados do que o lítio foram sintetizados nas estrelas. Durante os últimos estágios da evolução estelar, muitas das estrelas compactas queimaram e formaram o carbono (C), o oxigênio (O), o silício (Si), o enxofre (S) e o ferro (Fe). Elementos mais pesados do que o ferro foram produzidos de duas maneiras: uma na superfície de estrelas gigantes e outra na explosão de uma estrela super nova. Os destroços destas explosões, sofreram influência de forças gravitacionais e produziram uma nova geração de estrelas. Entretanto nenhum desses destroços foram coletados por um corpo central, alguns são coletados por pequenos corpos que entram em órbita em torno de uma estrela. Estes corpos são os planetas, e um deles é a terra. Toda a matéria na terra, foi formada pelo mecanismo da morte de uma estrela.

HISTÓRICO A primeira classificação, foi a divisão dos elementos em metais e não-metais. Isso possibilitou a antecipação das propriedades de outros elementos, determinando assim, se seriam ou não metálicos. 1ª) Classificação de Döbereiner Entre 1817 e 1829, ele descobriu grupos de três elementos químicos com propriedades químicas semelhantes, recebendo o nome de Tríades de Döbereiner.

2ª) Classificação de Chancourtois Lançado em 1862, ficou conhecido como Parafuso Telúrico de Chancourtois. · Dividiu a superfície de um cilindro em dezesseis partes iguais, atribuindo ao oxigênio a massa atômica 16; · Traçou uma linha com inclinação de 45º ao longo dessa superfície cilíndrica; · Distribuiu os elementos ao longo dessa linha, em ordem crescente das massas atômicas.

3ª) Classificação de Newlands “Quando os elementos são colocados em ordem crescente de massa atômica, suas propriedades se repetem de oito em oito casas, como as notas de uma escala musical”. Em 1864, ficou conhecida como a Lei das Oitavas.

4ª) Classificação de Dmitri Ivanovitch Mendeleev e Julius L. Meyer Em 1869, enunciou a seguinte lei periódica: “as propriedades dos elementos são uma função periódica de suas massas atômicas, isto é, em ordem crescente de massas atômicas. ”

5ª) Classificação de Moseley Em 1913, a lei periódica passou a ter um novo enunciado: “as propriedades dos elementos são uma função periódica de seus números atômicos, isto é, em ordem crescente de números atômicos. ”

6ª) Classificação de Glenn Seaborg (1951) • Nasceu em 1912 em Michigan nos EUA, formou-se em química na Universidade de Berkley, Califórnia e realizou a última maior troca na tabela periódica em 1950. • A partir da descoberta do plutônio em 1940, Seaborg descobriu todos os elementos transurânicos (do número atômico 94 até 102). • Reconfigurou a tabela periódica colocando a série dos actnídeos abaixo da série dos lantanídeos. • Em 1951, Seaborg recebeu o Prêmio Nobel em química, pelo seu trabalho. • O elemento 106 tabela periódica é chamado seabórgio, em sua homenagem

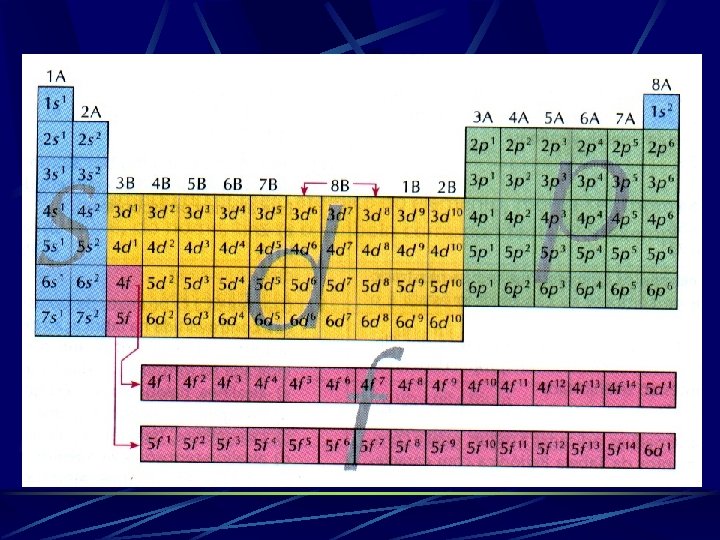
CONSTRUINDO A CLASSIFICAÇÃO PROPRIEDADES QUÍMICAS DEPENDEM CONFIGURAÇÃO ELETRÔNICA DO NÍVEL ENERGIA · Família ou grupo: conjunto de átomos com propriedades químicas semelhantes e mesma configuração eletrônica no último nível de energia. Ex. : Família dos elementos alcalinos. · Período: conjunto de elementos com elétrons dispostos no mesmo número de níveis de energia. Ex. : lítio, berílio, flúor e neônio.


FAMÍLIAS A E ZERO Os elementos que constituem essas famílias são denominados elementos representativos, e seus elétrons mais energéticos estão situados em subníveis s ou p. Nas famílias A, o número da família indica a quantidade de elétrons na camada de valência. Elas recebem ainda nomes característicos.

EXEMPLOS Si (Z = 14): 1 s 2 2 p 6 3 s 2 3 p 2 Família IV A Se ( Z = 34): 1 s 2 2 p 6 3 s 2 3 p 6 3 d 104 s 2 4 p 4 Família VI A

FAMÍLIA NOME CONFIGURAÇÃO DA ÚLTIMA CAMADA COMPONENTES 1 A OU 1 METAIS ALCALINOS ns' Li, Na, K, Rb, Cs, Fr 2 A OU 2 METAIS ALCALINOSTERROSOS ns² Be, Mg, Ca, Sr, Ba, Ra 3 A OU 13 FAMÍLIA DO BORO ns² np' B, Al, Ga, In, Tl 4 A OU 14 FAMÍLIA DO CARBONO ns² np² C, Si, Ge, Sn, Pb 5 A OU 15 FAMÍLIA DO NITROGÊNIO ns² np³ N, P, As, Sb, Bi 6 A OU 16 CALCOGÊNIOS ns² np 4 O, S, Se, Te, Po 7 A OU 17 HALOGÊNIOS ns² np 5 F, Cl, Br, I, At 8 A, 0 OU 18 GASES NOBRES ns² np 6 He, Ne, Ar, Kr, Xe, Rn

FAMÍLIAS B Os elementos dessas famílias são denominados genericamente elementos de transição. Uma parte deles ocupa o bloco central da tabela periódica, de IIIB até IIB (10 colunas), e apresenta seu elétron mais energético em subníveis d (transição ou transição externa).

IIIB IVB VB VIIB VIIIB Exemplo: Fe (Z = 26): 1 s² 2 p 6 3 s² 3 p 6 4 s² 3 d 6 Família: VIIIB IB IIB

A outra parte deles está deslocada do corpo central, constituindo as séries dos lantanídeos e dos actinídeos. Essas séries apresentam 14 colunas. O elétron mais energético está contido em subnível f (f 1 a f 14), transição interna.


PERÍODOS Na tabela atual existem sete períodos, e o número do período corresponde à quantidade de níveis (camadas) eletrônicos que os elementos químicos apresentam. RESUMINDO!!! PERÍODO CORRESPONDE AO NÚMERO DE CAMADAS DO ÁTOMO.

Exemplo: Sódio (Na) – Z = 11 1 s² 2 p 6 3 s¹ Período: 3º Família: IA – Metais Alcalinos

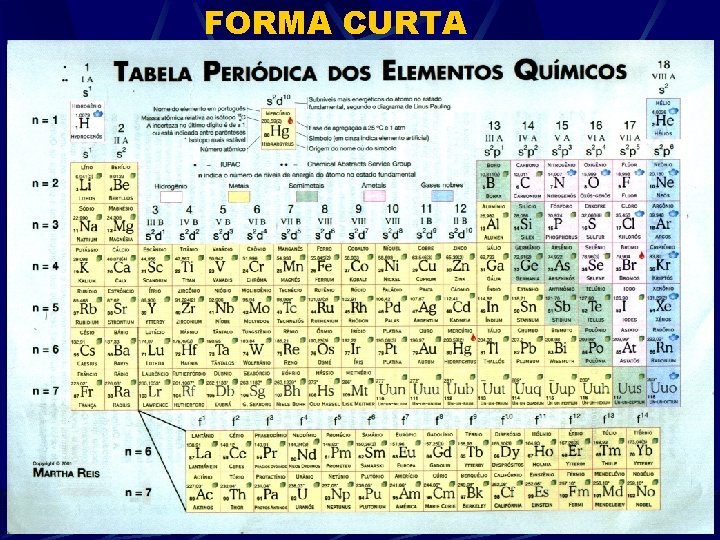
FORMA CURTA

FORMA LONGA


· Metais (76% da tabela): são bons condutores de calor e eletricidade, dúcteis, maleáveis, sólidos em condições ambientes (exceção do mercúrio, Z = 80, que é líquido); · Não-metais ou ametais (11% da tabela): são maus condutores de calor eletricidade, não são dúcteis, nem maleáveis. Sólidos: B, C, Si, P, As, Se, Te, I e At; líquido: Br; Gasosos: N, O, F e Cl; · Gases nobres (6% da tabela): quimicamente inertes. São todos gases em condições ambiente. · Semimetais: esses elementos teriam caractéristicas de metais e ametais, porém hoje já se consegue separá-los corretamente, embora muitos vestibualres ainda utilizam esse classe…(B, Si, ge, As, Sb, Te e Po); Ocorrência dos elementos químicos Temos 88 elementos naturais e 24 artificiais ( cisurânicos : inferior a Z = 92: tecnécio (Tc), astato (At), frâncio (Fr) e promício (Pm); transurânicos : todos aqueles com número atômico superior a 92); São elementos radioativos aqueles que apresentam número atômicos maior ou igual a 84.

“Jamais considere seus estudos como uma obrigação, mas como uma oportunidade invejável para aprender a conhecer a influência libertadora da beleza do reino do espírito, para seu próprio prazer pessoal e para proveito da comunidade à qual seu futuro trabalho pertencer. " Albert Einstein
 Rimas para el dia del maestro cortas
Rimas para el dia del maestro cortas Macmillan profesional
Macmillan profesional Universidad de caldas
Universidad de caldas Esses homens
Esses homens Fotos de poliedros
Fotos de poliedros Quantas vértices
Quantas vértices Henrique inglesa
Henrique inglesa Henrique nono
Henrique nono Qualificadoras objetivas e subjetivas
Qualificadoras objetivas e subjetivas Henrique veiga fernandes
Henrique veiga fernandes Henrique oliveira art
Henrique oliveira art Ato de supremacia de henrique viii
Ato de supremacia de henrique viii Pedro henrique casagrande oliveira
Pedro henrique casagrande oliveira Henrique grunspun
Henrique grunspun Carlos henrique marcondes
Carlos henrique marcondes Ato de supremacia de henrique viii
Ato de supremacia de henrique viii Henrique veiga inventor
Henrique veiga inventor A origem dos continentes
A origem dos continentes Atividade paisagem natural e modificada
Atividade paisagem natural e modificada área lateral do prisma triangular
área lateral do prisma triangular O que é a linha nos elementos da linguagem
O que é a linha nos elementos da linguagem Sustancias puras elementos y compuestos
Sustancias puras elementos y compuestos V
V El que habla dos idiomas vale por dos
El que habla dos idiomas vale por dos Partiendo del mismo lugar dos ciclistas
Partiendo del mismo lugar dos ciclistas El camino estrecho biblia
El camino estrecho biblia Dos reyes dos laberintos
Dos reyes dos laberintos Los envió de dos en dos
Los envió de dos en dos