ELEMENTOS DO GRUPO 17 INTRODUO Os elementos do


















































- Slides: 53

ELEMENTOS DO GRUPO 17 INTRODUÇÃO Os elementos do grupo 17 são denominados halogênios. O nome halogênios significa formadores de sais. A química dos halogênios (exceto o At) provavelmente é melhor compreendida do que a química de qualquer outro grupo excetuando-se os metais alcalinos. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios PROPRIEDADES GERAIS Começamos o estudo dos grupos com o estudo do metais mais reativos – os metais alcalinos. Em contraponto aos metais alcalinos o grupo dos halogênios contém os não metais mais reativos. No grupo dos metais alcalinos a reatividade aumenta a medida que descemos no grupo, no grupo dos halogênios o metal mais reativo fica no topo do grupo. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios PROPRIEDADES GERAIS • Configuração eletrônica externa: ns 2 np 5. • Todos os halogênios têm grandes afinidades eletrônicas. • O estado de oxidação mais comum é -1, mas os estados de oxidação +1, +3, +5 e +7 são possíveis. • Os halogênios são bons agentes de oxidação. • O flúor difere dos demais integrantes do grupo. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios PECULIARIDADES DO ASTATO O astato não ocorre na natureza mais foram obtidos artificialmente mais de vinte isótopos. Os isótopos mais estáveis são o isótopos abaixo: At com meia vida de 8, 3 horas 211 At com meia vida de 7, 5 horas 210 Em síntese todos os isótopos são radioativos. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios Propriedades dos Halogênios TABELA 1 – ALGUMAS PROPRIEDADES DOS HALOGÊNIOS © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios Propriedades dos Halogênios • As propriedades dos halogênios variam regularmente com o seu número atômico. • Cada halogênio é o elemento mais eletronegativo em seu período. • A entalpia de ligação do F 2 é baixa. • Conseqüentemente, o flúor é muito reativo. • O potencial de redução do flúor é muito alto. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios • Propriedades do Halogênios : Raio Atômico • Os raios atômicos aumentam com o aumento do número atômico. Aumenta Z o raio. aumenta o nº de níveis © 2005 by Pearson Education aumenta Capítulo 22

Grupo 17: Halogênios • Propriedades dos Halogênios : Raio Iônico • O raio iônico do cloreto é 38% maior do que o do fluoreto, entretanto o raio iônico do brometo é apenas 6, 5% maior que o do íon cloreto. • A diferença de tamanho em questão deve-se a presença no íon brometo de 10 elétrons “d” que são maus blindadores. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios Propriedades dos Halogênios : Energia de Ionização As energias de ionização dos halogênios mostram a tendência usual. A medida que o tamanho do halogênio aumenta a energia de ionização diminui. Os valores são muito elevados, logo a tendência dos átomos perderem elétrons para formar cátions é pequena. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios Propriedades dos Halogênios : Energia de Ionização A energia de ionização do flúor é consideravelmente maior que a dos demais elementos do grupo, devido ao seu pequeno tamanho. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios Propriedades dos Halogênios: Afinidade Eletrônica As afinidades eletrônicas de todos os halogênios são negativas. Isso implica que há liberação de energia quando um átomo de halogênio recebe um elétron. Portanto todos os halogênios formam o íon haleto. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios Propriedades do Halogênios: Afinidade Eletrônica O cloro tem a maior afinidade eletrônica do grupo. O flúor tem maior dificuldade em receber o elétron que o cloro. A razão da dificuldade maior do flúor de receber um elétron está relacionada ao seu pequeno tamanho que dificulta a acomodação do elétron recebido. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios • Propriedades dos Halogênios: Eletronegatividade Na medida do possível evitamos fazer menção do conceito de eletronegatividade e basear a sistematização da química inorgânica descritiva em grandezas termodinâmicas de definição rígida e de medição independente, tais como energia de ionização, afinidade ao elétron , entalpias de dissociação de ligação, energia de rede, energia de hidratação. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios Propriedades dos Halogênios: Eletronegatividade A base científica dos três métodos empregados para calcular a eletronegatividade (Eletronegatividade de Pauling, χP , Eletronegatividade de Mulliken χM , e Eletronegatividade de Allred –Rochow , χAR ) é algo duvidosa. χ = Letra minúscula do alfabeto grego, pronuncia-se Khi. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios Propriedades dos Halogênios: Entalpia da Ligação Simples Todos os halogênios formam moléculas diatômicas. Espera-se um decréscimo da energia de ligação nas moléculas dos halogênios à medida que o tamanho dos átomos aumenta. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios Propriedades dos Halogênios: Entalpia da Ligação Simples Um aumento do tamanho provoca uma diminuição da eficiência das interações entre os orbitais. As moléculas de dicloro, dibromo e di-iodo seguem a tendência esperada; a molécula de diflúor desvia-se desse comportamento. A energia de ligação da molécula de diflúor é extremamente baixa, sendo um dos principais motivos Capítulo 22 © 2005 by Pearson Education de sua grande reatividade.

Grupo 17: Halogênios Propriedades dos Halogênios: Entalpia da Ligação Simples Há uma repulsão internuclear apreciável, visto que os átomos de flúor são pequenos e a distância F-F também é pequena. Em adição temos ainda intensas repulsões elétron dos pares não ligantes dois átomos de flúor. A repulsão elétron-elétron enfraquece a ligação F-F da molécula de diflúor. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios Propriedades dos Halogênios: Potencial de Redução O potencial de redução da molécula de diflúor é excepcionalmente alto. A habilidade oxidante dos halogênios, indicada por seus potenciais padrão de redução diminui ao se descer no grupo. Em função disso o di-halogênio é capaz de oxidar os íons haletos abaixo dele no grupo. Capítulo 22 © 2005 by Pearson Education

Grupo 17: Halogênios Propriedades dos Halogênios: Potencial de Redução • Exemplo 1: A molécula de dicloro oxidará os íons brometo e iodeto, mas não oxidará o íon fluoreto. • 2 Br-(aq) + Cl 2 (g) → Br 2(l) + • 2 I- (aq) + Cl 2 (g) → I 2(s) + 2 Cl- (aq) • (Obviamente o fluoreto não será oxidado porque o flúor está acima do cloro na coluna 17). © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios Propriedades dos Halogênios: Potencial de Redução Exemplo 2 : A molécula de dibromo oxidará o ânion iodeto? A resposta é afirmativa porque o íon haleto em questão (I-) está abaixo do Bromo na tabela periódica. Teremos a seguinte reação: 2 I- (aq) + © 2005 by Pearson Education Br 2(l) → I 2 (s) + 2 Br -(aq) Capítulo 22

Grupo 17: Halogênios Propriedades dos Halogênios: Potencial de Redução • A água é oxidada mais facilmente do que o flúor, logo o F 2 não pode ser preparado por eletrólise de uma solução de sal porque o flúor é um agente oxidante tão forte que oxidará a água a oxigênio. • Vide a seguir a reação: F 2(aq) + H 2 O(l) → © 2005 by Pearson Education 2 HF(aq) + 1/2 O 2(g) � o=1, 80 V Capítulo 22

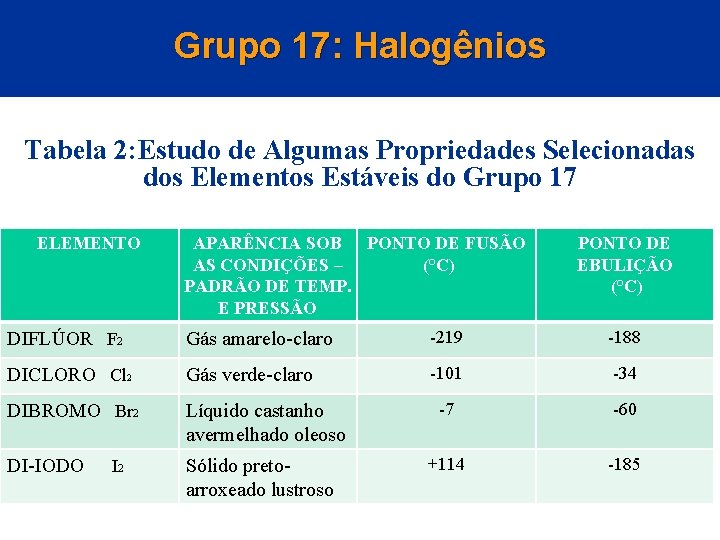
Grupo 17: Halogênios Tabela 2: Estudo de Algumas Propriedades Selecionadas dos Elementos Estáveis do Grupo 17 ELEMENTO APARÊNCIA SOB PONTO DE FUSÃO AS CONDIÇÕES – (°C) PADRÃO DE TEMP. E PRESSÃO PONTO DE EBULIÇÃO (°C) DIFLÚOR F 2 Gás amarelo-claro -219 -188 DICLORO Cl 2 Gás verde-claro -101 -34 DIBROMO Br 2 Líquido castanho avermelhado oleoso -7 -60 DI-IODO Sólido pretoarroxeado lustroso +114 -185 I 2 © 2005 by Pearson Education Capítulo 22

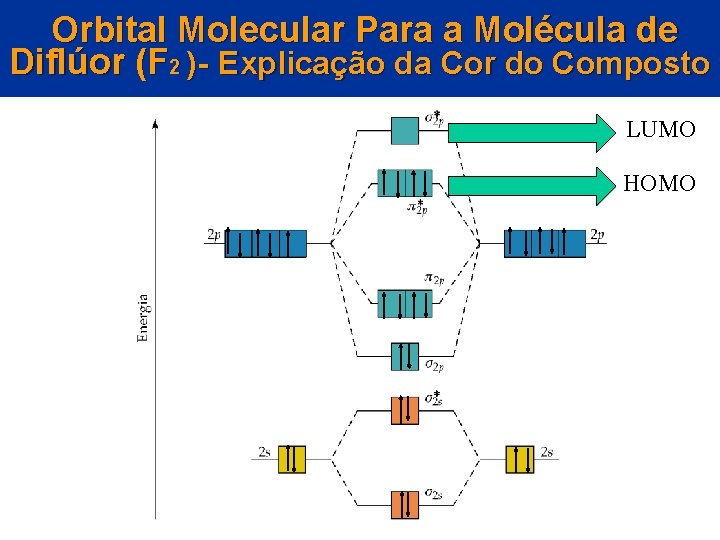
Orbital Molecular Para a Molécula de Diflúor (F 2 )- Explicação da Cor do Composto LUMO HOMO © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios • Propriedades dos Halogênios: Cor No que concerne a cor, as cores observadas nos halogênios provêm de uma transição eletrônica do OM pi asterisco ocupado de mais alta energia para o OM sigma asterisco de mais baixa energia. O intervalo de energia HOMO-LUMO decresce na ordem F 2 > Cl 2 > Br 2 > I 2 © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios Propriedades dos Halogênios: Pontos de Fusão e Ebulição • Quanto aos pontos de fusão e ebulição observamos um aumento regular dessas propriedades. • Como os halogênios diatômicos possuem apenas forças de dispersão de London entre as moléculas, seus PF e PE dependem da polarizabilidade das moléculas uma propriedade que por sua vez é dependente do número total de elétrons. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios Preparação dos Halogênios • O flúor é produzido por oxidação eletrolítica de uma solução de KF em HF anidro • KF(aq) + • 2 KHF 2(l) → HF(g) → KHF 2 (l) H 2 (g) + KF(l) + © 2005 by Pearson Education F 2(g) Capítulo 22

Grupo 17: Halogênios Preparação dos Halogênios Obtenção Industrial do Cloro O Cl 2 é produzido pela eletrólise do Na. Cl fundido ou em solução aquosa. eletrólise Cl 2 + H 2 + 2 OH 2 Cl- + 2 H 2 O • 0 btenção Laboratorial do Cloro Capítulo 22 2005 by Pearson Education • ©Mn. O 2(s) + 2 Cl-(aq) + 4 H+(aq) → Cl 2(g) + Mn 2+(aq) + 2 H 2 O(l)

Grupo 17: Halogênios Preparação dos Halogênios Obtenção Industrial do Bromo • O bromo é obtido industrialmente pela oxidação em meio ácido do íon brometo das águas do mar utilizando-se cloro como agente oxidante • Cl 2(g) + 2 Br- (aq) → 2 Cl-(aq) © 2005 by Pearson Education + Br 2(l) Capítulo 22

Grupo 17: Halogênios Preparação dos Halogênios Obtenção Laboratorial do Bromo Mn. O 2(s) +2 Br-(aq) + 4 H+ (aq) → Br 2(l) + Mn 2+(aq) + 2 H 2 O(l) © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios Preparação dos Halogênios Obtenção Laboratorial do Iodo Mn. O 2(s) + 2 H 2 SO 4(aq) + 2 KI(aq) → Mn. SO 4(aq) + 2 H 2 O(l) + K 2 SO 4(aq) + I 2(s) • Obtenção Industrial do Iodo Oxidação do iodeto com cloro • Cl 2(g) + © 2005 by Pearson Education 2 I- (aq) → 2 Cl- (aq) + I 2(s) Capítulo 22

Grupo 17: Halogênios Preparação dos Halogênios Obtenção Laboratorial do Astato • O At foi sintetizado pela primeira vez pelo bombardeio de bismuto com partículas alfa de alta energia 209 • 83 4 Bi + 2 211 He → © 2005 by Pearson Education 85 At 1 + 2 on Capítulo 22

Grupo 17: Halogênios Preparação dos Halogênios Obtenção do Tennessino • O Tennessino (Ts) Z=117 foi obtido a partir do bombardeio do átomo de Berquélio (Bk) Z=97 com o cátion potássio. • O nome é uma homenagem ao estado americano do Tennessee onde estão sediados o laboratório Ridge e a Universidade Vanderbilt Capítulo 22 ©Nacional 2005 by Pearson. Oak Education

Grupo 17: Halogênios OS HALETOS DE HIDROGÊNIO • O HF tem um alto ponto de ebulição em virtude das fortes ligações de H no líquido. • A facilidade de oxidação aumenta F- > Cl- > Br- > I • Os haletos de hidrogênio podem ser formados pela hidrólise de haletos moleculares: © 2005 by Pearson Education Se. Br 4 (s) + 3 H 2 O (l) H 2 Se. O 3 (aq) + 4 HBr(aq)Capítulo. 22

Grupo 17: Halogênios HALETOS DE HIDROGÊNIO • O HF reage com silicatos (e deve ser armazenado em recipientes de plástico): Si. O 2 (s) + 6 HF (aq) H 2 Si. F 6 (aq) + 2 H 2 O (l) • O Na. I e o Na. Br podem ser oxidados pela adição de ácido sulfúrico. • Após a adição do ácido, o I 2 violeta e o Br 2 amarelo ser. Education claramente vistos. Capítulo 22 ©podem 2005 by Pearson

Grupo 17: Halogênios OS HALETOS DE HIDROGÊNIO A maioria dos haletos de hidrogênio são preparados pelo tratamento do sal com ácido sulfúrico: Ca. F 2(s) + H 2 SO 4(l) 2 HF(g) + Ca. SO 4(s) Na. Cl(s) + H 2 SO 4(l) HCl(g) + Na. HSO 4(s) • Essas reações não podem ser usadas para o preparo de HBr ou HI. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios COMPOSTOS INTER-HALOGÊNIOS • Moléculas diatômicas contendo dois halogênios diferentes são chamadas de compostos interhalogênios. • Os compostos inter-halogênios têm o halogênio mais eletronegativo no estado de oxidação -1 e o outro no estado de oxidação +1. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios COMPOSTOS INTER-HALOGÊNIOS • Existem também compostos inter-halogênios poliatômicos. • A maioria dos inter-halogênios poliatômicos tem Cl, Br, ou I como o átomo central circundado por 3, 5 ou 7 átomos de F. © 2005 by Pearson Education Capítulo 22

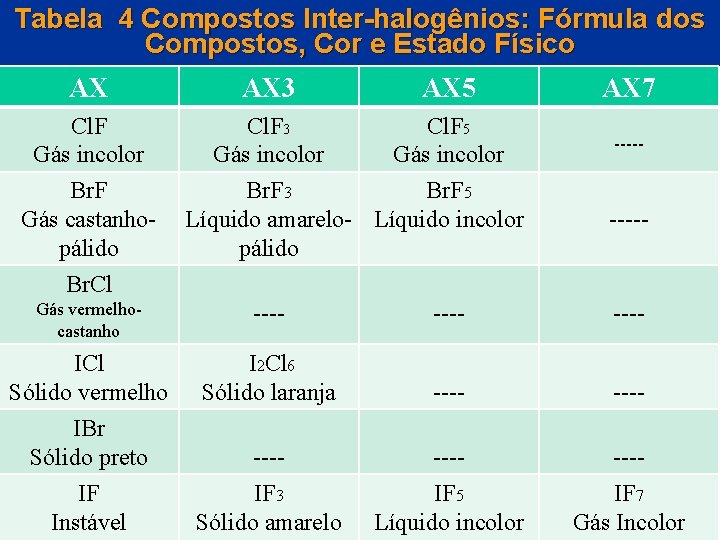
Tabela 4 Compostos Inter-halogênios: Fórmula dos Compostos, Cor e Estado Físico AX Cl. F Gás incolor Br. F Gás castanhopálido AX 3 AX 5 Cl. F 3 Cl. F 5 Gás incolor Br. F 3 Br. F 5 Líquido amarelo- Líquido incolor pálido AX 7 ----- Br. Cl Gás vermelhocastanho ---- ICl Sólido vermelho I 2 Cl 6 Sólido laranja ---- ---IF 5 Líquido incolor ---IF 7 Capítulo 22 Gás Incolor IBr Sólido preto ---IF IF 3 © 2005 by Pearson Education Instável Sólido amarelo

Grupo 17: Halogênios COMPOSTOS INTER-HALOGÊNIOS • Quanto maior é o halogênio, mais compostos interhalogênios ele pode formar (por exemplo, o Br. F 7 não é conhecido). • Dentre os compostos inter-halogênios ICl 3 é o único que tem a propriedade de formar dímeros. O dímero formado o I 2 Cl 6 é um sólido laranja. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios OXIÁCIDOS E OXI NIONS • O flúor forma apenas um oxiácido: HOF ( ácido hipofluoroso). • O oxigênio está no estado de oxidação zero. • A força do ácido aumenta à medida que o estado de oxidação do halogênio aumenta. • Todos são agentes de oxidação fortes. • Todos são instáveis e se decompõem facilmente. • ©Os são mais estáveis do que os oxiácidos. Capítulo 22 2005 oxiânions by Pearson Education

Grupo 17: Halogênios TABELA 3–OXIÁCIDOS HALOGÊNIOS INCLUINDO O Nox A FÓRMULA DO ÁCIDO E O NOME DO ÁCIDO © 2005 by Pearson Education Capítulo 22

Oxiácidos do Cloro Estabilidade e Acidez HCl. O 2 HCl. O 3 HCl. O 4 Cresce a estabilidade Cresce a força do ácido O ácido perclórico é o ácido mais forte e o mais estável dentre os oxiácidos do cloro apresentados. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios • OXIÁCIDOS E OXI NIONS • Os percloratos são particularmente instáveis na presença de material orgânico. • O perclorato de amônio é um potente oxidante. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios OXIÁCIDOS E OXI NIONS • Os ácidos periódico (HIO 4) e paraperiódico (H 5 IO 6) têm o iodo no estado de oxidação +7. • O ácido periódico é um ácido forte, o ácido paraperiódico é um ácido fraco. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios OXIÁCIDOS E OXI NIONS • O grande átomo de iodo permite 6 átomos de oxigênio à sua volta. • Os halogênios menores não conseguem formar esse tipo de composto. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios USOS • Os CFCs são usados como refrigerantes. • Os fluorocarbonos são usados como lubrificantes e plásticos (teflon). • O cloro é usado em plásticos (PVC), no dicloroetano e em outros reagentes químicos orgânicos, na indústria têxtil e de papel. • O Na. OCl é o ingrediente ativo dos alvejantes. • O Na. Br é usado em fotografia. © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios USOS Os sais de hipoclorito são usados em alvejantes e desinfetantes. • Na presença de alumínio em pó, o NH 4 Cl. O 3 é usado para o lançamento de ônibus espaciais. • Cada lançamento utiliza 700 toneladas de clorato de amônio. Capítulo 22 © 2005 by Pearson Education

Grupo 17: Halogênios USOS • O cloro é o halogênio mais importante comercialmente. São produzidas anualmente nos EUA cerca de 12 milhões de toneladas de cloro. Cerca da metade desse cloro é utilizada eventualmente na fabricação de compostos orgânicos contendo cloro como o cloreto de vinila. O cloreto de vinila é usado na fabricação de plástico de polivinila (PVC). Capítulo 22 ©de 2005 cloreto by Pearson Education

Grupo 17: Halogênios USOS • O cloro é usado também no tratamento de água para oxidar e destruir bactérias. • Um uso comum do iodo é como KI no sal de cozinha. • A falta de iodo na alimentação resulta no crescimento da glândula tireóide (bócio) © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios USOS O íon fluoreto é usado na água potável para reduzir a cárie dental. O dióxido de cloro é um agente oxidante poderoso, usado como alvejante de polpa de papel. (o processo de alvejamento consiste, geralmente, na oxidação de compostos orgânicos coloridos formando produtos incolores ou menos intensamente coloridos). © 2005 by Pearson Education Capítulo 22

Grupo 17: Halogênios – Estrutura Molecular de Alguns Compostos ÁCIDO PARAPERIÓDICO - H 5 IO 6 O ácido paraperiódico (ortoperiódico) apresenta o átomo de iodo central octaédrico e a presença de 5 grupos O-H por molécula leva a uma extensa hidrogênica intermolecular no estado sólido. Capítulo 22 © 2005 byligação Pearson Education

Grupo 17: Halogênios – Estrutura Molecular de Alguns Compostos Estrutura do ácido HOF ácido hipofluoroso É um agente oxidante forte. É instável decompondo-se em HF e O 2 Capítulo 22 © 2005 by Pearson Education

Grupo 17: Halogênios – Estrutura Molecular de Alguns Compostos Monóxido de dicloro - Cl 2 O Reage com a água formando HOCl Gás amarelo-castanho , muito solúvel em água e obtido pela reação Capítulo 22 © 2005 by Pearson Education do dicloro com o óxido de mercúrio (II)