DETERMINAZIONE DEI GRASSI GREGGI SCOPO determinare il contenuto



















- Slides: 34

DETERMINAZIONE DEI GRASSI GREGGI SCOPO: determinare il contenuto in sostanze solubili in etere di petrolio (40 -60 °C) CAMPO DI APPLICAZIONE: vengono estratti lipidi, pigmenti, fosfolipidi, cere, steroli, resine e vitamine liposolubili. PRINCIPIO DEL METODO: estrazione e distillazione continuata per 6 ore; nel caso di materie prime le cui materie grasse non possono essere completamente estratte con etere, si procede ad idrolisi a caldo con HCl 3 N per 1 ora prima di effettuare l’estrazione. GRASSI SAPONIFICABILI (trigliceridi, digliceridi, monogliceridi, ac. grassi liberi): saponificazione con KOH N/2 ed estrazione. GRASSI NON SAPONIFICABILI: sono esclusi da una valutazione strettamente nutrizionale; hanno però un valore extranutrizionale (es. colesterolo, vit. liposolubili, cere, fosfolipidi).

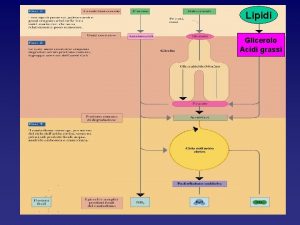
CLASSIFICAZIONE DEI LIPIDI Lipidi Esteri del glicerolo Semplici Non gliceridi Complessi Sfingomieline Glicolipidi Fosfogliceridi Cerebrosidi Cere Steroidi Terpeni Trigliceridi Glucolipidi Galattolipidi Lecitine Cefaline Prostaglandine

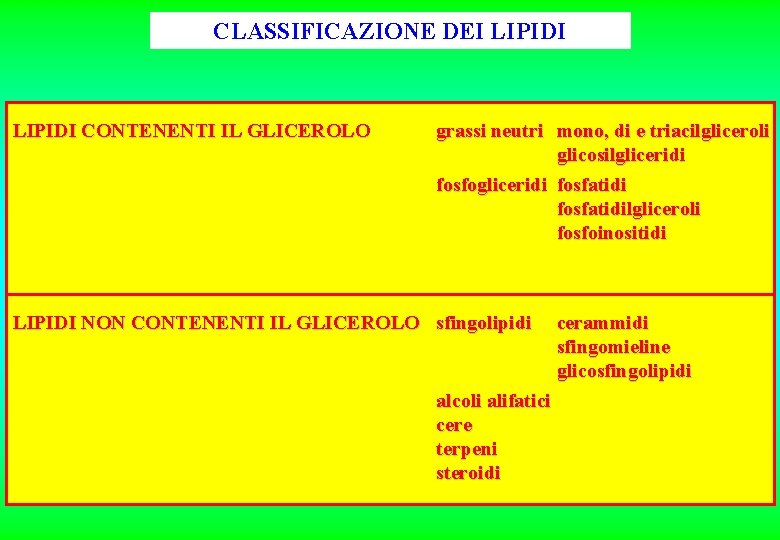
CLASSIFICAZIONE DEI LIPIDI CONTENENTI IL GLICEROLO grassi neutri mono, di e triacilgliceroli glicosilgliceridi fosfogliceridi fosfatidilgliceroli fosfoinositidi LIPIDI NON CONTENENTI IL GLICEROLO sfingolipidi alcoli alifatici cere terpeni steroidi cerammidi sfingomieline glicosfingolipidi

PRINCIPALI FUNZIONI DEI LIPIDI NEGLI ORGANISMI ANIMALI (in ordine quantitativo) v. ENERGETICA elevata resa energetica (alto rapporto H/O della loro struttura) deposizione nei tessuti in grande quantità ridotta azione dinamico specifica v. STRUTTURALE costituzione delle membrane cellulari v. FUNZIONALE precursori di prostaglandine e leucotrieni

ACIDI GRASSI CHE ENTRANO NELLA COMPOSIZIONE DEI LIPIDI Sono: MONOCARBOSSILICI A CATENA RETTILINEA A NUMERO PARI DI ATOMI DI C Si differenziano: a) in base al numero di atomi di C in: 1) a corta catena (1 4) 2) a media catena (5 10) 3) a lunga catena (> 12) b) in base alla presenza o meno di doppi legami: 1) saturi 2) insaturi ( monoinsaturi e polinsaturi)

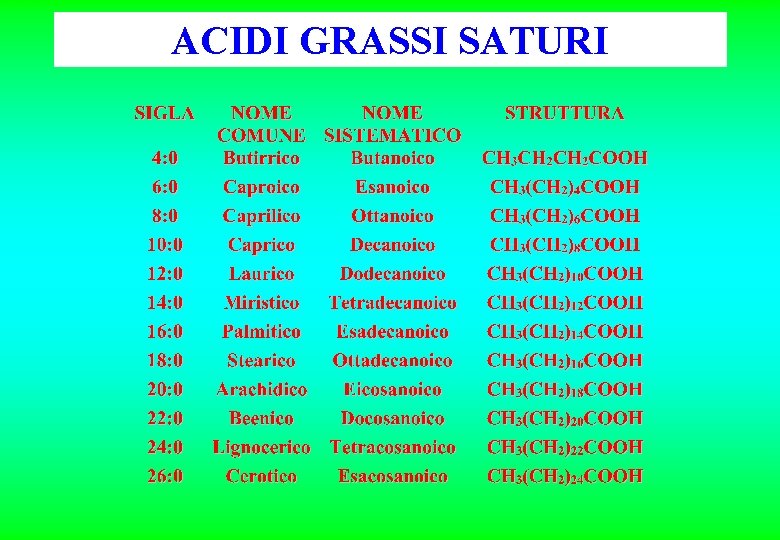
ACIDI GRASSI SATURI

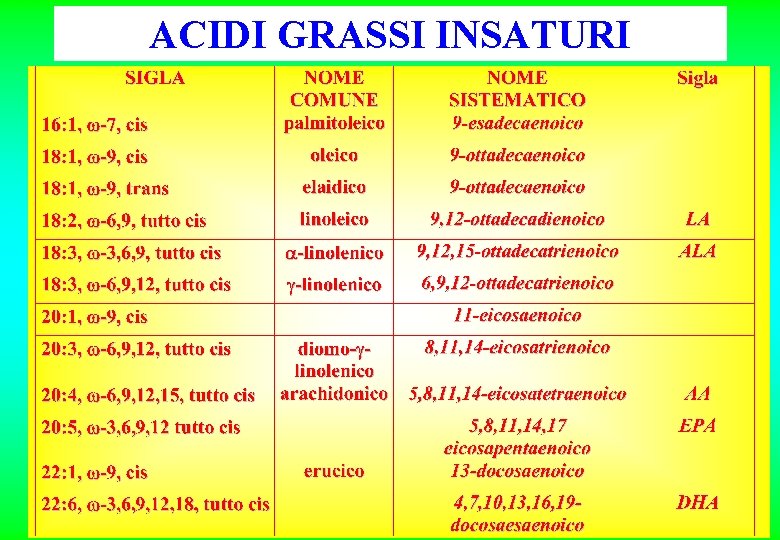
ACIDI GRASSI INSATURI

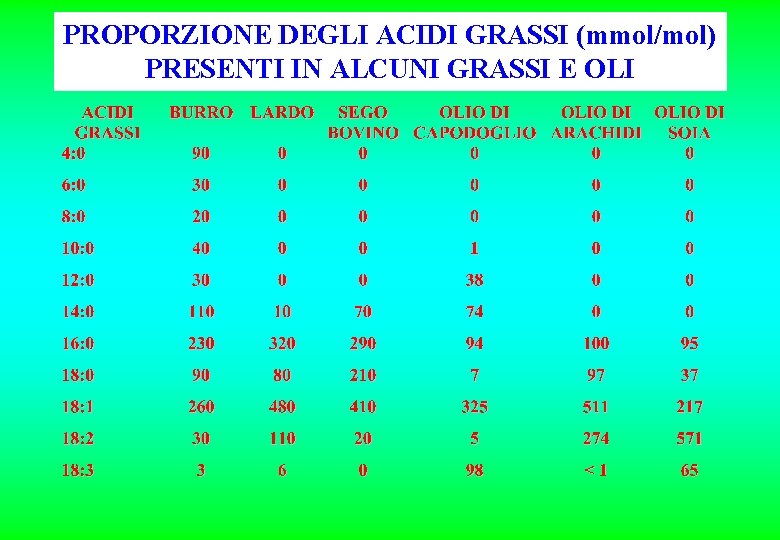
PROPORZIONE DEGLI ACIDI GRASSI (mmol/mol) PRESENTI IN ALCUNI GRASSI E OLI

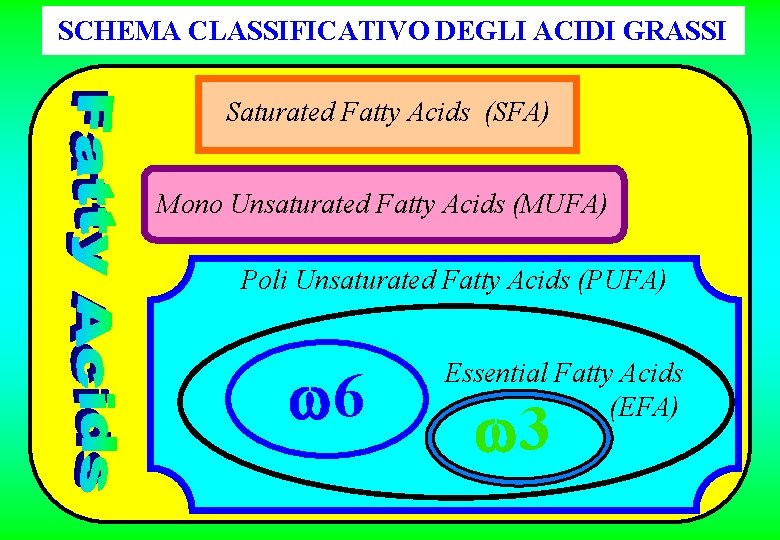
SCHEMA CLASSIFICATIVO DEGLI ACIDI GRASSI Saturated Fatty Acids (SFA) Mono Unsaturated Fatty Acids (MUFA) Poli Unsaturated Fatty Acids (PUFA) 6 Essential Fatty Acids (EFA) 3

ASPETTO FISICO: PUNTO DI FUSIONE Il PUNTO DI FUSIONE DI UN LIPIDE È TANTO PIÙ ELEVATO QUANTO MAGGGIORE È IL GRADO DI “SATURAZIONE” DEGLI ACIDI GRASSI CHE LO COSTITUISCONO OVVERO LA FLUIDITÀ DI UN LIPIDE È TANTO PIÙ ELEVATA QUANTO MAGGGIORE È IL GRADO DI “INSATURAZIONE” DEGLI ACIDI GRASSI CHE LO COSTITUISCONO Ordine di grandezza dei punti di fusione di alcuni lipidi OLII (lipidi liquidi a temperatura ambiente = 25°C) < 36°C STRUTTO (suino; lipidi fusi, soldidi a temperatura ambiente) 36 - 40°C SEGO (Bovino; lipidi crudi, soldidi a temperatura ambiente) > 40°C

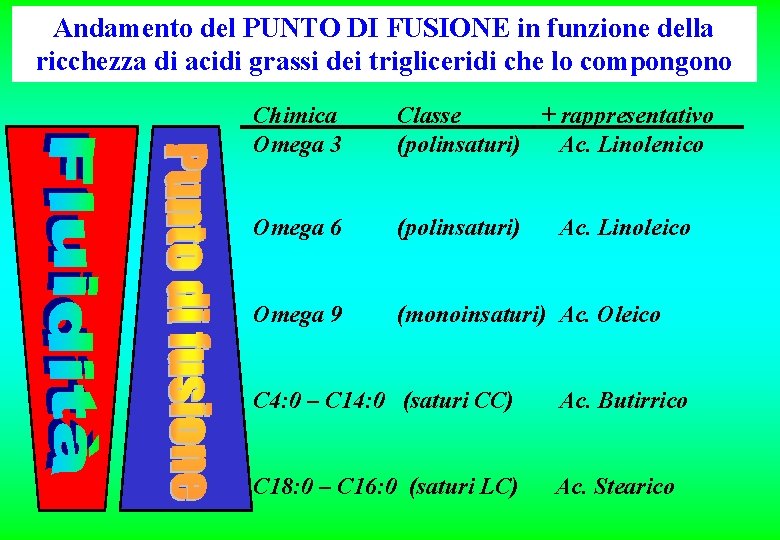
Andamento del PUNTO DI FUSIONE in funzione della ricchezza di acidi grassi dei trigliceridi che lo compongono Chimica Omega 3 Classe + rappresentativo (polinsaturi) Ac. Linolenico Omega 6 (polinsaturi) Omega 9 (monoinsaturi) Ac. Oleico Ac. Linoleico C 4: 0 – C 14: 0 (saturi CC) Ac. Butirrico C 18: 0 – C 16: 0 (saturi LC) Ac. Stearico

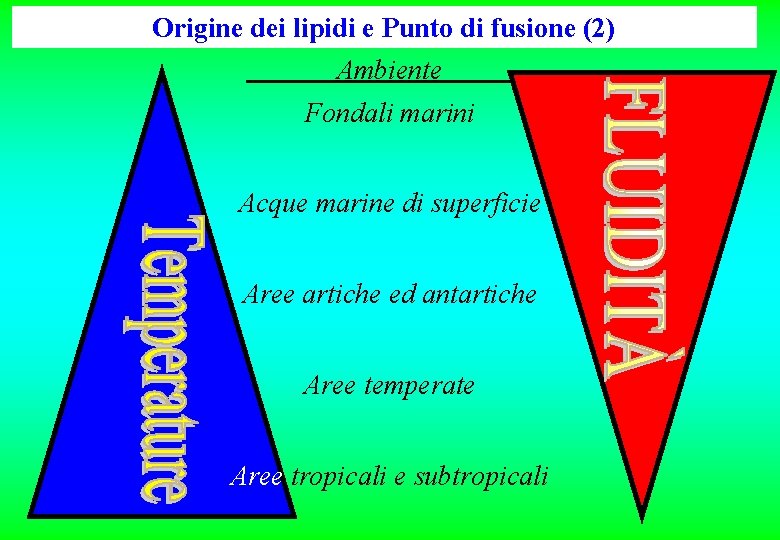
Origine dei lipidi e Punto di fusione Sia nel mondo vegetale che in quello animale, l’ambiente ed in particolare la temperatura del microclima in cui vive ciascun organismo è la principale causa di “selezione” degli individui riguardo le caratteristiche dei lipidi.

A basse temperature è necessaria una notevole fluidità per garantire la funzionalità dei lipidi di membrana

Ad alte temperature è prioritaria la resistenza all’ossidazione

Origine dei lipidi e Punto di fusione (2) Ambiente Fondali marini Acque marine di superficie Aree artiche ed antartiche Aree temperate Aree tropicali e subtropicali

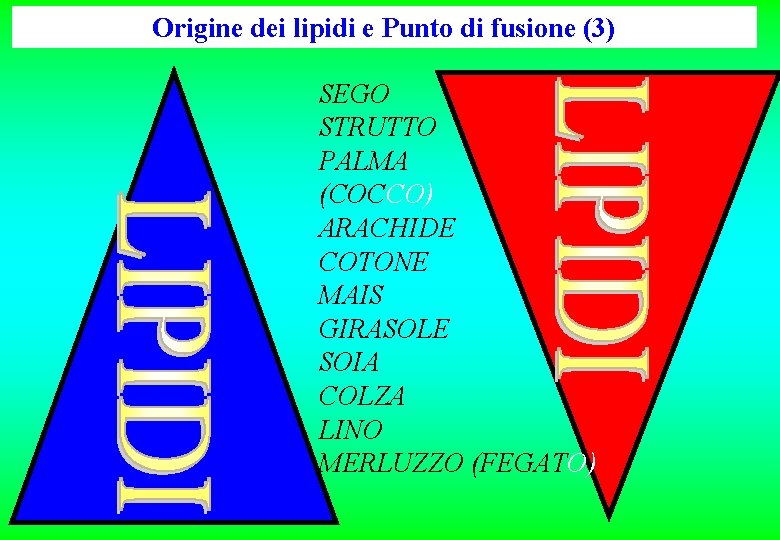
Origine dei lipidi e Punto di fusione (3) SEGO STRUTTO PALMA (COCCO) ARACHIDE COTONE MAIS GIRASOLE SOIA COLZA LINO MERLUZZO (FEGATO)

GLI ATOMI DI CARBONIO NELLA CATENA SONO NUMERATI A PARTIRE DAL COOH TERMINALE E LA POSIZIONE DEI DOPPI LEGAMI SI ESPRIME CON SEGUITO DA UN NUMERO (es. 9 significa che il doppio legame si trova fra il carbonio 9 e 10). GLI ACIDI GRASSI INOLTRE SI DIVIDONO IN GRUPPI CHE VENGONO DEFINITI CON LA SIGLA O n SEGUITA DA UN NUMERO CHE ESPRIME LA POSIZIONE DELL’ULTIMO DOPPIO LEGAME, CONTATO A PARTIRE DAL CARBONIO DEL CH 3. C 18: 2 n/ 6 ACIDO LINOLEICO C 18: 2 9, 12 H 3 C 3 8 6 n, 12 7 9 6 4 2 9 10 COOH

ACIDI GRASSI ESSENZIALI (EFA) v 6: C 18: 2 acido linoleico, C 18: 3 acido -linolenico, C 20: 4 acido arachidonico, v 3 C 18: 3 acido linolenico, C 20: 5 acido eicosapentaenoico (EPA), C 22: 5 acido docosapentaenoico (DPA), C 22: 6 acido docosaesanoico (DHA).

RUOLI BIOLOGICO DEGLI ACIDI GRASSI 3 • 1. 2. 3. • 1. Ruoli strutturali: Costituzione dei fosfolipidi dei sinaptosomi cerebrali, delle fibre nervose, della retina; Ruoli funzionali: Precursori delle prostaglandine della serie 3.

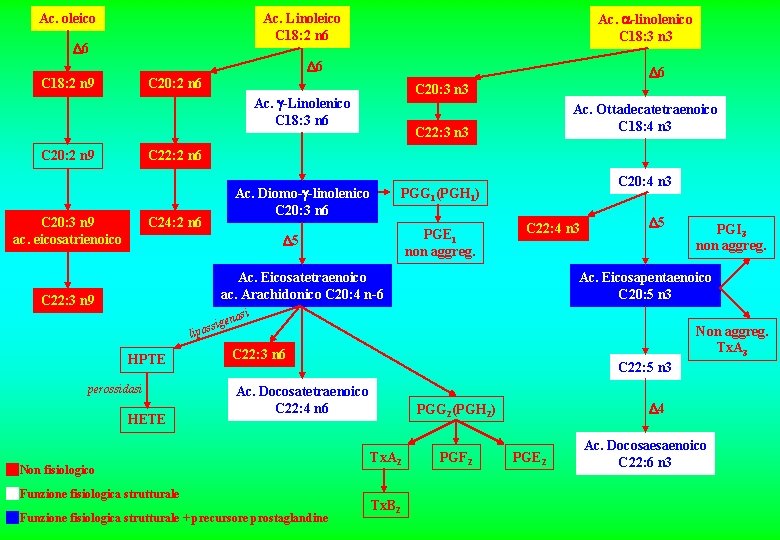
METABOLISMO DELL’ACIDO LINOLEICO (18: 2 9, 12; 18: 2 n-6) x x 18: 2 n-6 * 6 18: 3 n-6 20: 2 n-6 * 5 20: 4 n-6 22: 2 n-6 22: 4 n-6 24: 2 n-6 funzione fisiologica strutturale non fisiologico x non biosintetizzabile x * precursore delle prostaglandine 4 22: 3 n-6 22: 5 n-6

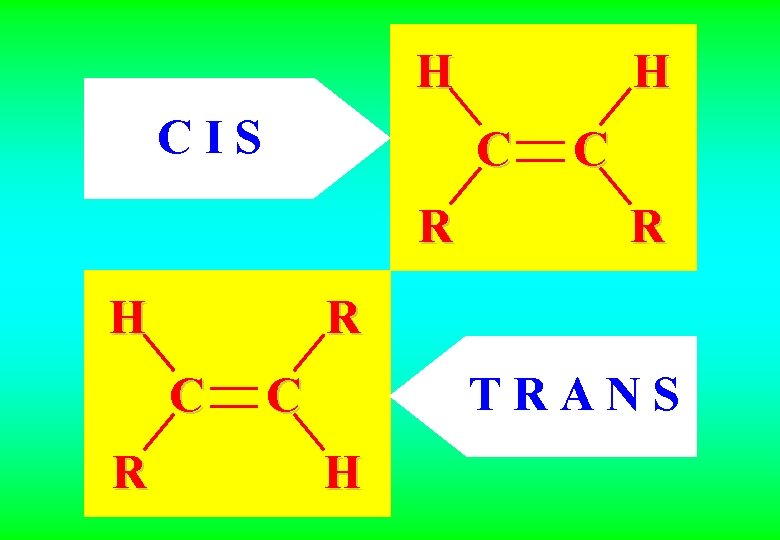
H C I S C R H C R R C R H T R A N S C H

METABOLISMO DELL’ACIDO -LINOLENICO (18: 3 9, 12, 15; 18: 3 n-3) x x 18: 3 n-3 * 6 18: 4 n-3 20: 3 n-3 * 5 20: 5 n-3 22: 3 n-3 22: 5 n-3 22: 4 n-3 funzione fisiologica strutturale non fisiologico x non biosintetizzabile x * precursore delle prostaglandine 4 22: 6 n-3

Ac. oleico Ac. Linoleico C 18: 2 n 6 6 Ac. -linolenico C 18: 3 n 3 6 C 18: 2 n 9 6 C 20: 2 n 6 C 20: 3 n 3 Ac. -Linolenico C 18: 3 n 6 C 20: 2 n 9 Ac. Ottadecatetraenoico C 18: 4 n 3 C 22: 3 n 3 C 22: 2 n 6 C 20: 3 n 9 ac. eicosatrienoico C 24: 2 n 6 Ac. Diomo- -linolenico C 20: 3 n 6 C 20: 4 n 3 PGG 1(PGH 1) PGE 1 non aggreg. 5 C 22: 4 n 3 Ac. Eicosatetraenoico ac. Arachidonico C 20: 4 n-6 C 22: 3 n 9 5 Ac. Eicosapentaenoico C 20: 5 n 3 asi n sige s o p li HPTE perossidasi HETE Non aggreg. Tx. A 3 C 22: 3 n 6 C 22: 5 n 3 Ac. Docosatetraenoico C 22: 4 n 6 Non fisiologico Funzione fisiologica strutturale + precursore prostaglandine PGI 3 non aggreg. 4 PGG 2(PGH 2) Tx. A 2 Tx. B 2 PGF 2 PGE 2 Ac. Docosaesaenoico C 22: 6 n 3

LE ATTIVITÀ ENZIMATICHE DESATURASI - ELONGASI desaturasi: 9, 6, 5, 4. Non vi sono 12 o 15 desaturasi ed è per questo che dall’acido oleico non si può sintetizzare il linoleico ed il linolenico Non si sa quali meccanismi ne influenzino precisamente l’attività ma sembra essere favorita da diete ricche di proteine e relativamente povere di carboidrati. Dal punto di vista endocrino sarebbe favorita dall’insulina e sfavorita dal glucagone. Non si conoscono situazioni limitanti all’attività elongasica.


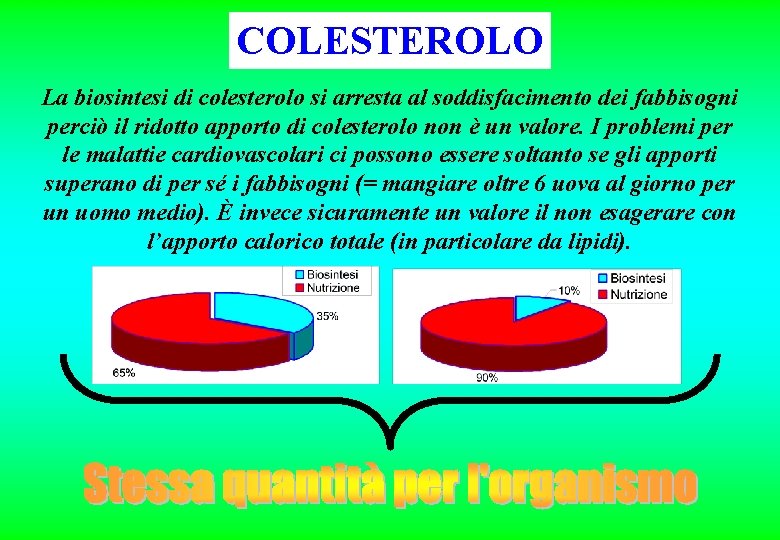
COLESTEROLO La biosintesi di colesterolo si arresta al soddisfacimento dei fabbisogni perciò il ridotto apporto di colesterolo non è un valore. I problemi per le malattie cardiovascolari ci possono essere soltanto se gli apporti superano di per sé i fabbisogni (= mangiare oltre 6 uova al giorno per un uomo medio). È invece sicuramente un valore il non esagerare con l’apporto calorico totale (in particolare da lipidi).

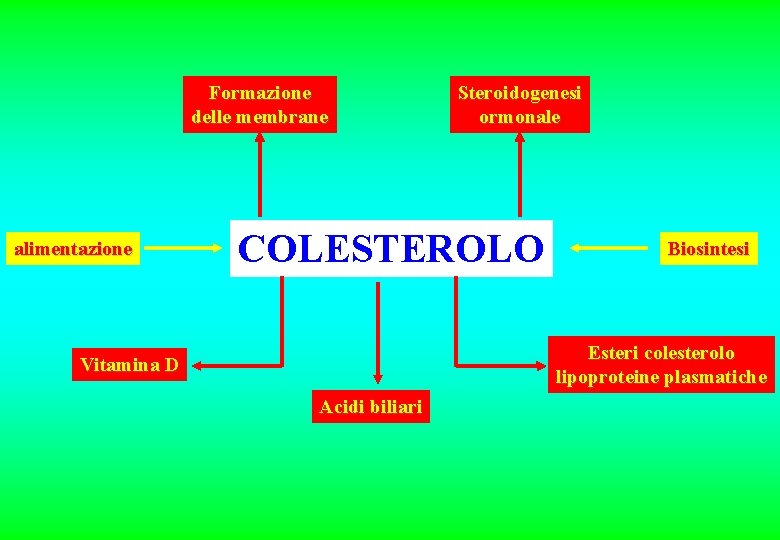
Formazione delle membrane alimentazione Steroidogenesi ormonale COLESTEROLO Biosintesi Esteri colesterolo lipoproteine plasmatiche Vitamina D Acidi biliari

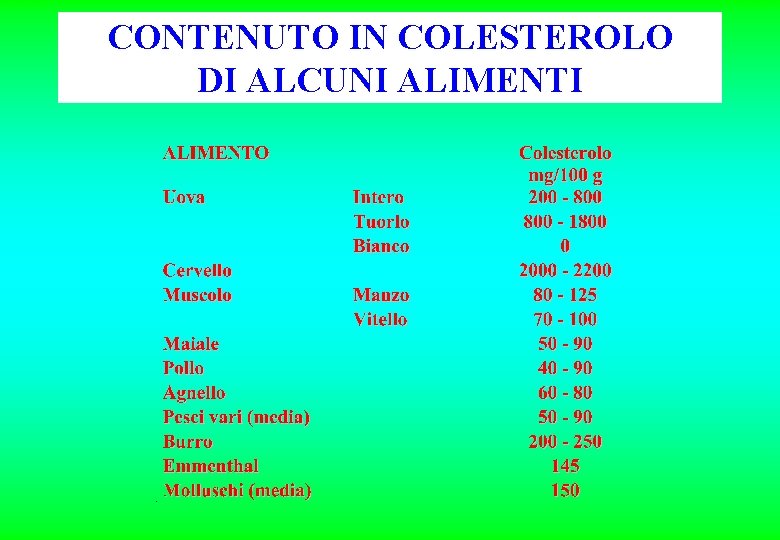
CONTENUTO IN COLESTEROLO DI ALCUNI ALIMENTI

L’AUTOSSIDAZIONE DEI GRASSI FATTORI INTRINSECI FATTORI ESTRINSECI insaturazione luce catalizzatori temperatura ossigeno pressione O 2

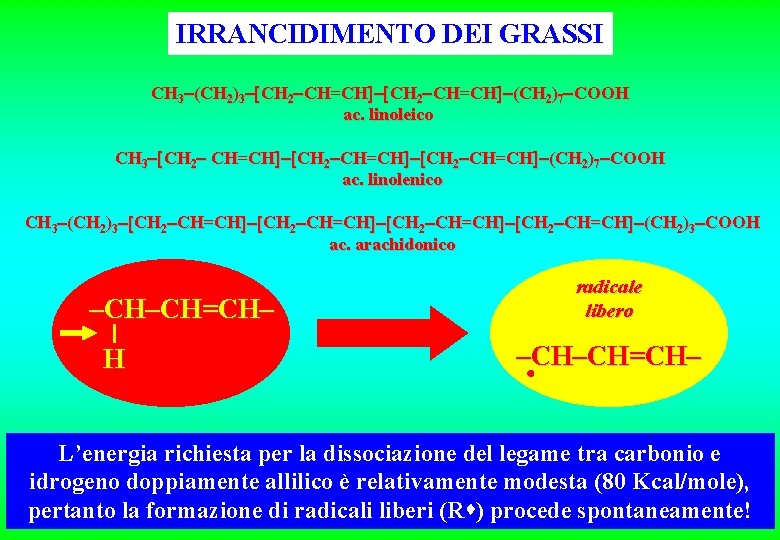
IRRANCIDIMENTO DEI GRASSI CH 3 (CH 2)3 CH 2 CH=CH (CH 2)7 COOH ac. linoleico CH 3 CH 2 CH=CH (CH 2)7 COOH ac. linolenico CH 3 (CH 2)3 CH 2 CH=CH (CH 2)3 COOH ac. arachidonico –CH–CH=CH– H radicale libero –CH–CH=CH– L’energia richiesta per la dissociazione del legame tra carbonio e idrogeno doppiamente allilico è relativamente modesta (80 Kcal/mole), pertanto la formazione di radicali liberi (R ) procede spontaneamente!

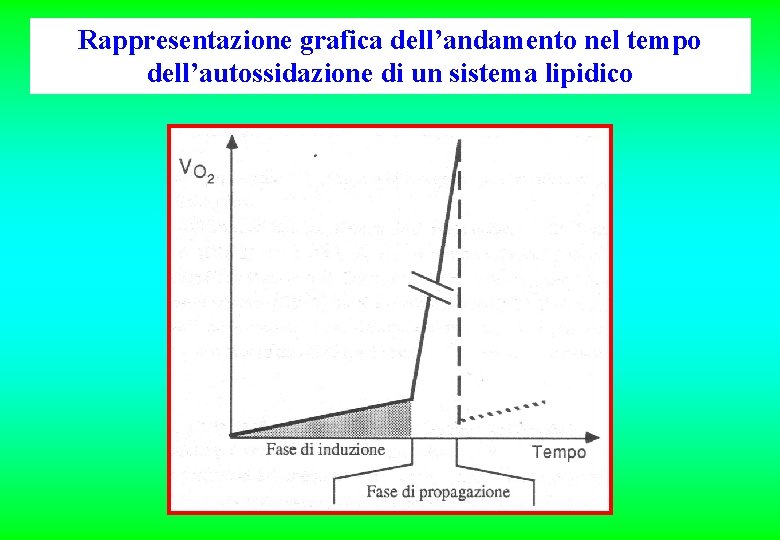
Rappresentazione grafica dell’andamento nel tempo dell’autossidazione di un sistema lipidico

MEZZI PER PREVENIRE L’AUTOSSIDAZIONE DELLE SOSTANZA GRASSE 1. ELIMINAZIONE O RIDUZIONE DEI FATTORI CHE FAVORISCONO L’INIZIAZIONE E LA PROPAGAZIONE DELLE REAZIONI DI PEROSSIDAZIONE. Tra questi fattori i principali sono: - pressione parziale dell’ossigeno (esposizione all’aria); - temperatura ed umidità; - radiazioni luminose e ionizzanti (esposizione alla luce); - presenza di enzimi (lipasi e lipossigenasi); - presenza di oligoelementi (in particolare Fe e Cu); - presenza di pigmenti (perché di natura lipidica). 2. IMPIEGO DI ANTIOSSIDANTI

ANTIOSSIDANTI Naturali lipofili: polifenoli Vitamina E, carotenoidi, Naturali idrofili: Acido ascorbico; Artificiali lipofili BHT, BHA (solidi), etossichina (liquida), gallato di propile.

VALUTAZIONE DEI GRASSI v. Punto di fusione v. Umidita’ v. Impurita’ v. Sostanze insaponificabili vn° di iodio (presenza di doppi legami) v. Acidita’ v. Grado di stabilita’ v. N° di perossidi v. Composizione % in acidi grassi v. TBARS (presenza di aldeidi e chetoni), v. Saggio di Kreiss
 Grassi greggi
Grassi greggi Determinazione dei cloruri
Determinazione dei cloruri Periodo funzione goniometrica
Periodo funzione goniometrica Determinazione del prezzo
Determinazione del prezzo Determinazione attività enzimatica spettrofotometro
Determinazione attività enzimatica spettrofotometro Piano formativo esempio
Piano formativo esempio Peso specifico latte
Peso specifico latte Determinazione del prezzo
Determinazione del prezzo Titolazione aceto commerciale
Titolazione aceto commerciale Determinazione del prezzo
Determinazione del prezzo Determinazione ferro nelle acque
Determinazione ferro nelle acque Bilancio forma abbreviata schema
Bilancio forma abbreviata schema Libro inventari contenuto
Libro inventari contenuto Analisi del contenuto
Analisi del contenuto Ideazione anancastica
Ideazione anancastica Caratteristiche testo argomentativo
Caratteristiche testo argomentativo La struttura del testo poetico
La struttura del testo poetico Sinalefe
Sinalefe Frase subordinata significato
Frase subordinata significato Tipi di strofe
Tipi di strofe Accoglienza testo argomentativo
Accoglienza testo argomentativo Complemento di mezzo
Complemento di mezzo Complemento di fine o scopo
Complemento di fine o scopo Il testo descrittivo ha lo scopo di mostrare
Il testo descrittivo ha lo scopo di mostrare Complemento di fine o scopo
Complemento di fine o scopo Scopo la prof
Scopo la prof Testo narrativo scopo
Testo narrativo scopo Parole poetiche per la loro forma grafica
Parole poetiche per la loro forma grafica Istituto comprensivo grassi fiumicino
Istituto comprensivo grassi fiumicino Tullio grassi
Tullio grassi Pyloroplastie selon finney
Pyloroplastie selon finney Tabella formaggi grassi e magri
Tabella formaggi grassi e magri Giorgio grassi teatro romano di sagunto
Giorgio grassi teatro romano di sagunto I sali biliari emulsionano i grassi
I sali biliari emulsionano i grassi Pyloro duodenotomy
Pyloro duodenotomy