Esperienza 3 Determinazione del grado di acidit di


![Curve di titolazione p. H = 14+log[OH-] ü Acido forte titolato da base forte Curve di titolazione p. H = 14+log[OH-] ü Acido forte titolato da base forte](https://slidetodoc.com/presentation_image_h2/535c3f3c9a777cb4ec29d789c52ff45a/image-6.jpg)





- Slides: 22

Esperienza 3: Determinazione del grado di acidità di un aceto commerciale Titolazione: procedimento analitico per determinare la concentrazione (titolo) di un componente (analita) in una soluzione per mezzo di una reazione stechiometrica in cui il titolante reagisce con l’analita. Caratteristiche di una reazione utilizzata per titolare: - completa - a stechiometria definita - veloce - la fine della reazione deve essere chiaramente rilevabile 1

A seconda delle caratteristiche chimiche dell’analita, si usano reazioni di tipo diverso: • Titolazioni acido-base • Titolazioni redox • Titolazioni di precipitazione • Titolazioni complessometriche Inoltre diversi metodi di rilevazione possono essere applicati alle titolazioni: o Titolazione volumetrica con utilizzo di indicatore o Titolazione spettrofotometrica o Titolazioni conduttimetriche, potenziometriche, voltammetriche, coulometriche o amperometriche o Titolazioni radiochimiche o Titolazioni calorimetriche 2

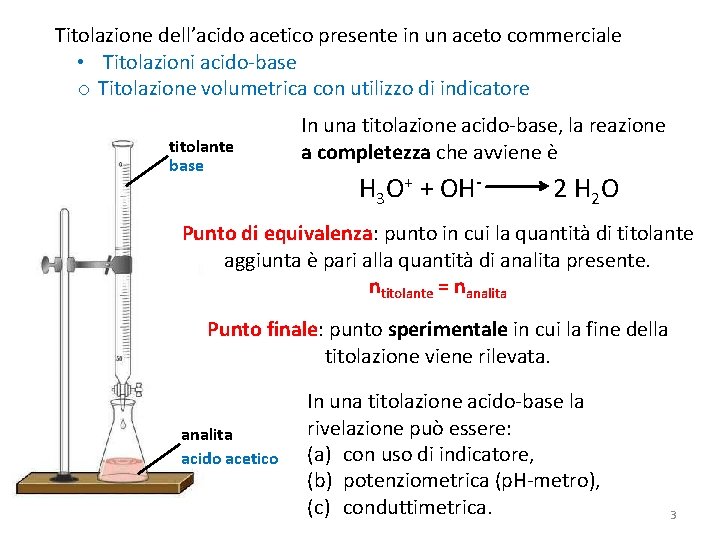
Titolazione dell’acido acetico presente in un aceto commerciale • Titolazioni acido-base o Titolazione volumetrica con utilizzo di indicatore titolante base In una titolazione acido-base, la reazione a completezza che avviene è H 3 O+ + OH- 2 H 2 O Punto di equivalenza: punto in cui la quantità di titolante aggiunta è pari alla quantità di analita presente. ntitolante = nanalita Punto finale: punto sperimentale in cui la fine della titolazione viene rilevata. analita acido acetico In una titolazione acido-base la rivelazione può essere: (a) con uso di indicatore, (b) potenziometrica (p. H-metro), (c) conduttimetrica. 3

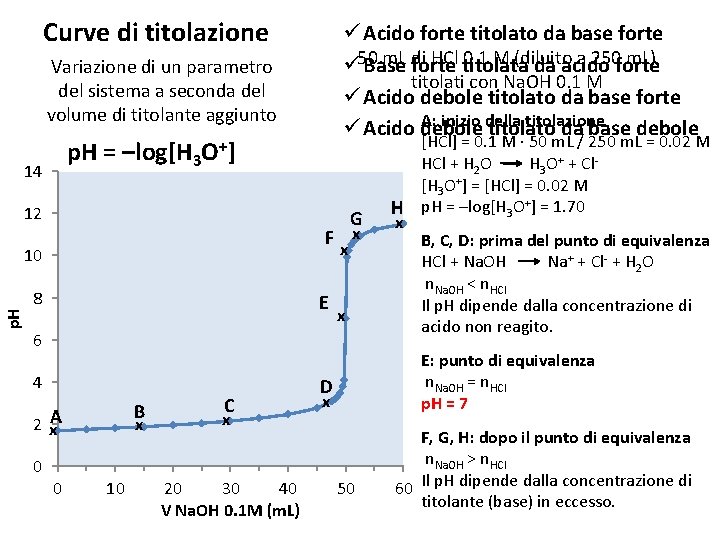
Curve di titolazione ü Acido forte titolato da base forte m. L di HCl titolata 0. 1 M (diluito a 250 forte m. L) ü 50 Base forte da acido titolati con Na. OH 0. 1 M ü Acido debole titolato da base forte A: inizio della titolazione ü Acido debole titolato da base debole Variazione di un parametro del sistema a seconda del volume di titolante aggiunto p. H = –log[H 3 O+] 14 12 G F x x p. H 10 8 E x 6 4 B 2 x. A 0 0 x 10 C x 20 30 40 V Na. OH 0. 1 M (m. L) [HCl] = 0. 1 M ∙ 50 m. L / 250 m. L = 0. 02 M HCl + H 2 O H 3 O+ + Cl[H 3 O+] = [HCl] = 0. 02 M H p. H = –log[H 3 O+] = 1. 70 x B, C, D: prima del punto di equivalenza HCl + Na. OH Na+ + Cl- + H 2 O n. Na. OH < n. HCl Il p. H dipende dalla concentrazione di acido non reagito. E: punto di equivalenza n. Na. OH = n. HCl p. H = 7 D x 50 F, G, H: dopo il punto di equivalenza n. Na. OH > n. HCl 60 Il p. H dipende dalla concentrazione di titolante (base) in eccesso.

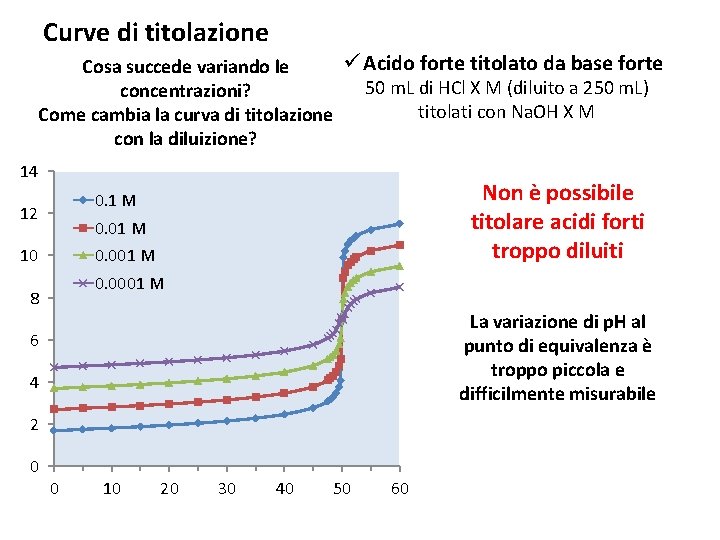
Curve di titolazione ü Acido forte titolato da base forte Cosa succede variando le 50 m. L di HCl X M (diluito a 250 m. L) concentrazioni? titolati con Na. OH X M Come cambia la curva di titolazione con la diluizione? 14 Non è possibile titolare acidi forti troppo diluiti 0. 1 M 12 0. 01 M 10 0. 001 M 0. 0001 M 8 La variazione di p. H al punto di equivalenza è troppo piccola e difficilmente misurabile 6 4 2 0 0 10 20 30 40 50 60
![Curve di titolazione p H 14logOH ü Acido forte titolato da base forte Curve di titolazione p. H = 14+log[OH-] ü Acido forte titolato da base forte](https://slidetodoc.com/presentation_image_h2/535c3f3c9a777cb4ec29d789c52ff45a/image-6.jpg)
Curve di titolazione p. H = 14+log[OH-] ü Acido forte titolato da base forte ü Base forte titolata da acido forte m. L didebole Na. OH 0. 1 M (diluito a 250 forte m. L) ü 50 Acido titolato da base titolati con HCl 0. 1 M ü Acido debole titolato da base debole A: inizio della titolazione [Na. OH] = 0. 02 M [OH-] = [Na. OH] = 0. 02 M p. H = 14 -log[OH-] = 12. 30 14 12 p. H 10 B, C, D: prima del punto di equivalenza Na. OH + HCl Na+ + Cl- + H 2 O n. HCl < n. Na. OH Il p. H dipende dalla concentrazione di base non reagita. 8 6 E: punto di equivalenza n. HCl = n. Na. OH p. H = 7 4 2 0 0 10 20 30 40 V HCl 0. 1 M (m. L) 50 F, G, H: dopo il punto di equivalenza n. HCl > n. Na. OH 60 Il p. H dipende dalla concentrazione di titolante (acido) in eccesso.

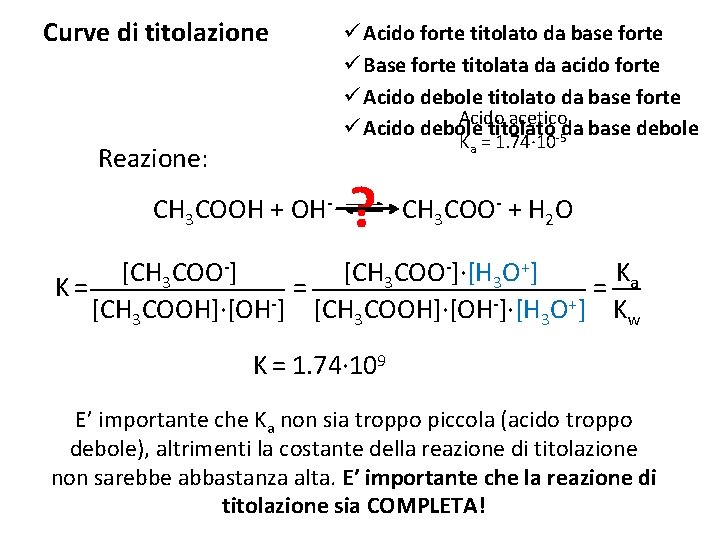
Curve di titolazione ü Acido forte titolato da base forte ü Base forte titolata da acido forte ü Acido debole titolato da base forte Acido acetico ü Acido debole titolato-5 da base debole Ka = 1. 74∙ 10 Reazione: CH 3 COOH + OH- ? CH 3 COO- + H 2 O Ka [CH 3 COO-]∙[H 3 O+] K= = = + [CH 3 COOH]∙[OH ]∙[H 3 O ] Kw K = 1. 74∙ 109 E’ importante che Ka non sia troppo piccola (acido troppo debole), altrimenti la costante della reazione di titolazione non sarebbe abbastanza alta. E’ importante che la reazione di titolazione sia COMPLETA!

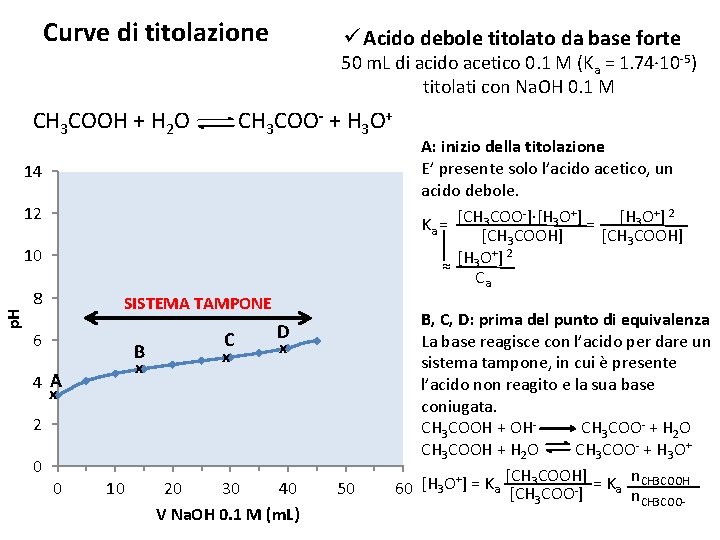
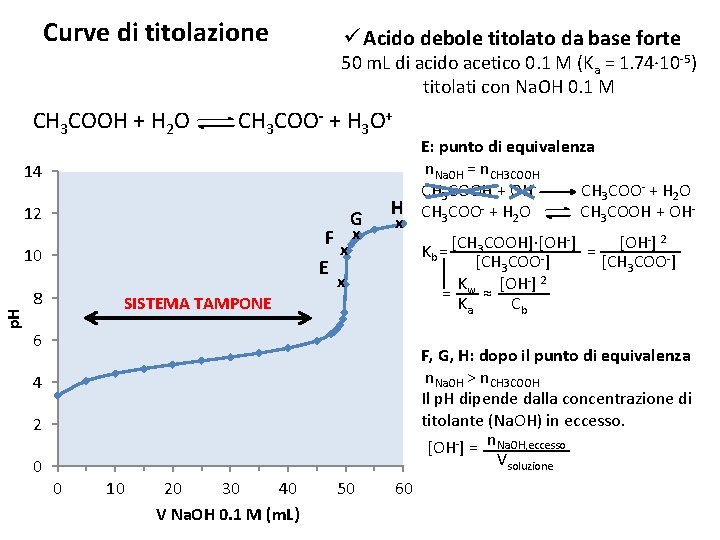
Curve di titolazione ü Acido debole titolato da base forte 50 m. L di acido acetico 0. 1 M (Ka = 1. 74∙ 10 -5) titolati con Na. OH 0. 1 M CH 3 COOH + H 2 O CH 3 COO- + H 3 O+ 14 12 p. H 10 8 SISTEMA TAMPONE 6 B x 4 A C x D x x 2 0 0 10 20 30 40 V Na. OH 0. 1 M (m. L) 50 A: inizio della titolazione E’ presente solo l’acido acetico, un acido debole. + 2 + Ka = [CH 3 COO ]∙[H 3 O ] = [H 3 O ] [CH 3 COOH] [H 3 O+] 2 ≈ Ca B, C, D: prima del punto di equivalenza La base reagisce con l’acido per dare un sistema tampone, in cui è presente l’acido non reagito e la sua base coniugata. CH 3 COOH + OHCH 3 COO- + H 2 O CH 3 COOH + H 2 O CH 3 COO- + H 3 O+ [CH 3 COOH] n. CH 3 COOH + 60 [H 3 O ] = Ka [CH COO-] = Ka n 3 CH 3 COO-

Curve di titolazione ü Acido debole titolato da base forte 50 m. L di acido acetico 0. 1 M (Ka = 1. 74∙ 10 -5) titolati con Na. OH 0. 1 M CH 3 COOH + H 2 O CH 3 COO- + H 3 O+ 14 12 G F x x E p. H 10 x 8 SISTEMA TAMPONE E: punto di equivalenza n. Na. OH = n. CH 3 COOH + OHCH 3 COO- + H 2 O H CH 3 COO- + H 2 O CH 3 COOH + OHx -] 2 -] [OH [CH COOH]∙[OH 3 Kb = = [CH 3 COO-] Kw [OH-] 2 = ≈ Ka Cb 6 F, G, H: dopo il punto di equivalenza n. Na. OH > n. CH 3 COOH Il p. H dipende dalla concentrazione di titolante (Na. OH) in eccesso. [OH-] = n. Na. OH, eccesso Vsoluzione 4 2 0 0 10 20 30 40 V Na. OH 0. 1 M (m. L) 50 60

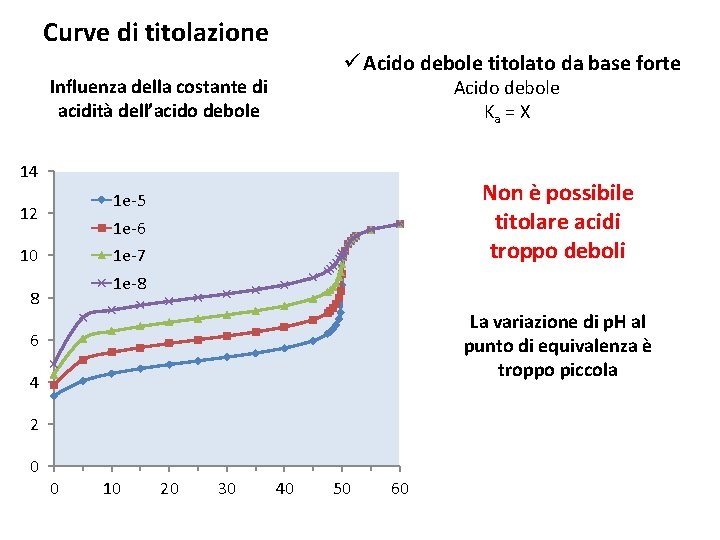
Curve di titolazione ü Acido debole titolato da base forte Influenza della costante di acidità dell’acido debole Acido debole Ka = X 14 Non è possibile titolare acidi troppo deboli 1 e-5 12 1 e-6 10 1 e-7 1 e-8 8 La variazione di p. H al punto di equivalenza è troppo piccola 6 4 2 0 0 10 20 30 40 50 60

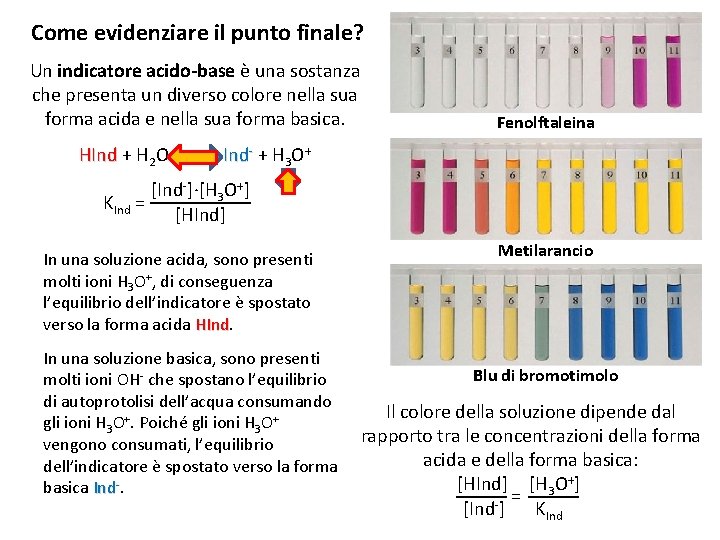
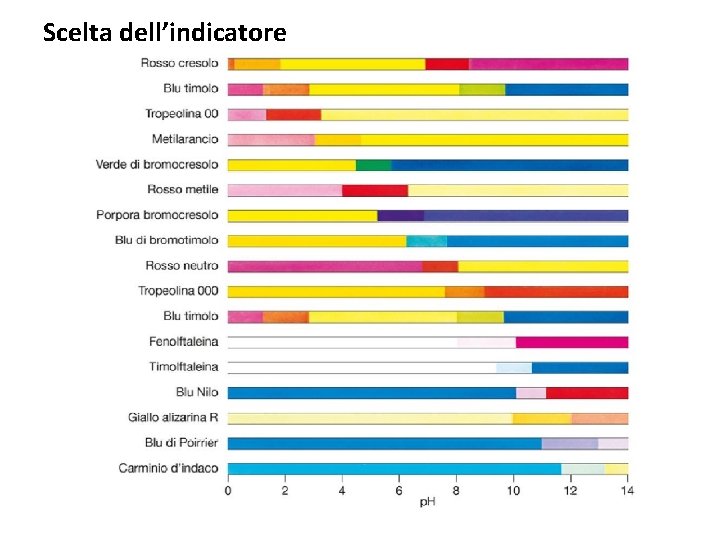
Come evidenziare il punto finale? Un indicatore acido-base è una sostanza che presenta un diverso colore nella sua forma acida e nella sua forma basica. HInd + H 2 O Fenolftaleina Ind- + H 3 O+ [Ind-]∙[H 3 O+] KInd = [HInd] In una soluzione acida, sono presenti molti ioni H 3 O+, di conseguenza l’equilibrio dell’indicatore è spostato verso la forma acida HInd In una soluzione basica, sono presenti molti ioni OH- che spostano l’equilibrio di autoprotolisi dell’acqua consumando gli ioni H 3 O+. Poiché gli ioni H 3 O+ vengono consumati, l’equilibrio dell’indicatore è spostato verso la forma basica Ind-. Metilarancio Blu di bromotimolo Il colore della soluzione dipende dal rapporto tra le concentrazioni della forma acida e della forma basica: [HInd] [H 3 O+] = [Ind-] KInd

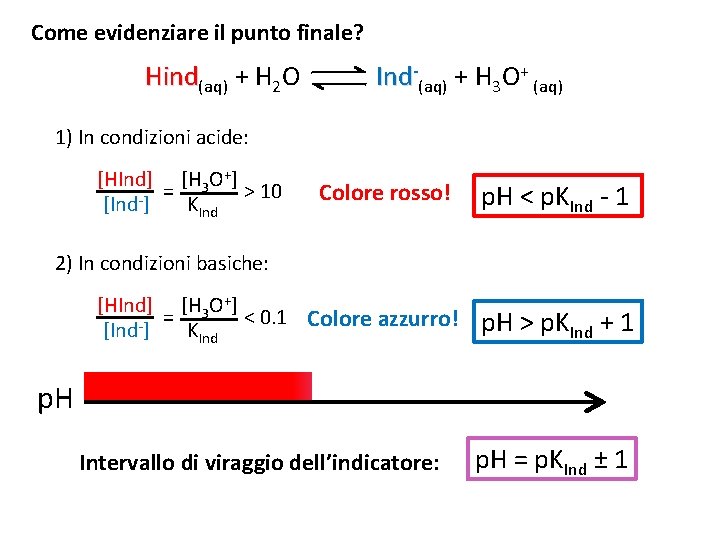
Come evidenziare il punto finale? Hind(aq) + H 2 O Ind-(aq) + H 3 O+ (aq) 1) In condizioni acide: [HInd] [H 3 O+] = > 10 [Ind-] KInd Colore rosso! p. H < p. KInd - 1 2) In condizioni basiche: [HInd] [H 3 O+] = < 0. 1 Colore azzurro! [Ind-] KInd p. H > p. KInd + 1 p. H Intervallo di viraggio dell’indicatore: p. H = p. KInd ± 1

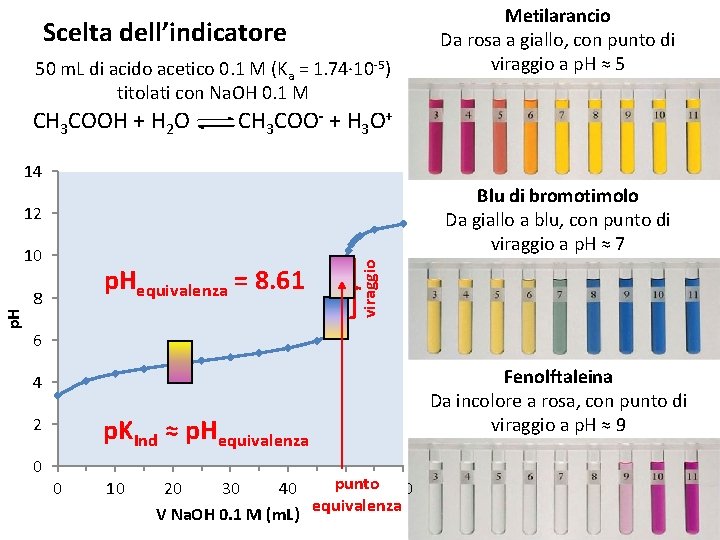
Scelta dell’indicatore 50 m. L di acido acetico 0. 1 M (Ka = 1. 74∙ 10 -5) titolati con Na. OH 0. 1 M CH 3 COOH + H 2 O Metilarancio Da rosa a giallo, con punto di viraggio a p. H ≈ 5 CH 3 COO- + H 3 O+ 14 Blu di bromotimolo Da giallo a blu, con punto di viraggio a p. H ≈ 7 p. H 10 p. Hequivalenza = 8. 61 8 viraggio 12 6 4 p. KInd ≈ p. Hequivalenza 2 0 0 10 punto 20 30 40 50 60 V Na. OH 0. 1 M (m. L) equivalenza Fenolftaleina Da incolore a rosa, con punto di viraggio a p. H ≈ 9

Scelta dell’indicatore

Esperienza: grado di acidità dell’aceto ü Si determina il grado di acidità dell’aceto come i grammi di acido acetico contenuti in 100 m. L di aceto commerciale ü Titolazione volumetrica acido-base: acido debole titolato con una base forte. Reazione: CH 3 COOH + OHCH 3 COO- + H 2 O Parametro monitorato: p. H

1. Preparazione dei reagenti ü Ogni coppia: Preparare 250 m. L di aceto diluito 1: 10. Prelevare 25. 00 m. L di aceto commerciale con una pipetta tarata e travasarli in un matraccio. Portare a volume con acqua. ü Ogni studente: - Preparare 100 m. L di idrossido di sodio 0. 12 M Pesare esattamente circa la massa necessaria, trasferire in un becker, sciogliere in poca acqua e trasferire in modo quantitativo in un matraccio. Portare a volume. L’IDROSSIDO DI SODIO E’ CAUSTICO LA DISSOLUZIONE DELL’IDROSSIDO E’ ESOTERMICA - Riempire la buretta con la soluzione di idrossido di sodio Avvinare la buretta con poca soluzione (da buttare via). Quindi riempirla e azzerarla. Fare attenzione alla bolla nel beccuccio.

2. Titolazione dell’aceto ü Con una pipetta tarata travasare 25. 00 m. L di aceto diluito in un becker/beuta da 250 m. L e diluire a circa 100 m. L con acqua distillata. ü Aggiungere 5 gocce della soluzione di fenolftaleina 1% in etanolo. ü Titolare con la soluzione di Na. OH: aggiungere la soluzione di idrossido lentamente, mescolando la soluzione nella beuta ad ogni aggiunta. Rallentare le aggiunte mano che la colorazione rosa tende ad essere persistente. ü Terminare la titolazione quando la colorazione rosa è persistente. ü Registrare il volume di titolante impiegato. ü Ripetere la titolazione per 3 volte, con 3 aliquote di aceto diluito. Calcolare il valore medio del volume finale e usarlo per il calcolo del grado di acidità.

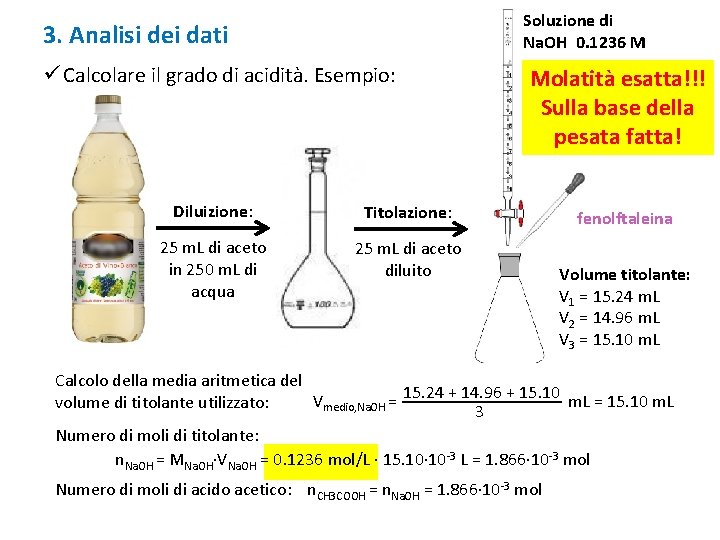
Soluzione di Na. OH 0. 1236 M 3. Analisi dei dati ü Calcolare il grado di acidità. Esempio: Diluizione: Titolazione: 25 m. L di aceto in 250 m. L di acqua 25 m. L di aceto diluito Molatità esatta!!! Sulla base della pesata fatta! fenolftaleina Volume titolante: V 1 = 15. 24 m. L V 2 = 14. 96 m. L V 3 = 15. 10 m. L Calcolo della media aritmetica del Vmedio, Na. OH = 15. 24 + 14. 96 + 15. 10 m. L = 15. 10 m. L volume di titolante utilizzato: 3 Numero di moli di titolante: n. Na. OH = MNa. OH∙VNa. OH = 0. 1236 mol/L ∙ 15. 10∙ 10 -3 L = 1. 866∙ 10 -3 mol Numero di moli di acido acetico: n. CH 3 COOH = n. Na. OH = 1. 866∙ 10 -3 mol

n. CH 3 COOH = 1. 866∙ 10 -3 mol in 25 m. L di aceto diluito Massa di acido acetico in 25 m. L di aceto diluito: m. CH 3 COOH = n. CH 3 COOH ∙ PM = 1. 866∙ 10 -3 mol ∙ 60. 05 g/mol = 0. 1121 g Massa di acido acetico in 100 m. L di aceto diluito: m. CH 3 COOH : 100 m. L = 0. 1121 g : 25 m. L m. CH 3 COOH = 0. 4483 g Diluizione: 1 a 10 Massa di acido acetico in 100 m. L di aceto concentrato (commerciale): m. CH 3 COOH = 4. 483 g Grado di acidità dell’aceto commerciale: 4. 483% Molarità di acido acetico nell’aceto commerciale: MCH 3 COOH = m. CH 3 COOH 4. 483 g = = 0. 7465 mol/L PM ∙ Vaceto 60. 05 g/mol ∙ 0. 100 L

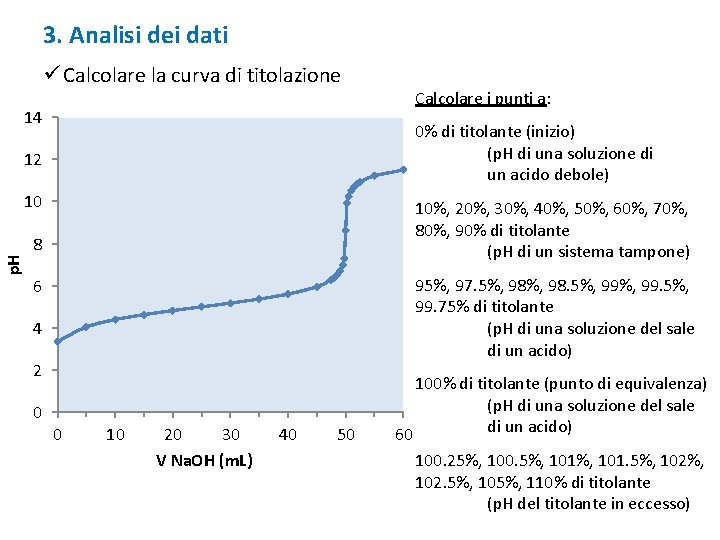
3. Analisi dei dati ü Calcolare la curva di titolazione 14 0% di titolante (inizio) (p. H di una soluzione di un acido debole) 12 p. H 10 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% di titolante (p. H di un sistema tampone) 8 95%, 97. 5%, 98. 5%, 99. 75% di titolante (p. H di una soluzione del sale di un acido) 6 4 2 0 Calcolare i punti a: 0 10 20 30 V Na. OH (m. L) 40 50 100% di titolante (punto di equivalenza) (p. H di una soluzione del sale di un acido) 60 100. 25%, 100. 5%, 101. 5%, 102. 5%, 105%, 110% di titolante (p. H del titolante in eccesso)

3. Analisi dei dati ü Vi verranno forniti (Moodle) i valori ottenuti dai diversi studenti ü Valutare la distribuzione statistica delle misure del grado di acidità di tutto il gruppo Valore medio Deviazione standard Risultato

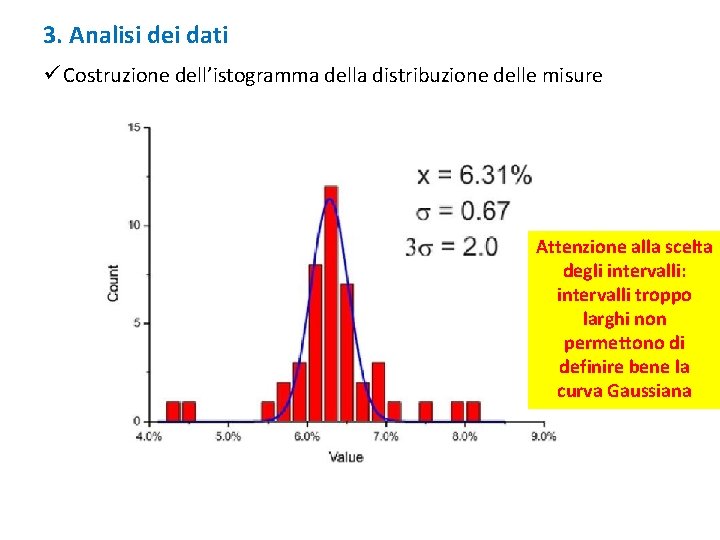
3. Analisi dei dati ü Costruzione dell’istogramma della distribuzione delle misure Attenzione alla scelta degli intervalli: intervalli troppo larghi non permettono di definire bene la curva Gaussiana
 Determinazione del grado di acidità dell'aceto commerciale
Determinazione del grado di acidità dell'aceto commerciale Il metodo gerber per la determinazione del grasso nel latte
Il metodo gerber per la determinazione del grasso nel latte Determinazione ferro nelle acque
Determinazione ferro nelle acque Determinazione del prezzo
Determinazione del prezzo Determinazione del prezzo
Determinazione del prezzo Determinazione del prezzo
Determinazione del prezzo Determinazione dei cloruri
Determinazione dei cloruri Determinazione attività enzimatica spettrofotometro
Determinazione attività enzimatica spettrofotometro Tabella criteri di determinazione ore sostegno
Tabella criteri di determinazione ore sostegno Grado absoluto y relativo de una expresión algebraica
Grado absoluto y relativo de una expresión algebraica Momento torcente zanichelli
Momento torcente zanichelli L'esperienza delle cose moderne e la lezione delle antique
L'esperienza delle cose moderne e la lezione delle antique Esperienza di millikan
Esperienza di millikan Campi di esperienza scuola infanzia
Campi di esperienza scuola infanzia Esperimento di millikan
Esperimento di millikan Competenze chiave europee 2021
Competenze chiave europee 2021 La mia esperienza di stage
La mia esperienza di stage Economie di esperienza
Economie di esperienza I campi d'esperienza
I campi d'esperienza Equazione di colebrook
Equazione di colebrook L'esperienza delle cose moderne e la lezione delle antique
L'esperienza delle cose moderne e la lezione delle antique Narrador segun grado de participacion
Narrador segun grado de participacion Conocimiento del medio página 128 primer grado
Conocimiento del medio página 128 primer grado