Curso Modelos Geoqumicos UPC Clculo de procesos Carlos



















- Slides: 29

Curso Modelos Geoquímicos, UPC Cálculo de procesos Carlos Ayora Instituto de Ciencias de la Tierra Jaume Almera, CSIC cayora@ija. csic. es

Procesos (reaction paths) -Disolución de un mineral o gas hasta equilibrio - Perturbación conocida de un componente: - Valoración de acidez o alcalinidad - Disolución conocida de mineral o gas -Perturbación de todos los componentes: - Mezcla de soluciones - Evaporación

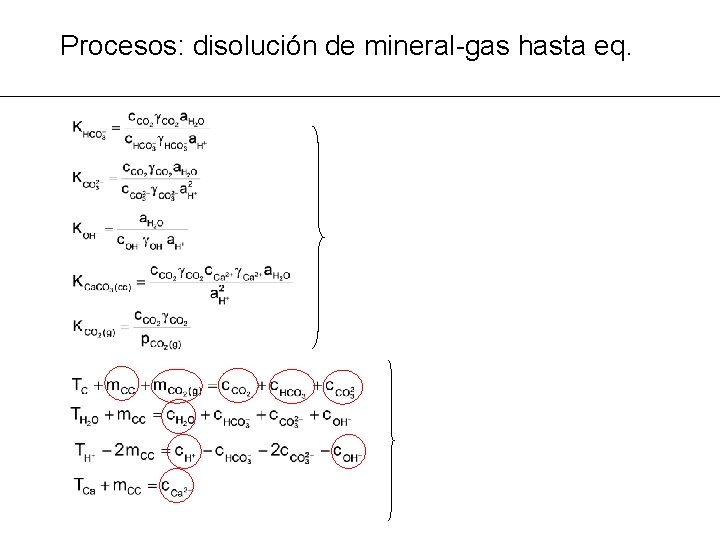
Procesos: disolución de mineral-gas hasta eq. PROBLEMA MG 4: calcular la masa de calcita que necesita disolver el agua de lluvia para llegar al equilibrio ® Agua destilada: Tiinicial conocido (=0 excepto TH 2 O= 55. 51) ® Modificación de las ecuaciones de balance de masas ® 2 nuevas incógnitas: m. CC y m. CO 2(g) ® 2 nuevas ecuaciones de equilibrio

Procesos: disolución de mineral-gas hasta eq.

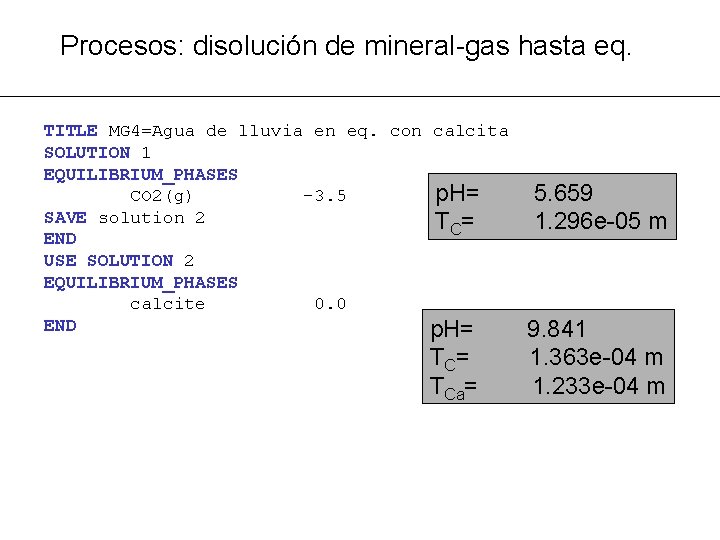
Procesos: disolución de mineral-gas hasta eq. TITLE MG 4: equilibrio agua de lluvia-calcita SOLUTION 1 units mol/kgw p. H 7. 0 # defecto density 1. # defecto temp 25. 0 # defecto EQUILIBRIUM PHASES CO 2(g) -3. 5 calcite 0. 0 END m. CO 2(g)= 4. 87 e-4 m m. CO 2(g)= 4. 93 e-4 m p. H= T C= TCa= 8. 28 9. 80 e-4 m 4. 93 e-4 m

Procesos: disolución de mineral-gas hasta eq. TITLE MG 4=Agua de lluvia en eq. con calcita SOLUTION 1 EQUILIBRIUM_PHASES p. H= CO 2(g) -3. 5 SAVE solution 2 T C= END USE SOLUTION 2 EQUILIBRIUM_PHASES calcite 0. 0 END p. H= T C= TCa= 5. 659 1. 296 e-05 m 9. 841 1. 363 e-04 m 1. 233 e-04 m

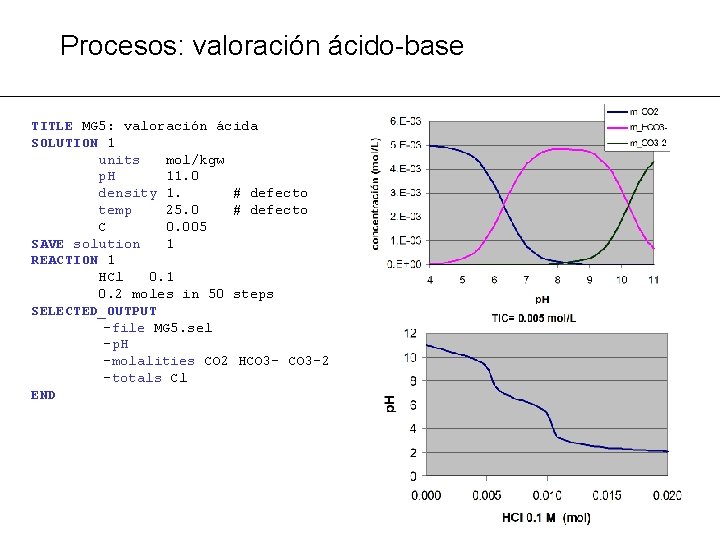
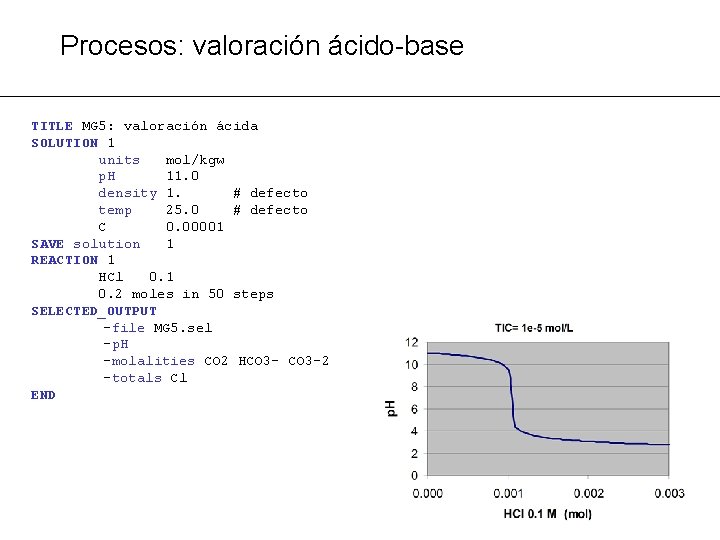
Procesos: valoración ácido-base PROBLEMA MG 5: calcular la evolución del p. H al añadir un ácido o una base a una solución ® Añadir al sistema va moles conocidas de ácido o vb de base: Ejemplo: añadir va moles de H 2 SO 4 o vb moles de Na. OH

Procesos: valoración ácido-base TITLE MG 5: valoración ácida SOLUTION 1 units mol/kgw p. H 11. 0 density 1. # defecto temp 25. 0 # defecto C 0. 005 SAVE solution 1 REACTION 1 HCl 0. 1 0. 2 moles in 50 steps SELECTED_OUTPUT -file MG 5. sel -p. H -molalities CO 2 HCO 3 -2 -totals Cl END

Procesos: valoración ácido-base TITLE MG 5: valoración ácida SOLUTION 1 units mol/kgw p. H 11. 0 density 1. # defecto temp 25. 0 # defecto C 0. 00001 SAVE solution 1 REACTION 1 HCl 0. 1 0. 2 moles in 50 steps SELECTED_OUTPUT -file MG 5. sel -p. H -molalities CO 2 HCO 3 -2 -totals Cl END

Procesos: disolución mineral PROBLEMA MG 12: Una descarga ácida de una mina se hace pasar por un tratamiento de caliza (ALD: Alkaline Limestone Drainage) de manera que la calcita se disuelva neutralizando la solución y precipitando el hierro y aluminio disuelto. Calcular la evolución del p. H y la masa de Fe(OH)3, Al(OH)3 y yeso, que precipitarán al disolver 1. 5 kg de calcita en 1 m 3 de agua ácida. Suponer que el agua siempre está en equilibrio con la atmósfera. ® Añadir al sistema va moles conocidas de mineral:

Procesos: disolución mineral units p. H Ca Mg Na Fe Al Cl S(6) ppm 3. 1 489. 3 69. 8 58. 0 198. 0 92. 2 35. 0 2820. 0 as SO 4

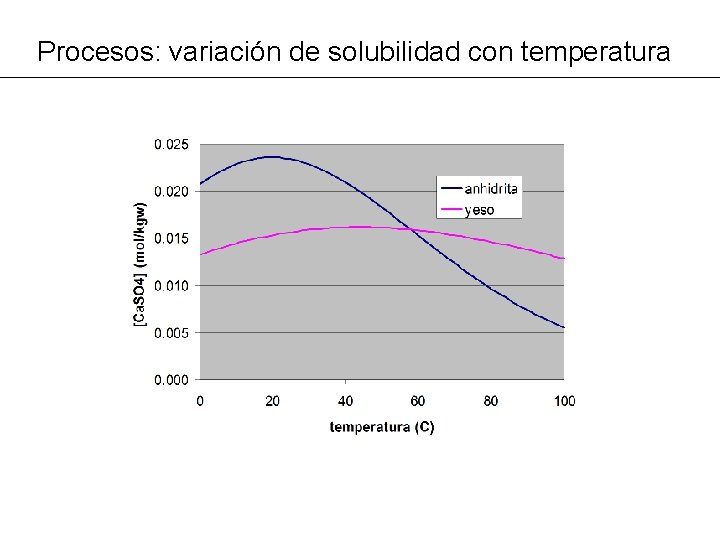
Procesos: variación de solubilidad con temperatura PROBLEMA MG 14: Variación de la solubilidad con la temperatura: - Calcular la solubilidad (mol Ca. SO 4/kgw) de yeso y anhidrita entre 0 y 100ºC ® Los cambios afectan al valor de la constante de equilibrio de la reacción de disolución. ® Comprobar la función de variación de log K con T en la base de datos termodinámica: Gypsum Ca. SO 4: 2 H 2 O = Ca+2 + SO 4 -2 + 2 H 2 O log_k -4. 58 delta_h -0. 109 kcal -analytic 68. 2401 0. 0 -3221. 51 -25. 0627 Ca. SO 4 = Ca+2 + SO 4 -2 log_k -4. 36 delta_h -1. 710 kcal -analytic 197. 520 0. 0 -69. 835 0. 0 Anhydrite -8669. 8 0. 0

Procesos: variación de solubilidad con temperatura TITLE MG 14 ab--Solubilidad del yeso y anhidrita con temperatura SOLUTION 1 Pure water p. H 7. 0 temp 25. 0 REACTION_TEMPERATURE 1 0. 0 100. 0 in 51 steps EQUILIBRIUM_PHASES 1 Gypsum 0. 0 SELECTED_OUTPUT -file MG 14 a. xls -temperature -totals Ca S(6) END USE solution 1 REACTION_TEMPERATURE 2 0. 0 100. 0 in 51 steps EQUILIBRIUM_PHASES 2 Anhydrite 0. 0 SELECTED_OUTPUT -file MG 14 b. xls -temperature -totals Ca S(6) END

Procesos: variación de solubilidad con temperatura

Procesos:

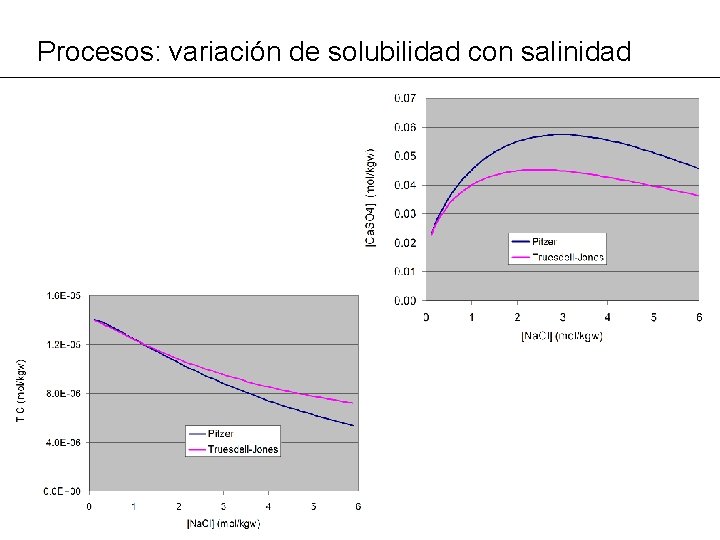
Procesos: variación de solubilidad con salinidad PROBLEMA MG 15: Variación de la solubilidad con la salinidad: - Calcular la solubilidad de yeso y de CO 2 atmosférico para salinidades de 0 a 6 m Na. Cl ® Los cambios afectan al valor del coeficiente de actividad de las especies disueltas (iónicas y neutras) ® Calcular lo anterior con los modelos de actividad de Truesdell -Jones y de Pitzer

Procesos: variación de solubilidad con salinidad TITLE MG 15 --Solubilidad de yeso y CO 2(g)con salinidad (Pitzer y Truesdell-Jones) SOLUTION 1 Pure water p. H 7. 0 temp 25. 0 EQUILIBRIUM_PHASES 1 Gypsum 0. 0 REACTION Na. Cl 1. 0 6. 0 in 51 steps SELECTED_OUTPUT -file MG 15 a. xls -totals Na Ca SOLUTION 2 Pure water p. H 7. 0 temp 25. 0 EQUILIBRIUM_PHASES 1 CO 2(g) -3. 5 SELECTED_OUTPUT -file MG 15 b. xls -totals Na C END

Procesos: variación de solubilidad con salinidad

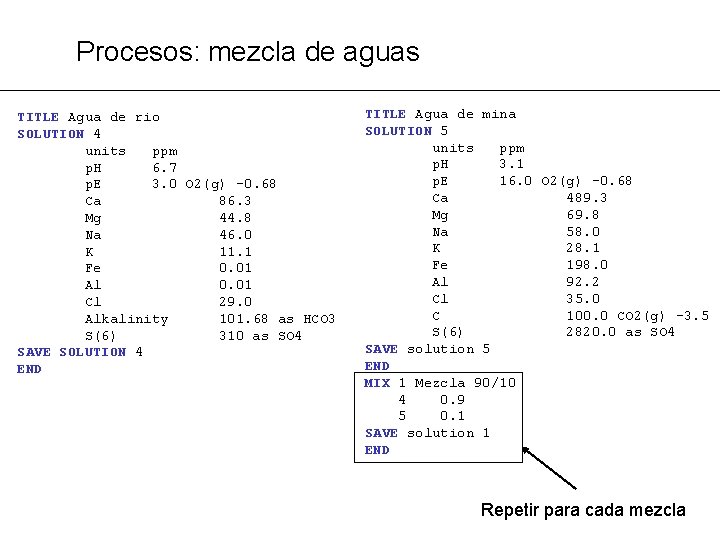
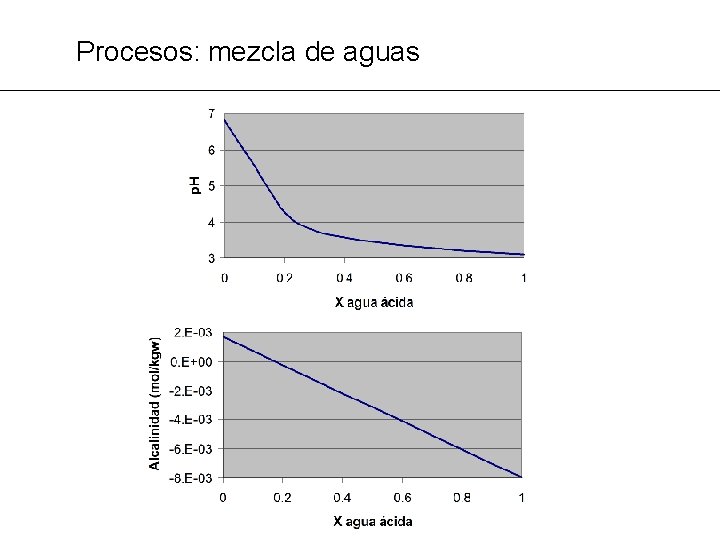
Procesos: mezcla de aguas PROBLEMA MG 9: Una descarga ácida de una mina va a parar a un río. Calcular la alcalinidad y p. H de todo el rango de mezclas aguas abajo. Suponer que las aguas siempre están en equilibrio con la atmósfera. ® Los cambios siempre afectan al total del componente i, no a cada una de las especies acuosas: Esto es especialmente evidente en el p. H y la alcalinidad.

Procesos: mezcla de aguas TITLE Agua de rio SOLUTION 4 units ppm p. H 6. 7 p. E 3. 0 O 2(g) -0. 68 Ca 86. 3 Mg 44. 8 Na 46. 0 K 11. 1 Fe 0. 01 Al 0. 01 Cl 29. 0 Alkalinity 101. 68 as HCO 3 S(6) 310 as SO 4 SAVE SOLUTION 4 END TITLE Agua de mina SOLUTION 5 units ppm p. H 3. 1 p. E 16. 0 O 2(g) -0. 68 Ca 489. 3 Mg 69. 8 Na 58. 0 K 28. 1 Fe 198. 0 Al 92. 2 Cl 35. 0 C 100. 0 CO 2(g) -3. 5 S(6) 2820. 0 as SO 4 SAVE solution 5 END MIX 1 Mezcla 90/10 4 0. 9 5 0. 1 SAVE solution 1 END Repetir para cada mezcla

Procesos: mezcla de aguas

Procesos: mezcla de aguas PROBLEMA MG 7: Calcular el índice de saturación respecto a la calcita de las mezclas de un agua continental y otra marina ambas saturadas en calcita. Calcular la masa de calcita que precipitaría por cada kg de agua. ® Los cambios siempre afectan al total del componente i, no a cada una de las especies acuosas:

Procesos: mezcla de aguas Agua continental : equilibrada con p. CO 2= 2 (suelo vegetal) y con calcita Agua marina: units ppm p. H 8. 22 Ca Mg Na K Cl Alkalinity S(6) 412. 3 1291. 8 10768. 0 399. 1 19353. 0 141. 682 as HCO 3 2712. 0 as SO 4

Procesos: evaporación PROBLEMA MG 8: Infiltración de agua de riego, evaporación en el suelo y precipitación de sales: - calcular la masa de calcita y yeso precipitados - utilizar diversas bases de datos y comparar el resultado ® Los cambios siempre afectan al total del componente i, no a cada una de las especies acuosas:

Procesos: evaporación TITLE Evaporación hasta 5*conc. agua riego + precip. yeso, calcita SOLUTION 5 units ppm p. H 6. 9 pe 13 o 2(g) -0. 67 Ca 214 Mg 102 Na 509 K 88 Cl 955 C 1 co 2(g) -2. 0 S(6) 575 as SO 4 REACTION 1 # Concentrar 5*, quitar 4/5 of H 2 O H -2 O -1 #H 2 O -1. 0 es lo mismo 44. 4072 #55. 5*4/5 SAVE solution 2 END MIX 1 2 5. 0 # Aumentar el volumen hasta 1 kg de agua SAVE solution 3 END USE solution 3 EQUILIBRIUM_PHASES # precip. yeso y calcita calcite 0. 0 gypsum 0. 0 END

Procesos: evaporación TITLE Evaporación hasta 5*conc. agua riego + precip. yeso, calcita SOLUTION 5 units ppm p. H 6. 9 pe 13 o 2(g) -0. 67 Ca 214 Mg 102 Na 509 K 88 Cl 955 C 1 co 2(g) -2. 0 S(6) 575 as SO 4 REACTION 1 # Concentrar 5*, quitar 4/5 of H 2 O H -2 O -1 #H 2 O -1. 0 es lo mismo 44. 4072 #55. 5*4/5 SAVE solution 2 END MIX 1 2 5. 0 # Aumentar el volumen hasta 1 kg de agua SAVE solution 3 END USE solution 3 EQUILIBRIUM_PHASES # precip. yeso y calcita calcite 0. 0 gypsum 0. 0 END Calcita= 8. 671 e-04 mol/kgw Yeso= 1. 111 e-03 mol/kgw

Procesos: evaporación PROBLEMA MG 8: evaporación de agua de mar ® Los cambios siempre afectan al total del componente i, no a cada una de las especies acuosas:

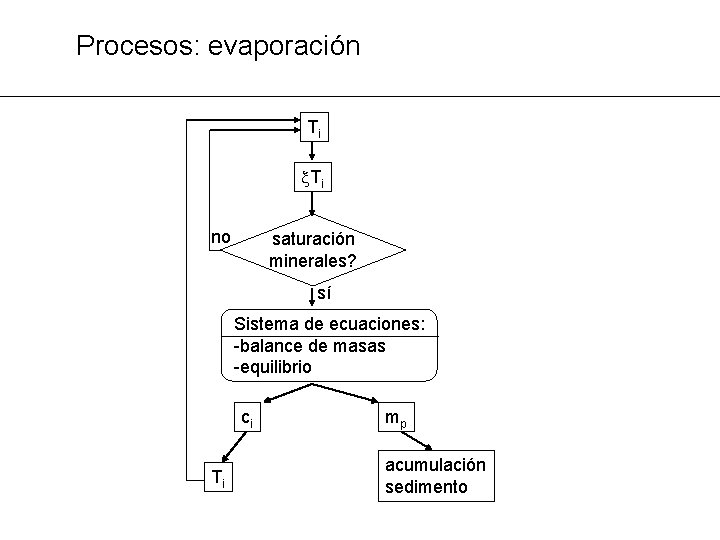
Procesos: evaporación Ti Ti no saturación minerales? sí Sistema de ecuaciones: -balance de masas -equilibrio ci Ti mp acumulación sedimento

Procesos: evaporación Na 2 Ca(SO 4)2 K 2 Mg. Ca 2(SO 4)4· 2 H 2 O Mg. SO 4· 6 H 2 O
 Tablas mentales
Tablas mentales Hoja de clculo
Hoja de clculo Esquema de una hoja
Esquema de una hoja Sun: staroffice calc, paquete staroffice.
Sun: staroffice calc, paquete staroffice. Hojas de clculo
Hojas de clculo Hoja de clculo
Hoja de clculo Iftdtl
Iftdtl Upc bölcske
Upc bölcske Timesheets upc
Timesheets upc Upc drac
Upc drac Donde encuentro
Donde encuentro Atenea upc etseib
Atenea upc etseib Prisma upc
Prisma upc Tesa gauge block comparator
Tesa gauge block comparator Moodle atenea
Moodle atenea Upc idexx
Upc idexx Upc
Upc Upc ci
Upc ci Planificador d'horaris etsetb
Planificador d'horaris etsetb Upc hálózati azonosító
Upc hálózati azonosító Faig constar model
Faig constar model Fib upc raco
Fib upc raco Vicente medina upc
Vicente medina upc Eva vidal upc
Eva vidal upc Tempus upc
Tempus upc Upc wifree
Upc wifree Ac upc
Ac upc Expedient academic upc
Expedient academic upc Upc 2-513
Upc 2-513 Language telegram
Language telegram