Copertina Paolo Pistar Principi di Chimica Moderna Istituto











- Slides: 22

Copertina Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 1

CAPITOLO 3 Le trasformazioni chimiche della materia Indice 1. Dalle trasformazioni fisiche alle reazioni chimiche 2. Elementi e composti Mappa concettuale: La materia 3. La tavola periodica: qualche anticipazione 4. La teoria atomica 5. Atomi e molecole 6. Modelli molecolari e formule chimiche 7. Miscele e composti 8. Le prove chimiche della teoria atomica 9. Legge dei volumi di combinazione 10. Legge di Avogadro 11. Introduzione alle reazioni chimiche Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 2

1 Dalle trasformazioni CAPITOLO 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA PAG. fisiche alle reazioni chimiche In una trasformazione fisica le sostanze interessate non cambiano identità. Il filamento di una lampadina, al passaggio di corrente elettrica, diventa incandescente e luminoso; non appena cessa il passaggio di corrente, esso ritorna allo stato iniziale. In una reazione chimica una sostanza si trasforma in altre sostanze. Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 3 55

1 Dalle trasformazioni CAPITOLO 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA PAG. fisiche alle reazioni chimiche Una reazione chimica si evidenzia per: • produzione di calore; • sviluppo di un gas; • variazione di colore; • variazione delle proprietà; Le pastiglie effervescenti in acqua sviluppano bollicine di un gas incolore, evidenziando che una reazione chimica è in corso. Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 4 55

CAPITOLO 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA 1 Dalle trasformazioni PAG. fisiche alle reazioni chimiche Si verifica anche una reazione chimica quando una sostanza si decompone. a b c d In una reazione chimica una o più sostanze (i reagenti) si trasformano in una o più differenti sostanze (i prodotti). I reagenti vanno scritti a sinistra di una freccia mentre i prodotti a destra. reagenti Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 prodotti 5 56

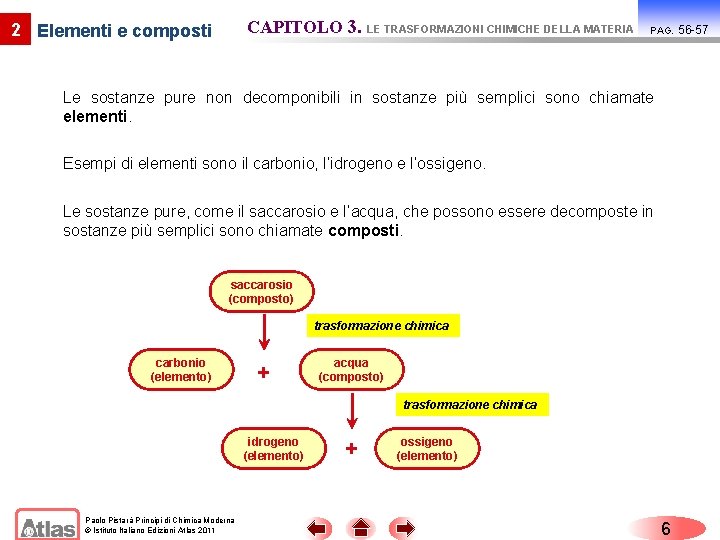
CAPITOLO 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA 2 Elementi e composti PAG. Le sostanze pure non decomponibili in sostanze più semplici sono chiamate elementi. Esempi di elementi sono il carbonio, l’idrogeno e l’ossigeno. Le sostanze pure, come il saccarosio e l’acqua, che possono essere decomposte in sostanze più semplici sono chiamate composti. saccarosio (composto) trasformazione chimica carbonio (elemento) + acqua (composto) trasformazione chimica idrogeno (elemento) Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 + ossigeno (elemento) 6 56 -57

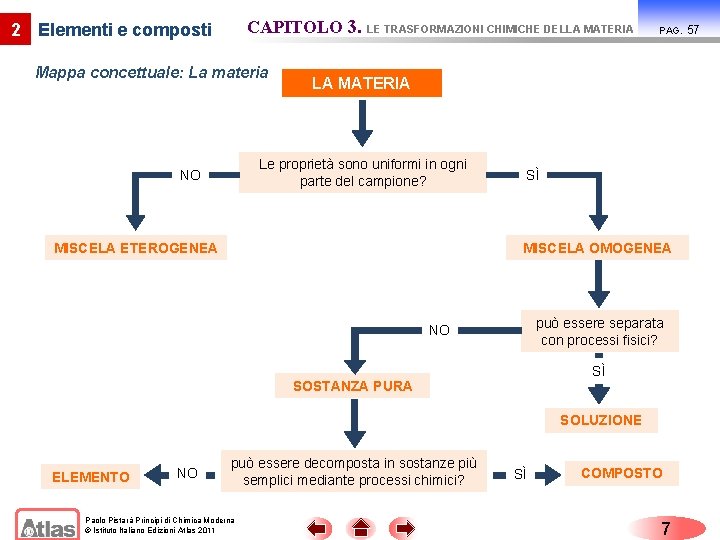
CAPITOLO 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA 2 Elementi e composti Mappa concettuale: La materia LA MATERIA Le proprietà sono uniformi in ogni parte del campione? NO PAG. MISCELA ETEROGENEA SÌ MISCELA OMOGENEA può essere separata con processi fisici? NO SÌ SOSTANZA PURA SOLUZIONE ELEMENTO NO può essere decomposta in sostanze più semplici mediante processi chimici? Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 SÌ COMPOSTO 7 57

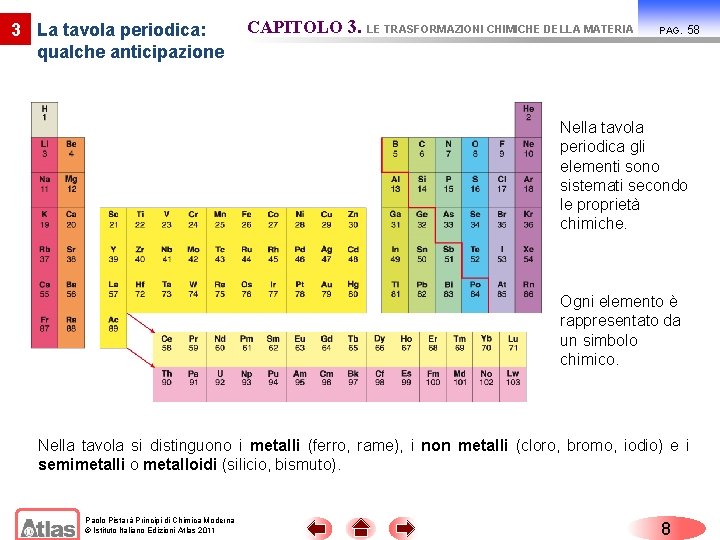
3 La tavola periodica: qualche anticipazione CAPITOLO 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA PAG. 58 Nella tavola periodica gli elementi sono sistemati secondo le proprietà chimiche. Ogni elemento è rappresentato da un simbolo chimico. Nella tavola si distinguono i metalli (ferro, rame), i non metalli (cloro, bromo, iodio) e i semimetalli o metalloidi (silicio, bismuto). Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 8

4 La teoria atomica CAPITOLO 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA PAG. La teoria atomica di Dalton si fonda sui seguenti punti: a. La materia è costituita da particelle piccolissime dette atomi. b. Tutti gli atomi di un dato elemento sono identici, cioè hanno la stessa massa e le stesse proprietà. c. Un composto è costituito da due o più atomi di differenti elementi combinati chimicamente. d. In una comune reazione chimica gli atomi sono indivisibili e, quindi, non cambiano di massa. Pertanto non possono essere né creati né distrutti, varia semplicemente il modo con cui si aggregano tra di loro. e. Le reazioni chimiche avvengono tra numeri interi di atomi. Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 9 59

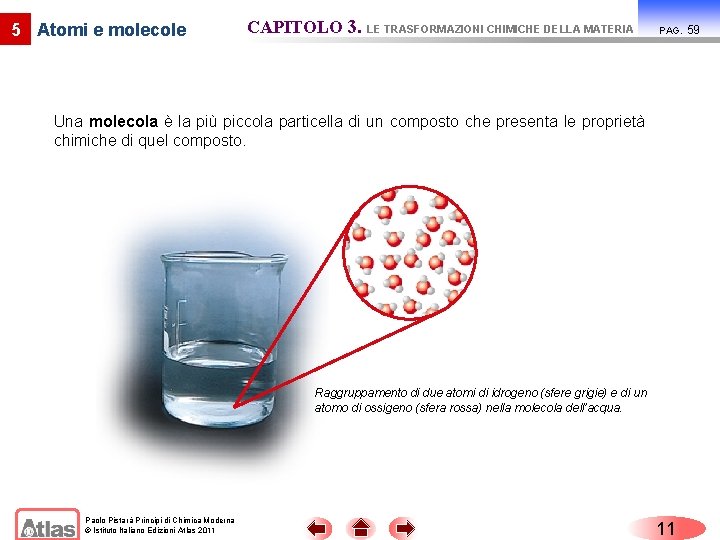
5 Atomi e molecole CAPITOLO 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA PAG. Un atomo è la più piccola particella di un elemento che possiede le proprietà chimiche dell’elemento. Rame allo stato naturale; ogni sfera rappresenta un atomo di rame. Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 10 59

5 Atomi e molecole CAPITOLO 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA PAG. Una molecola è la più piccola particella di un composto che presenta le proprietà chimiche di quel composto. Raggruppamento di due atomi di idrogeno (sfere grigie) e di un atomo di ossigeno (sfera rossa) nella molecola dell’acqua. Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 11 59

6 Modelli molecolari e formule chimiche CAPITOLO 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA PAG. Il raggruppamento degli atomi in una molecola viene rappresentato mediante modelli molecolari a sfere e bastoncini oppure a sfere compatte. Per ogni molecola, inoltre, esiste una formula chimica rappresentata con i simboli degli elementi che la compongono. I numeri scritti in basso a destra dei simboli sono chiamati indici. H 2 O indice 2 indica il numero di atomi di idrogeno Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 indice 1 che viene omesso, indica il numero di atomi di ossigeno Modelli molecolari dell’acqua. 12 60

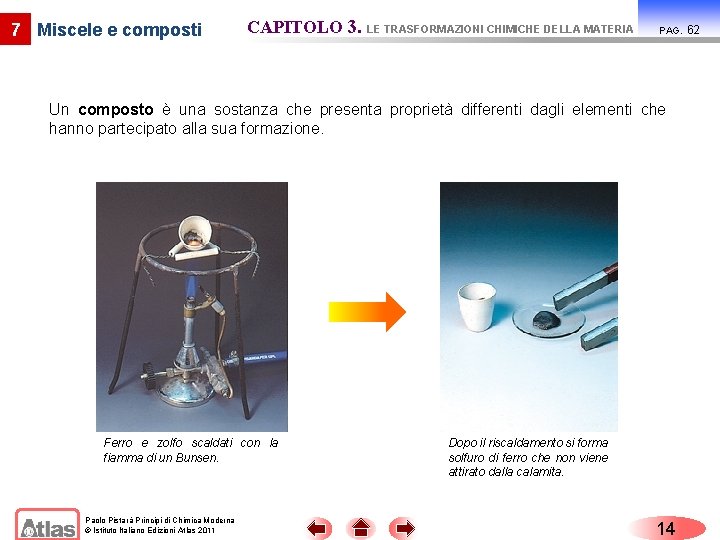
7 Miscele e composti CAPITOLO 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA PAG. Una miscela è un insieme di due o più sostanze che conservano proprietà individuali caratteristiche e sono separabili con mezzi fisici. In seguito a riscaldamento ferro e zolfo formano solfuro di ferro, un composto che, a differenza del ferro, non viene attirato dalla calamita. Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 13 61

7 Miscele e composti CAPITOLO 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA PAG. Un composto è una sostanza che presenta proprietà differenti dagli elementi che hanno partecipato alla sua formazione. Ferro e zolfo scaldati con la fiamma di un Bunsen. Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 Dopo il riscaldamento si forma solfuro di ferro che non viene attirato dalla calamita. 14 62

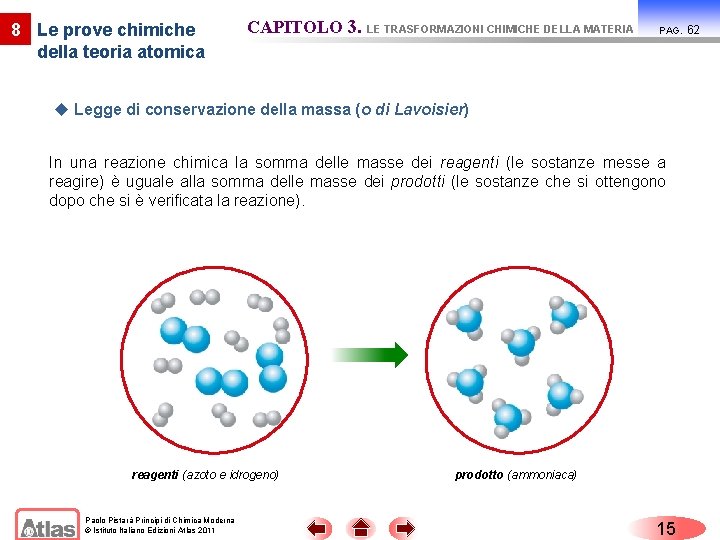
8 Le prove chimiche della teoria atomica CAPITOLO 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA PAG. u Legge di conservazione della massa (o di Lavoisier) In una reazione chimica la somma delle masse dei reagenti (le sostanze messe a reagire) è uguale alla somma delle masse dei prodotti (le sostanze che si ottengono dopo che si è verificata la reazione). reagenti (azoto e idrogeno) Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 prodotto (ammoniaca) 15 62

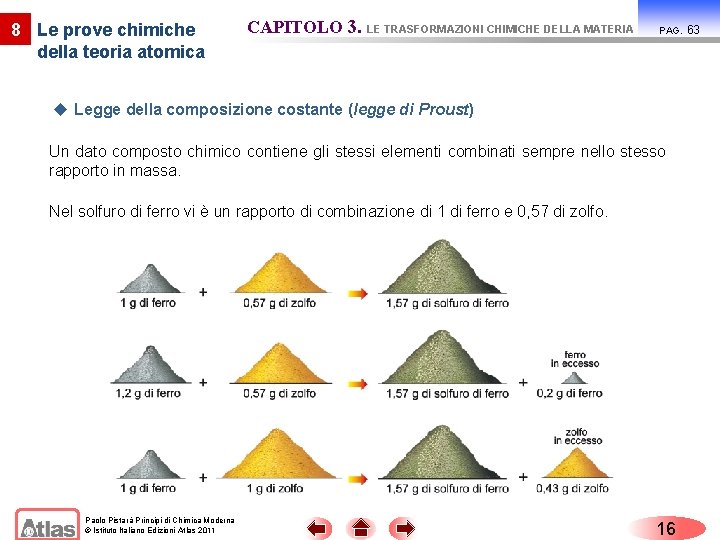
8 Le prove chimiche della teoria atomica CAPITOLO 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA PAG. u Legge della composizione costante (legge di Proust) Un dato composto chimico contiene gli stessi elementi combinati sempre nello stesso rapporto in massa. Nel solfuro di ferro vi è un rapporto di combinazione di 1 di ferro e 0, 57 di zolfo. Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 16 63

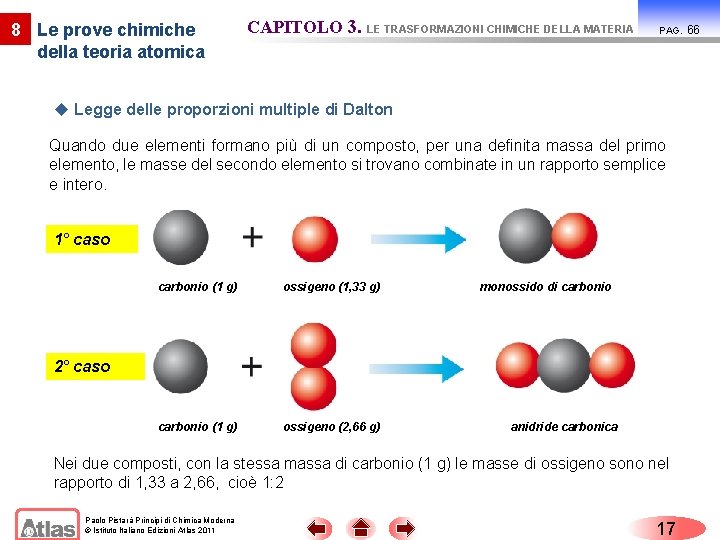
8 Le prove chimiche della teoria atomica CAPITOLO 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA PAG. u Legge delle proporzioni multiple di Dalton Quando due elementi formano più di un composto, per una definita massa del primo elemento, le masse del secondo elemento si trovano combinate in un rapporto semplice e intero. 1° caso carbonio (1 g) ossigeno (1, 33 g) carbonio (1 g) ossigeno (2, 66 g) monossido di carbonio 2° caso anidride carbonica Nei due composti, con la stessa massa di carbonio (1 g) le masse di ossigeno sono nel rapporto di 1, 33 a 2, 66, cioè 1: 2 Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 17 66

CAPITOLO 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA 9 Legge dei volumi di combinazione di Gay-Lussac PAG. In una reazione chimica i volumi dei gas che si combinano e quelli che si formano stanno tra loro in rapporti esprimibili con numeri interi e piccoli. Sono esempi di reazioni di gas che illustrano la legge di Gay-Lussac: idrogeno gas : 1 L idrogeno gas cloro gas : 1 L 1 L : 2 L Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 ossigeno gas 1 L cloruro di idrogeno gas : acqua vapore 2 L 18 66

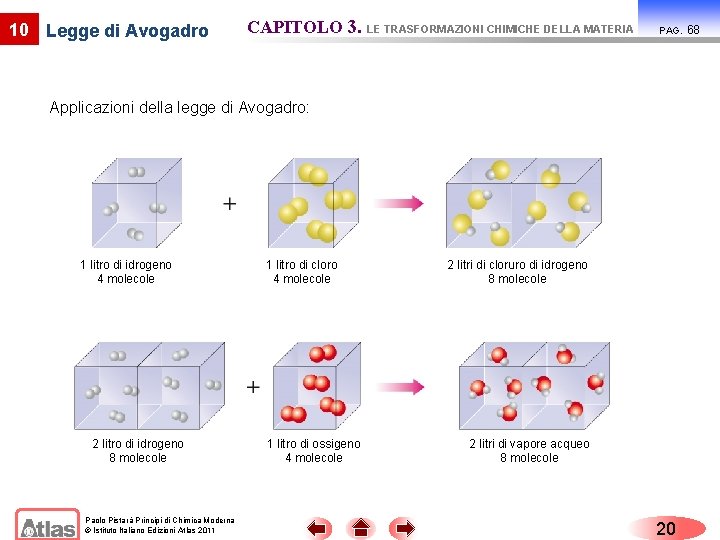
10 Legge di Avogadro CAPITOLO 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA PAG. Nelle stesse condizioni di temperatura e di pressione, volumi uguali di gas diversi contengono lo stesso numero di molecole. H 2 O HCl La rappresentazione grafica della legge di Avogadro evidenzia che il volume di un gas è indipendente dalle dimensioni delle molecole e dal tipo di molecola. Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 19 67

10 Legge di Avogadro CAPITOLO 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA PAG. Applicazioni della legge di Avogadro: 1 litro di idrogeno 4 molecole 2 litro di idrogeno 8 molecole Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 1 litro di cloro 4 molecole 1 litro di ossigeno 4 molecole 2 litri di cloruro di idrogeno 8 molecole 2 litri di vapore acqueo 8 molecole 20 68

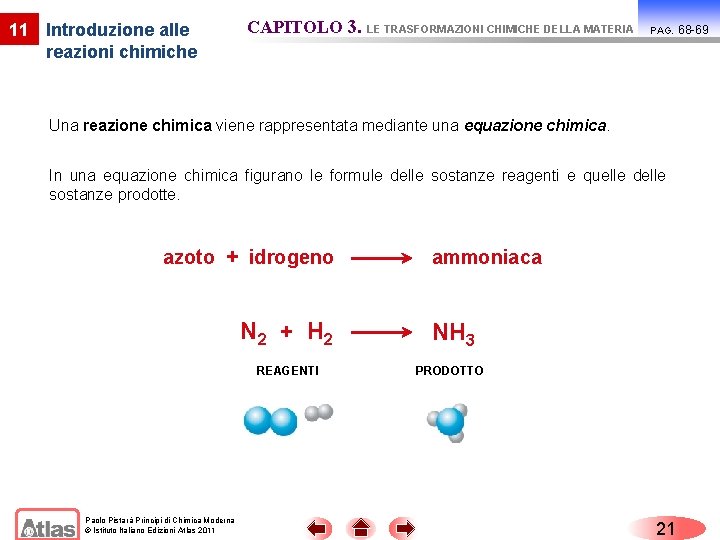
11 Introduzione alle reazioni chimiche CAPITOLO 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA PAG. Una reazione chimica viene rappresentata mediante una equazione chimica. In una equazione chimica figurano le formule delle sostanze reagenti e quelle delle sostanze prodotte. azoto + idrogeno Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 ammoniaca N 2 + H 2 NH 3 REAGENTI PRODOTTO 21 68 -69

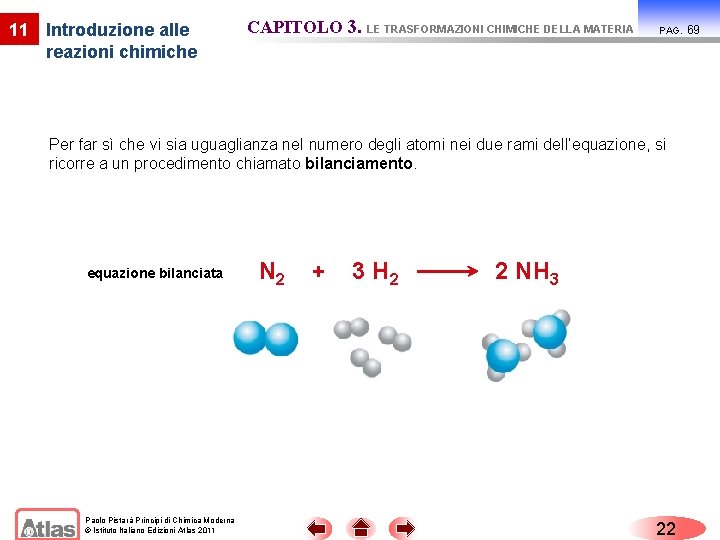
11 Introduzione alle reazioni chimiche CAPITOLO 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA PAG. Per far sì che vi sia uguaglianza nel numero degli atomi nei due rami dell’equazione, si ricorre a un procedimento chiamato bilanciamento. equazione bilanciata Paolo Pistarà Principi di Chimica Moderna © Istituto Italiano Edizioni Atlas 2011 N 2 + 3 H 2 2 NH 3 22 69
 Principi di chimica moderna tomo b soluzioni
Principi di chimica moderna tomo b soluzioni Principi di chimica moderna - tomo a soluzioni
Principi di chimica moderna - tomo a soluzioni Copertina promessi sposi
Copertina promessi sposi Principi kineziterapije
Principi kineziterapije Cosa sono i principi nutritivi
Cosa sono i principi nutritivi Principi gestaltici di raggruppamento
Principi gestaltici di raggruppamento Principi della costituzione
Principi della costituzione Principi della dinamica
Principi della dinamica Provvedimenti amministrativi
Provvedimenti amministrativi Principi fondamentali della costituzione mappa
Principi fondamentali della costituzione mappa Principi nutritivi
Principi nutritivi Didakticki principi
Didakticki principi Didakticki principi
Didakticki principi Principi de conservació de l'energia
Principi de conservació de l'energia Testamentos extraordinarios
Testamentos extraordinarios Principi dizajna
Principi dizajna Principi kineziterapije
Principi kineziterapije Esse est percipi
Esse est percipi Cos'è un testo regolativo
Cos'è un testo regolativo Struttura costituzione italiana
Struttura costituzione italiana Principio di giustizia oss
Principio di giustizia oss Oop principi
Oop principi Principi dello sport
Principi dello sport