Conceptes previs Lleis qumiques Teoria cineticomolecular U 2












- Slides: 14

Conceptes previs Lleis químiques Teoria cineticomolecular

U 2 |Conceptes previs Estats de la matèria Escala absoluta de temperatura Volum molar / Principi d’Avogadro

U 2 |Estats de la matèria Propietats Gas Líquid Sòlid Plasma • No té forma ni volum propis • Molt compressible • Flueix amb facilitat • S’adapta a la forma del recipient • Molt poc compressible • Forma definida, volum propi • Rígid • Molt poc compressible • Estat més abundant a l’univers • Format per partícules amb càrregues lliures en moviment continu i desordenat • Es troba a temperatures elevadíssimes

U 2 |Escala absoluta de temperatura De la mateixa manera que hi ha l’escala de temperatura centígrada o Celsius, hi ha una escala de temperatura absoluta. Cada grau d’aquesta escala s’anomena kelvin i se simbolitza per K. Escala centígrada i escala absoluta de temperatura. Comparació entre els valors de les temperatures en les dues escales. Un gas es troba en condicions normals (c. n. ) quan la seva temperatura és de 273 K (0 °C) i la seva pressió és 1, 013 × 105 Pa (1 atm).

U 2 |Volum molar / Principi d’Avogadro Volum molar Volum ocupat per un mol d’un element o compost, sigui en estat sòlid, líquid o gasós. El volum molar se simbolitza per Vm. Principi d’Avogadro Volums iguals de gasos en les mateixes condicions de pressió i temperatura tenen el mateix nombre de molècules. En cadascun dels recipients hi ha un mol de gas a la mateixa pressió i temperatura.

U 2 |Lleis químiques Gasos perfectes: - Llei general - Equació general - Aplicacions Mescla gasos: - Llei de Dalton

U 2 |Llei general dels gasos perfectes Per a una mateixa massa de gas, el producte de la pressió pel seu volum dividit per la seva temperatura absoluta és una quantitat constant. • Llei de Boyle-Mariotte (T 1 = T 2) • Llei de Gay-Lussac (P 1 = P 2) • Llei de Gay-Lussac (V 1 = V 2) p 1 V 1 = p 2 V 2

U 2 |Equació general dels gasos perfectes El valor constant p Vm/T s’anomena constant dels gasos i es designa amb la lletra R. El seu valor és de 8, 31 J/K mol, quan la pressió, el volum i la temperatura estan expressats en unitats del SI. P V = n RT

U 2 |Aplicacions de l’equació general dels gasos perfectes Determinació de masses moleculars de gasos Determinació de la densitat d’un gas Densitats relatives

U 2 |Llei de Dalton de les pressions parcials La pressió total exercida per una mescla de gasos és igual a la suma de les pressions parcials de tots els seus components. ptotal = p. A + p. B + p. C +. . . La pressió total de la mescla de gasos és de 60 k. Pa. La pressió parcial del gas B en la mescla de gasos és de 30 k. Pa, que és la mateixa pressió que exerciria si ell sol ocupés tot el volum de la mescla, a la mateixa temperatura.

U 2 |Teoria cineticomolecular dels gasos Ampliació als estats líquid i sòlid Canvis d’estat

U 2 |Teoria cineticomolecular dels gasos • Els gasos estan constituïts per un nombre molt gran de molècules que estan en moviment ràpid i incessant. • Les molècules xoquen entre elles i amb les parets del recipient que les conté, i es mouen en ziga-zaga, sense direccions privilegiades i a velocitats diferents. • La pressió exercida pel gas contra les parets del recipient que el conté és conseqüència del xoc de les molècules. • Els xocs de les molècules entre elles i amb les parets del recipient que les conté són perfectament elàstics. • Les molècules són petitíssimes i estan molt separades les unes de les altres. El seu volum és negligible comparat amb el volum total del recipient. • La velocitat de les partícules i, per tant, la seva energia cinètica mitjana de translació depèn de la temperatura del gas. • Quan dos gasos tenen la mateixa temperatura absoluta, les seves molècules tenen la mateixa energia cinètica mitjana. Les molècules d’un gas es desplacen constantment xocant entre elles i amb les parets del recipient que les conté.

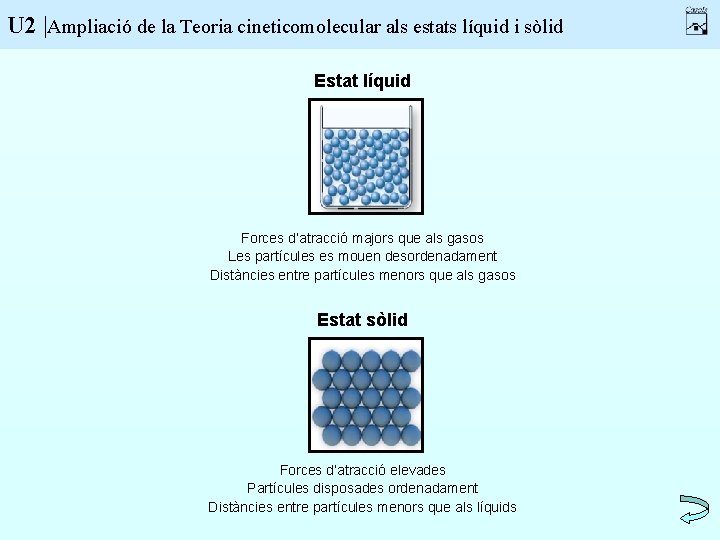
U 2 |Ampliació de la Teoria cineticomolecular als estats líquid i sòlid Estat líquid Forces d’atracció majors que als gasos Les partícules es mouen desordenadament Distàncies entre partícules menors que als gasos Estat sòlid Forces d’atracció elevades Partícules disposades ordenadament Distàncies entre partícules menors que als líquids

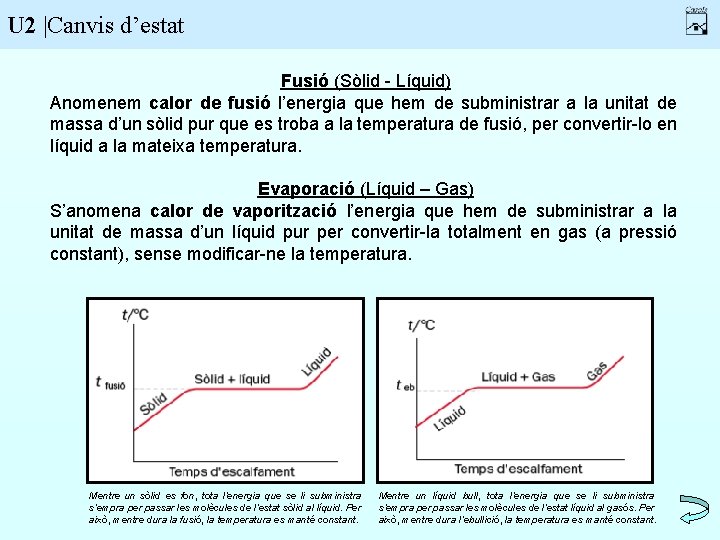
U 2 |Canvis d’estat Fusió (Sòlid - Líquid) Anomenem calor de fusió l’energia que hem de subministrar a la unitat de massa d’un sòlid pur que es troba a la temperatura de fusió, per convertir-lo en líquid a la mateixa temperatura. Evaporació (Líquid – Gas) S’anomena calor de vaporització l’energia que hem de subministrar a la unitat de massa d’un líquid pur per convertir-la totalment en gas (a pressió constant), sense modificar-ne la temperatura. Mentre un sòlid es fon, tota l’energia que se li subministra s’empra per passar les molècules de l’estat sòlid al líquid. Per això, mentre dura la fusió, la temperatura es manté constant. Mentre un líquid bull, tota l’energia que se li subministra s’empra per passar les molècules de l’estat líquid al gasós. Per això, mentre dura l’ebullició, la temperatura es manté constant.
 Tres lleis de newton
Tres lleis de newton Les lleis de mendel
Les lleis de mendel Teoria financiera
Teoria financiera Conformidad interpersonal
Conformidad interpersonal Virginia henderson metaparadigma
Virginia henderson metaparadigma Teoria do resalto elastico
Teoria do resalto elastico Intelligenze motrici
Intelligenze motrici La teoría de talcott parsons
La teoría de talcott parsons Teoria bifattoriale della regolazione delle emozioni
Teoria bifattoriale della regolazione delle emozioni Teoría focal de coleman
Teoría focal de coleman Teoría de acción razonada
Teoría de acción razonada Teoria de la contingencia lawrence y lorsch
Teoria de la contingencia lawrence y lorsch Teoria del condicionamiento sin reforzamiento
Teoria del condicionamiento sin reforzamiento Podejście neoklasyczne
Podejście neoklasyczne Teoria de aristóteles
Teoria de aristóteles