COMPOSICIN DE LA DISOLUCIN DEL SUELO COMPOSICIN DE



































- Slides: 55

COMPOSICIÓN DE LA DISOLUCIÓN DEL SUELO

COMPOSICIÓN DE LA DISOLUCIÓN DEL SUELO • Suelos agrícolas: Ca 2+, Mg 2+, K+, NO 3 -, Cl- y SO 42 -, p. H • Suelos ácidos: Al • Suelos alcalinos: Na+, CO 32 - • Estabilidad mineral Si • Suelos superficiales poco alterados DOC

COMPONENTES MINORITARIOS Metales traza suelos contaminados Dependen: p. H S. O. M Condiciones redox

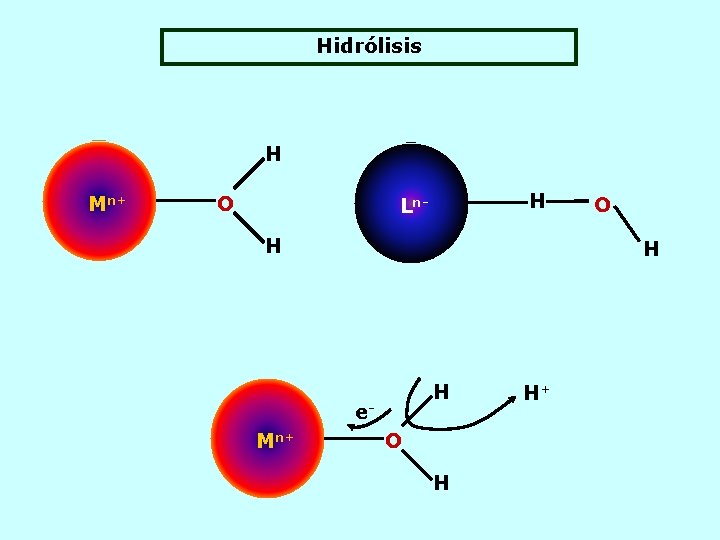
ESPECIACIÓN üHidrólisis üFormación de pares iónicos üFormación de complejos

Hidrólisis H O H Ln. H H H e. Mn+ O H H+

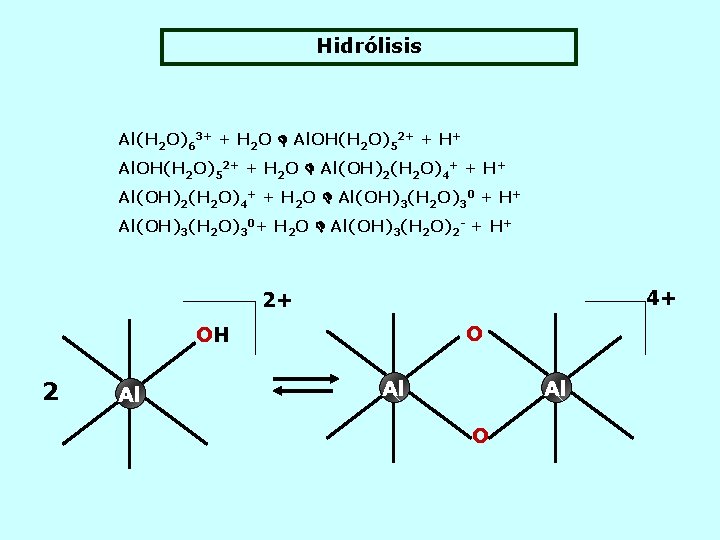
Hidrólisis Al(H 2 O)63+ + H 2 O Al. OH(H 2 O)52+ + H+ Al. OH(H 2 O)52+ + H 2 O Al(OH)2(H 2 O)4+ + H+ Al(OH)2(H 2 O)4+ + H 2 O Al(OH)3(H 2 O)30 + H+ Al(OH)3(H 2 O)30+ H 2 O Al(OH)3(H 2 O)2 - + H+ 4+ 2+ O OH 2 Al Al Al O

Hidrólisis

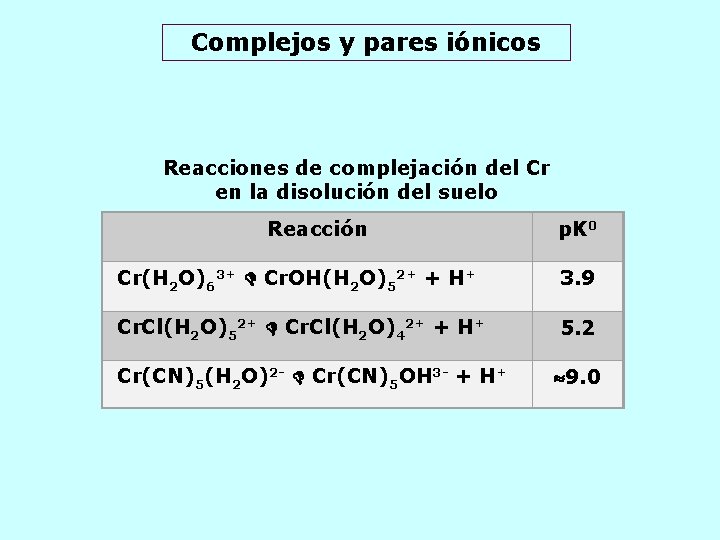
Complejos y pares iónicos Reacciones de complejación del Cr en la disolución del suelo Reacción p. K 0 Cr(H 2 O)63+ Cr. OH(H 2 O)52+ + H+ 3. 9 Cr. Cl(H 2 O)52+ Cr. Cl(H 2 O)42+ + H+ 5. 2 Cr(CN)5(H 2 O)2 - Cr(CN)5 OH 3 - + H+ 9. 0

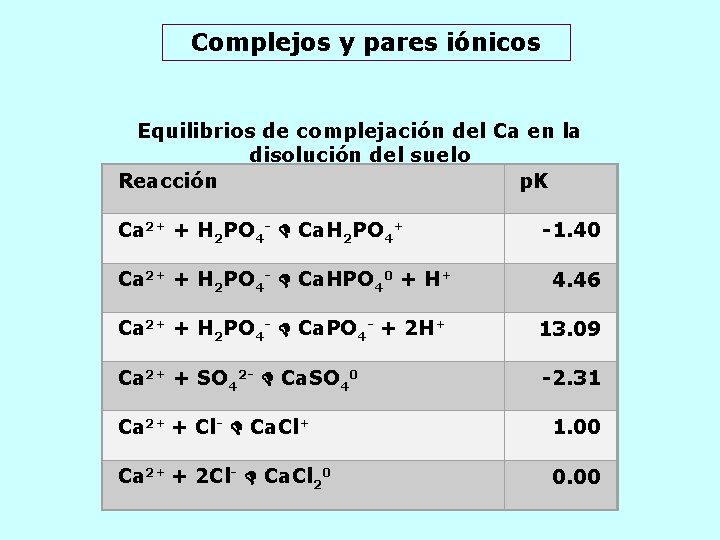
Complejos y pares iónicos Equilibrios de complejación del Ca en la disolución del suelo Reacción p. K Ca 2+ + H 2 PO 4 - Ca. H 2 PO 4+ -1. 40 Ca 2+ + H 2 PO 4 - Ca. HPO 40 + H+ 4. 46 Ca 2+ + H 2 PO 4 - Ca. PO 4 - + 2 H+ 13. 09 Ca 2+ + SO 42 - Ca. SO 40 -2. 31 Ca 2+ + Cl- Ca. Cl+ 1. 00 Ca 2+ + 2 Cl- Ca. Cl 20 0. 00

El p. H del suelo

p. H del suelo H+ marca el comportamiento del suelo desde el punto de vista químico y biológico p. H = -log [H+ ] p. H + p. OH = 14

FUENTES DE ACIDEZ

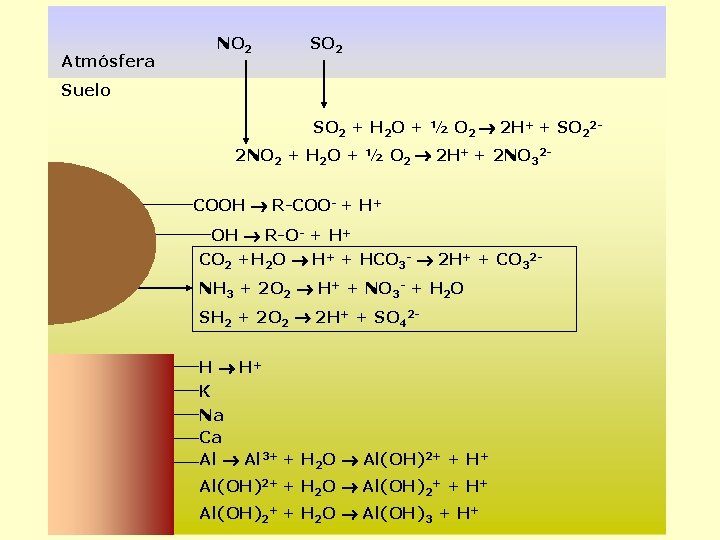
Atmósfera NO 2 SO 2 Suelo SO 2 + H 2 O + ½ O 2 2 H+ + SO 22 - 2 NO 2 + H 2 O + ½ O 2 2 H+ + 2 NO 32 - COOH R-COO- + H+ OH R-O- + H+ CO 2 +H 2 O H+ + HCO 3 - 2 H+ + CO 32 NH 3 + 2 O 2 H+ + NO 3 - + H 2 O SH 2 + 2 O 2 2 H+ + SO 42 H H+ K Na Ca Al 3+ + H 2 O Al(OH)2+ + H+ Al(OH)2+ + H 2 O Al(OH)3 + H+

LA LLUVIA ÁCIDA H+ NH 4+ Na+ Ca 2+ Mg 2+ SO 42 NO 3 - Cl- K+ Suelos forestales y de pradera • Lavado de los cationes alcalinos y alcalinotérreos • Disminución del p. H • Solubilización de metales tóxicos como el Al. • Reducción de la actividad de los microorganismos • Disminución de la productividad

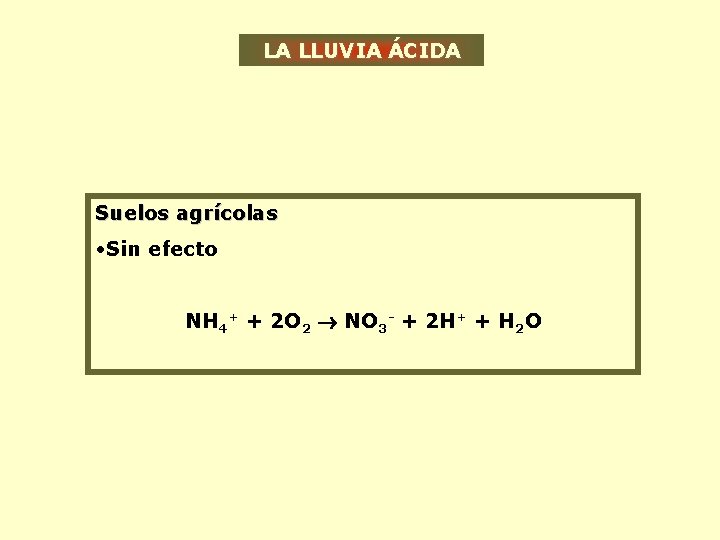
LA LLUVIA ÁCIDA Suelos agrícolas • Sin efecto NH 4+ + 2 O 2 NO 3 - + 2 H+ + H 2 O

SUELOS DE MINAS Y ÁCIDO SULFATO superficie de minas de carbón planicies marinas de templadas y tropicales inundación en Fe. S 2 + 15/4 O 2 + 7 H 2 O Fe(OH)3 + 2 H 2 SO 4 áreas

SUELOS DE MINAS Y ÁCIDO SULFATO

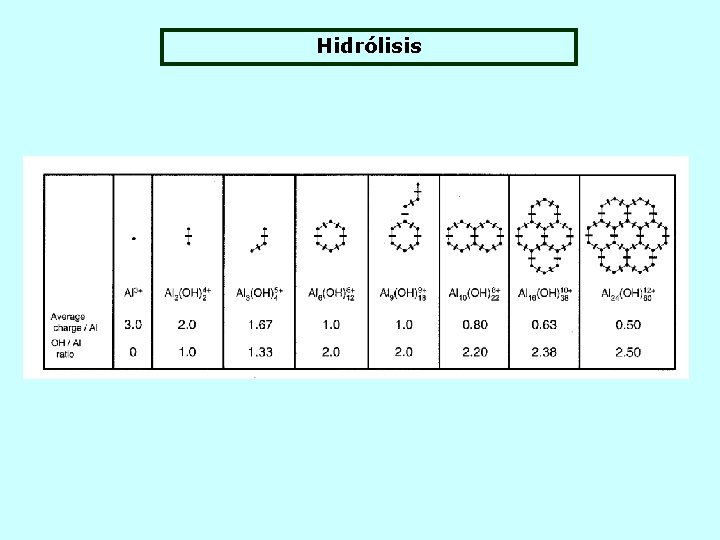
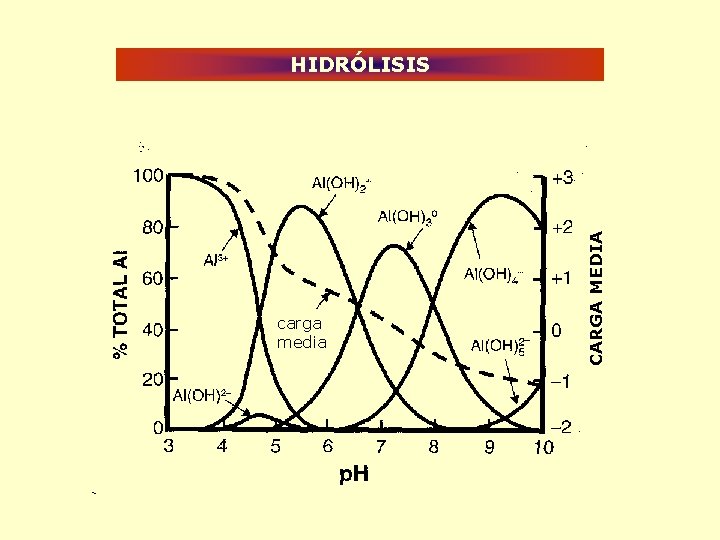
carga media CARGA MEDIA HIDRÓLISIS

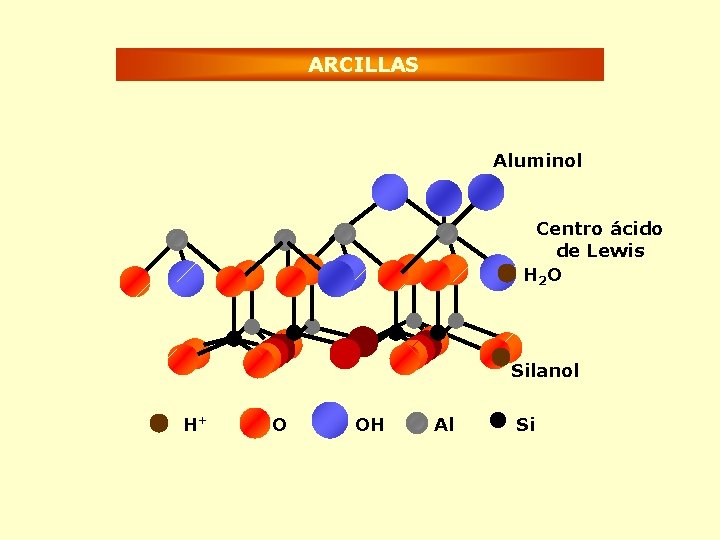
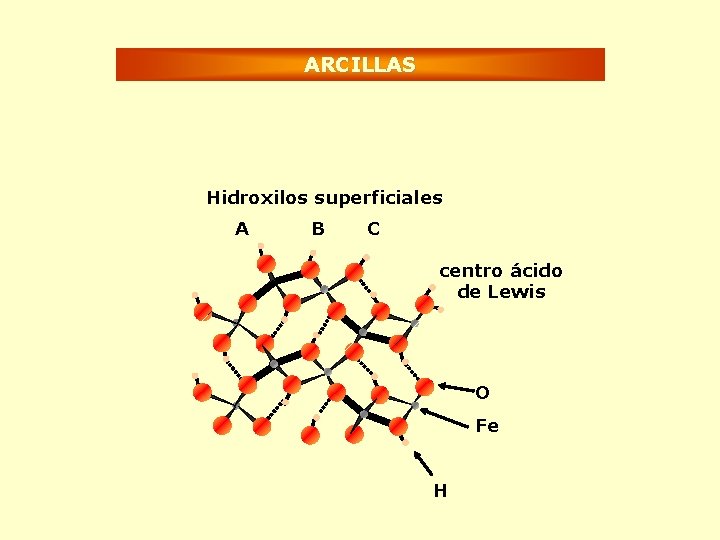
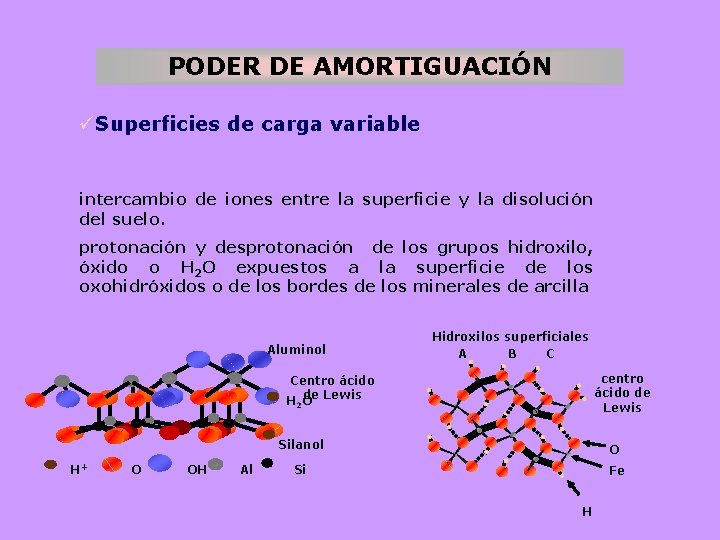
ARCILLAS Aluminol Centro ácido de Lewis H 2 O Silanol H+ O OH Al Si

ARCILLAS Hidroxilos superficiales A B C centro ácido de Lewis O Fe H

ARCILLAS Suelos muy ácidos H, Fe, Al Unidos por enlaces covalentes a los bordes de cristales de la arcilla difícilmente pasa a la disolución del suelo. Sólo en lugares de intercambio de carga permanente de los silicatos en equilibrio con el presente en la disolución del suelo.

ARCILLAS Suelos moderadamente ácidos Parte de los iones hidrógeno, unidos a lugares de carga variable, se pueden liberar más fácilmente Contribuyen con los retenidos en los lugares de carga permanente a la concentración de protones en la disolución del suelo.

ARCILLAS Suelos neutros y alcalinos La mayoría de las cargas dependientes del p. H, se han transformado en disponibles para el intercambio de cationes Hidrógeno sustituido por calcio, magnesio y otras bases

OTRAS FUENTES DE ACIDEZ Reacciones redox 4 Fe 2+ + O 2 + 10 H 2 O 4 Fe(OH)3 + 8 H+

OTRAS FUENTES DE ACIDEZ

FUENTES DE ALCALINIDAD

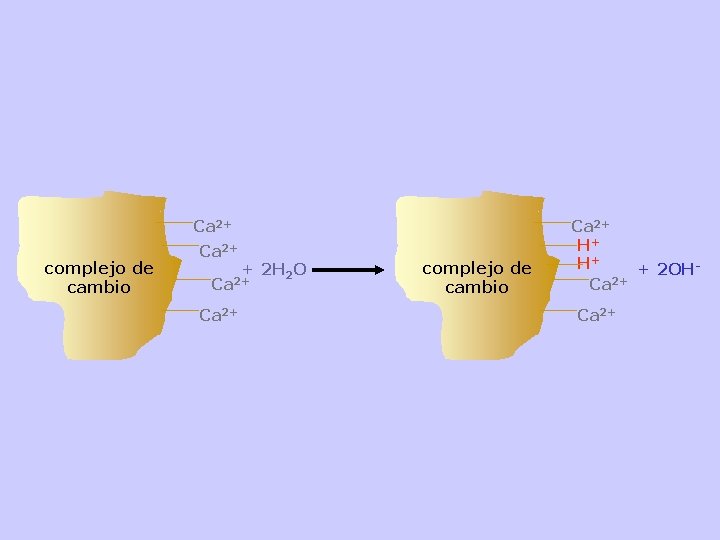
Ca 2+ complejo de cambio Ca 2+ + 2 H 2 O Ca 2+ complejo de cambio Ca 2+ H+ H+ + 2 OHCa 2+

SALES SOLUBLES Suelos salinos y sódicos (Aridisoles) Acumulación de Ca. CO 3; Mg. CO 3, Na 2 SO 4; Na. Cl Los cationes correspondientes saturan el complejo de cambio.

SALES SOLUBLES Si en el suelo predominan los carbonatos, el p. H final es como mucho 8. 5, p. H de equilibrio de la reacción de disolución del carbonato de Ca Ca. CO 3 + H 2 O Ca 2+ + CO 2 + 2 OH-

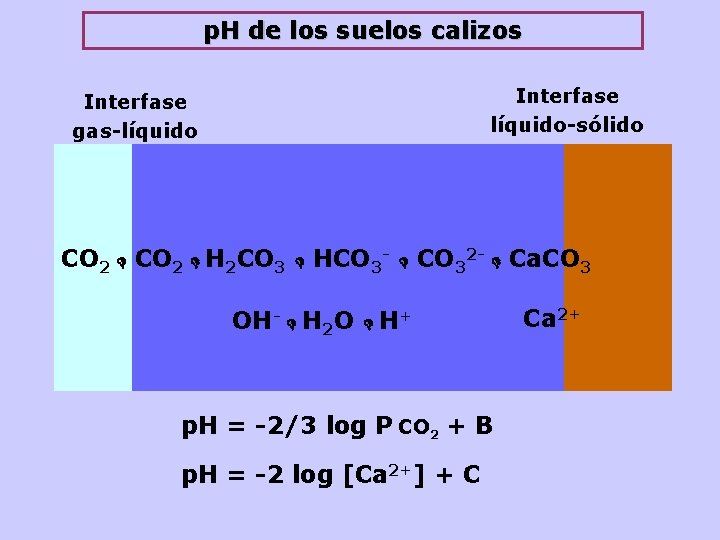
p. H de los suelos calizos Interfase líquido-sólido Interfase gas-líquido CO 2 H 2 CO 3 HCO 3 - CO 32 - Ca. CO 3 OH- H 2 O H+ p. H = -2/3 log P CO 2 + B p. H = -2 log [Ca 2+] + C Ca 2+

p. H de los suelos salinos Sales de ácidos fuertes y de bases fuertes: Sulfatos, cloruros, nitratos de calcio, magnesio y sodio p. H del orden de 8. 5 Sales de ácidos débiles Carbonatos de sodio, potasio magnesio p. H por encima aproximadamente. de 8. 5 hasta 10

p. H de los suelos salinos HCO 3 - y CO 32 - reaccionan con el ión H 3 O+ para fijar un protón: HCO 3 - + H 3 O+ H 2 CO 3 + H 2 O CO 32 - + 2 H 3 O+ H 2 CO 3 + 2 H 2 O Alc = [HCO 3 -] + 2[CO 32 -] + 2[OH-] - [H+] Alc = [Na+] + [K+] + 2[Ca 2+] + 2[Mg 2+] - [Cl- ] - 2[SO 42 -] p. H = log Alc - log PCO 2 + 7. 82

PODER DE AMORTIGUACIÓN

PODER DE AMORTIGUACIÓN resistencia que presenta el suelo a modificar su p. H cuando se le añaden ácidos o bases. permite mantener el p. H dentro de límites muy estrechos, evitando modificaciones radicales que afectarían negativamente a los microorganismos y plantas y al propio suelo

PODER DE AMORTIGUACIÓN Depende de: üDisolución del suelo üDisolución de minerales del suelo üSuperficies de carga permanente üSuperficies de carga variable

PODER DE AMORTIGUACIÓN üDisolución del suelo Ácidos disueltos Ácidos fuertes capacidad tampón alta a concentraciones altas mínima a valores de p. H de alrededor de 7, mayor a valores más bajos (<3) Ácidos débiles Carbonatos M. O. Capacidad tampón dependiente de la concentración y p. K de disociación Máxima p. K-1<p. H<p. K+1

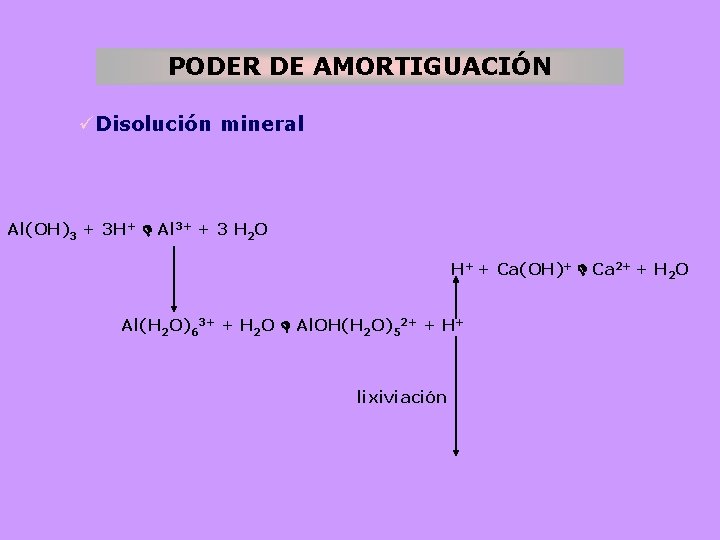
PODER DE AMORTIGUACIÓN üDisolución mineral Al(OH)3 + 3 H+ Al 3+ + 3 H 2 O H+ + Ca(OH)+ Ca 2+ + H 2 O Al(H 2 O)63+ + H 2 O Al. OH(H 2 O)52+ + H+ lixiviación

PODER DE AMORTIGUACIÓN üDisolución mineral gibbsita, caolinita, esmectitas, illitas, feldespatos Mayor capacidad si contienen Ca 2+, Mg 2+, Na+ y K+ Mayor capacidad cuanto más solubles

PODER DE AMORTIGUACIÓN üSuperficies de carga permanente intercambio de cationes entre la superficie y la disolución del suelo. Depende de: Tipo y concentración de iones en la superficie y en la disolución Tipo, características estructurales y afinidad relativa de la superficie por los distintos iones. Las arcillas saturadas de H son inestables

PODER DE AMORTIGUACIÓN üSuperficies de carga variable intercambio de iones entre la superficie y la disolución del suelo. protonación y desprotonación de los grupos hidroxilo, óxido o H 2 O expuestos a la superficie de los oxohidróxidos o de los bordes de los minerales de arcilla Aluminol Hidroxilos superficiales A B C centro ácido de Lewis Centro ácido de Lewis H 2 O Silanol O H+ O OH Al Si Fe H

PODER DE AMORTIGUACIÓN üSuperficies de carga variable Punto isoeléctrico (iep) p. H al cual se absorben cantidades iguales de H+ y de OH- Igual afinidad por los H+ que por los OH- iep 7, Mayor afinidad por los H+ iep > 7 Menor afinidad por los H+ iep<7

PODER DE AMORTIGUACIÓN üSuperficies de carga variable p. H < iep adsorción de H+ aumenta con la fuerza iónica y la carga de los iones de la disolución del suelo. p. H>iep adsorción de OH- aumenta con la fuerza iónica y la carga de los iones de la disolución del suelo.

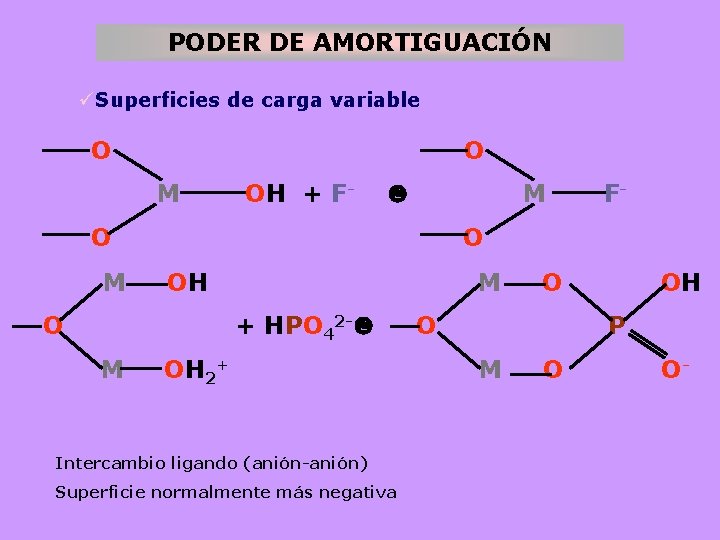
PODER DE AMORTIGUACIÓN üSuperficies de carga variable O M OH + F- M F- O M OH M O OH O + HPO 42 - O P M OH 2+ M O O- Intercambio ligando (anión-anión) Superficie normalmente más negativa

PODER DE AMORTIGUACIÓN üSuperficies de carga variable Punto cero de carga (pzc) el p. H al cual la carga neta de la superficie es cero La capacidad tampón de una superficie de carga variable es mínima en el pzc y aumenta conforme nos alejamos de él, La amortiguación depende de la diferencia entre el p. H de la disolución y el pzc.

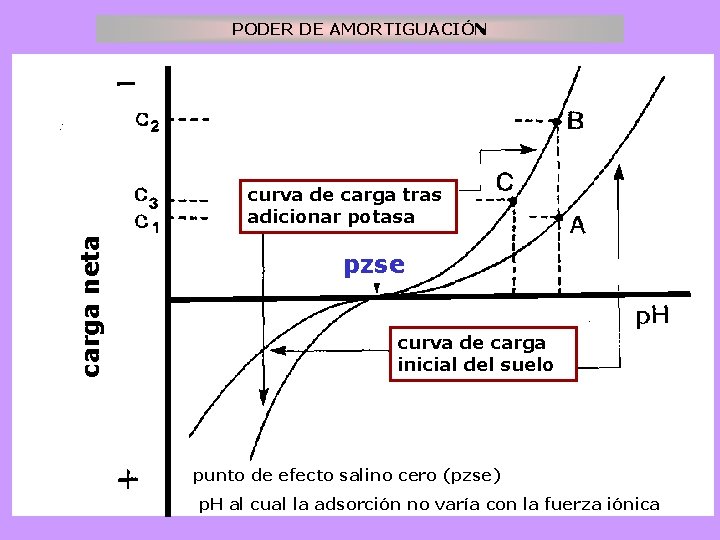
PODER DE AMORTIGUACIÓN üSuperficies de carga variable carga neta curva de carga tras adicionar potasa pzse curva de carga inicial del suelo punto de efecto salino cero (pzse) p. H al cual la adsorción no varía con la fuerza iónica

PODER DE AMORTIGUACIÓN üSuperficies de carga variable La materia orgánica La amortiguación por materia orgánica en la fase sólida es similar a su comportamiento en la disolución del suelo. Su capacidad depende del p. H del suelo y de si se acumula como ácido o su base conjugada.

RANGO DE p. H DE LOS SUELOS

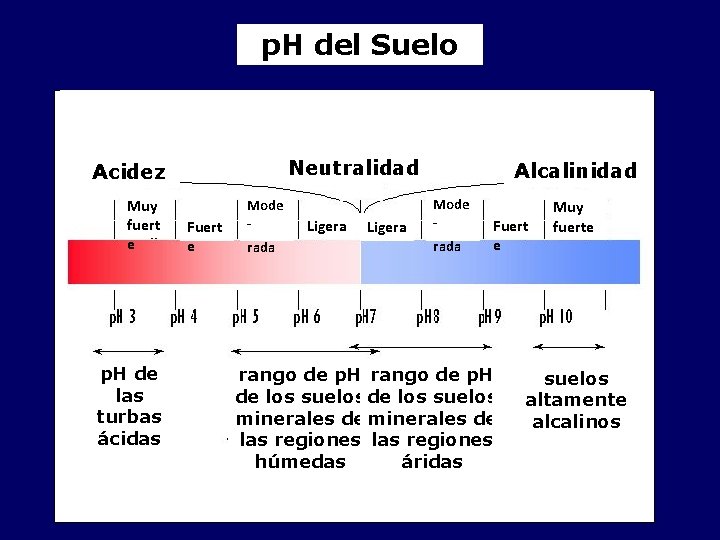
p. H del Suelo Neutralidad Acidez Muy fuert e p. H de las turbas ácidas Fuert e Mode rada Ligera Alcalinidad Mode rada Fuert e rango de p. H de los suelos minerales de las regiones húmedas áridas Muy fuerte suelos altamente alcalinos

p. H del Suelo El p. H y el grado de saturación de los suelos varían de forma limitada en función de las estaciones del año. Suelos con vegetación permanente su valor medio refleja un estado de equilibrio característico del perfil. p. H ± 1 Producción de iones H+ durante la humificación se compensa con el aporte de iones básicos (procesos de alteración y de los ascensos biológicos). Suelos agrícolas puede que no exista compensación por la extracción de bases por las cosechas.

TIPOS DE ACIDEZ DEL SUELO

Acidez actual: concentración de iones H 3 O+ libres que existen en la disolución del suelo Acidez potencial: la suma de los iones H+ de cambio que constituyen una "reserva", actualmente no disponible

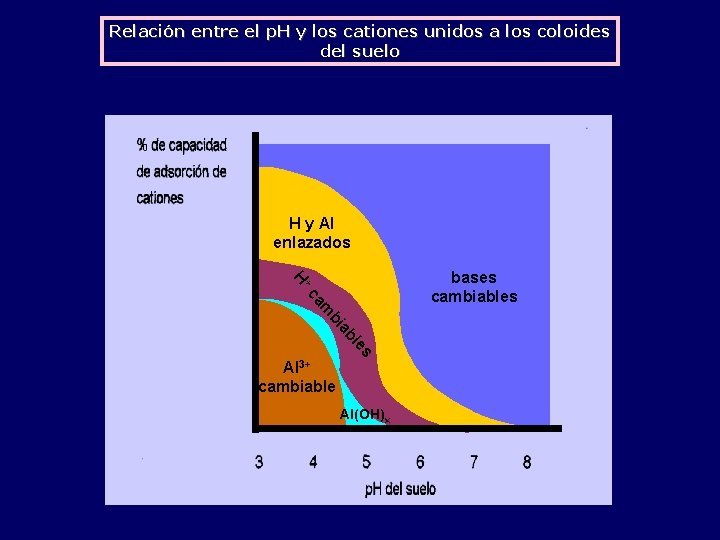
Relación entre el p. H y los cationes unidos a los coloides del suelo H y Al enlazados + H bases cambiables s le ab bi m ca Al 3+ cambiable Al(OH)x

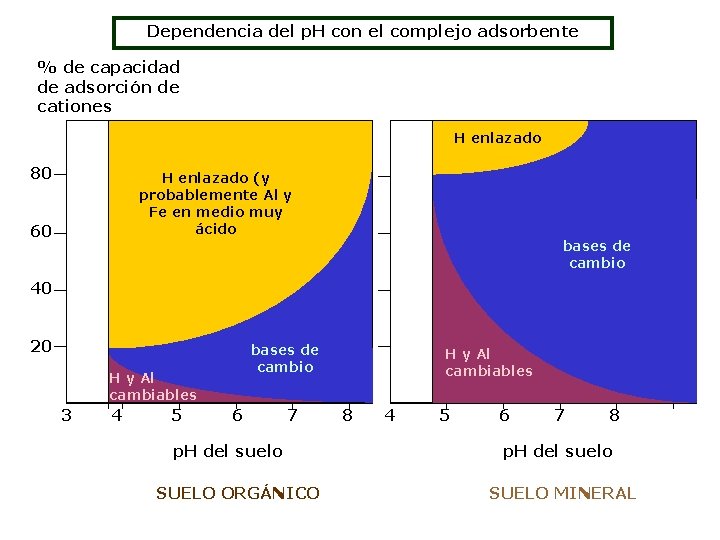
Dependencia del p. H con el complejo adsorbente % de capacidad de adsorción de cationes H enlazado 80 60 H enlazado (y probablemente Al y Fe en medio muy ácido bases de cambio 40 20 H y Al cambiables bases de cambio H y Al cambiables 3 4 5 6 7 8 4 5 6 7 8 p. H del suelo SUELO ORGÁNICO SUELO MINERAL

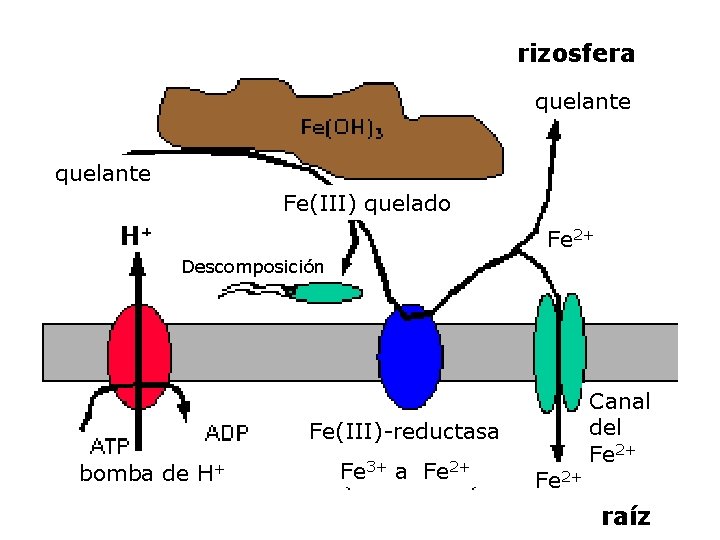
rizosfera quelante Fe(III) quelado Fe 2+ Descomposición Fe(III)-reductasa bomba de H+ Fe 3+ a Fe 2+ Canal del Fe 2+ raíz

Contribución de los minerales de arcilla al p. H del suelo Acidez H enlazados covalentemente H de cambio
 Agentes generadores de suelos
Agentes generadores de suelos Composicin
Composicin Composicion de color
Composicion de color Mezcla homognea
Mezcla homognea Disolucin
Disolucin Acudos fuertes
Acudos fuertes Disolucin
Disolucin Disoluciones
Disoluciones Estructura granular simple
Estructura granular simple Clase textural del suelo
Clase textural del suelo Suelos zonales y azonales
Suelos zonales y azonales Erosión hídrica del suelo
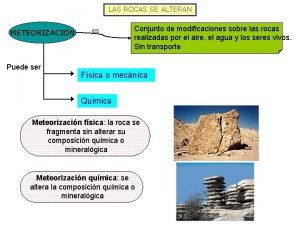
Erosión hídrica del suelo Geomorfologia rocas y suelos
Geomorfologia rocas y suelos Composicion del suelo
Composicion del suelo Importacia del suelo
Importacia del suelo Peso especifico del suelo
Peso especifico del suelo Factores que intervienen en la formación de los suelos
Factores que intervienen en la formación de los suelos Conclusión de la contaminación del suelo
Conclusión de la contaminación del suelo Componentes del suelo
Componentes del suelo Caracteristicas de un suelo fertil
Caracteristicas de un suelo fertil Fase liquida del suelo
Fase liquida del suelo Organizacion del suelo
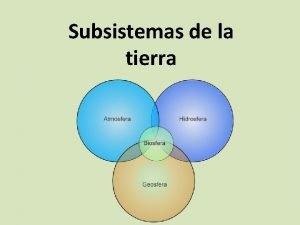
Organizacion del suelo Subsistemas de la tierra geosfera
Subsistemas de la tierra geosfera Carbono del suelo
Carbono del suelo Horizontes del suelo
Horizontes del suelo Perfil y horizonte del suelo
Perfil y horizonte del suelo Cuál es la función del suelo en los ecosistemas
Cuál es la función del suelo en los ecosistemas Cuadro comparativo del agua aire y suelo
Cuadro comparativo del agua aire y suelo Gigaspora gigantea
Gigaspora gigantea Normas de suelo
Normas de suelo Suelo de la región insular
Suelo de la región insular Lilia ayala rojas
Lilia ayala rojas Pradera tipo de suelo
Pradera tipo de suelo Ciencia que estudia los suelos
Ciencia que estudia los suelos Radiante
Radiante ¿quién va a el suelo? a. sacudir b. barrer c. planchar
¿quién va a el suelo? a. sacudir b. barrer c. planchar Ley de suelo canarias
Ley de suelo canarias Tipos de mejoradores de suelo
Tipos de mejoradores de suelo Porqu es
Porqu es El petrolero prestige se hundio en el mar a 133 millas
El petrolero prestige se hundio en el mar a 133 millas De que esta hecho el suelo
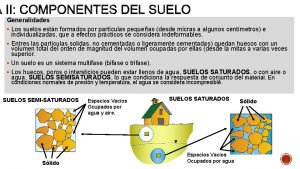
De que esta hecho el suelo Suelo saturado
Suelo saturado Barrer el suelo cocinar
Barrer el suelo cocinar Se echa en el suelo la bestia
Se echa en el suelo la bestia Plan andaluz de vivienda y suelo
Plan andaluz de vivienda y suelo Suelos calizos
Suelos calizos Yo soy del sur ecos del rocio
Yo soy del sur ecos del rocio Diferencias entre la via aerea del adulto y del niño
Diferencias entre la via aerea del adulto y del niño Clases de extintores y colores
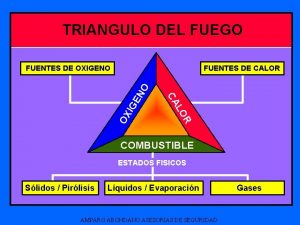
Clases de extintores y colores El calor es uno de los elementos del triángulo del fuego
El calor es uno de los elementos del triángulo del fuego Teatro absurdo caracteristicas
Teatro absurdo caracteristicas Preguntas sobre el tacto
Preguntas sobre el tacto Los colores de la bandera del sena son:
Los colores de la bandera del sena son: Nivel de investigación
Nivel de investigación Santo rosario corazones
Santo rosario corazones Sanidad interior espíritu alma y cuerpo
Sanidad interior espíritu alma y cuerpo