Clculo de Unidades Qumicas de Concentracin Grupos 202

















- Slides: 18

Cálculo de Unidades Químicas de Concentración Grupos 202 y 205 Biól. Margarita Contreras Marmolejo

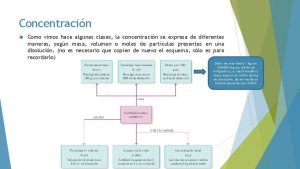
• Recuerda que las unidades de concentración en una solución son de dos tipos: • Unidades Física • • Porcentaje en masa (% p/p masa) Porcentaje en volumen (% v/v volumen) Porcentaje peso-volumen (% P/V Unidad clásica En Ciencias de la Salud) Partes por millón- partes por billón. (ppm-ppb) • Unidades Químicas • Molaridad (M) • Normalidad (N) • Molalidad (m)


Hoy veremos las unidades químicas • Y comenzamos con la Molaridad (M) • Fórmula de La Molaridad es: • M = n/ V • M = m/(PM)(V) • • • De donde: M = molaridad n = moles V = Volumen en litros PM = Peso molecular m = Masa del compuesto en gramos

• para esto te invito a que veas Los siguientes Link 1. https: //www. youtube. com/watch? v=x. WZzkxdlo. Ss 2. https: //www. youtube. com/watch? v=1 x. U 6 ts. L 3 KAo 3. https: //www. youtube. com/watch? v=Cwt. V 2 Kd-Ooo Este link es el más completo. Recuerda usar tu Tabla Periódica. Al terminar de ver los vídeos, resuelve los problemas que vienen en las copias del libro que sacamos de la biblioteca en la página 434 y los ejercicios son del 14. 41 al 14. 46. Del libro Fundamentos de Química de Ralph Burns.

• Si no tienes las copias aquí te pongo otros ejemplos para resolver. 1. ¿Cuántos gramos de nitrato de potasio KNO 3, se necesitan para preparar 500 ml de una solución 0. 100 M? 2. ¿Cuántos gramos de sulfato de cobre II, Cu. SO 4, se necesitan para preparar 250 ml, de una solución 0. 100 M? 3. ¿Cuántos gramos de glucosa, C 6 H 12 O 6, se necesitan para preparar 250 ml de una solución 0. 150 M? 4. ¿Cuántos ml de una solución de glucosa 0. 150 M se deben emplear para obtener 2. 00 gramos de glucosa?

Ahora pasemos a resolver problemas de la NORMALIDAD • Fórmula de Normalidad • N = # eq en gramos/ Volumen (L) de la solución • Masa equivalente = masa molecular/parámetro • Parámetro en el número de valencia de la sustancia Ejemplo: Ca(OH)2 = 2 OH H 3 PO 4 = 3 H Na 2 CO 3 = 2 carga neta del metal • Fórmula unificada • N =( Masa)(Parámetro)/(Masa molecular)(Volumen en Litros)

Resuelve los siguientes problemas de Normalidad 1. ¿Cuál es la normalidad de una solución de HCL que tiene 0. 15 equivalentes del ácido en 2 L de la solución? 2. Calcular la Normalidad de una solución de ácido sulfúrico H 2 SO 4 que tiene 25 gramos del ácido en 750 ml. 3. ¿Cuál es la normalidad de una solución de HCl que tiene 0. 25 equivalentes del ácido en 1. 5 L de la solución?

Calculemos la Molalidad • https: //www. youtube. com/watch? v=o. OAPxbaq 8 k. Q • Fórmula de Molalidad (m) • m = gramos /(PM)(Kg de agua) ó • m = moles de soluto/masa del solvente (kg) • De donde: • m = molalidad • PM= Peso Molecular

Resuelve los siguientes problemas 1. Calcula la molalidad de la solución resultante al disolver 3 gr de Na. OH en 750 ml de agua. 2. Calcula la molalidad de la solución resultante al disolver 4. 5 gr de Ca(OH)2 en 450 ml de agua. 3. Calcular la molalidad de la solución resultante al disolver 10 gr de Na. OH en 1 Kg de agua.

Relación entre Normalidad y Molaridad • Para una misma solución se cumple: • N = (M)(parámetro) • De donde: • N = Normalidad • M = Molaridad • Ejemplo: • Calcular la Normalidad de una solución de H 2 SO 4 0. 2 M N = (0. 2)(2) N= 4

Fracción molar • Fracción molar (X) • Este es el número de moles de un compuesto dividido por el número total de moles de todas las especies químicas en la solución. Tenga en cuenta, la suma de todas las fracciones molares en una solución siempre es igual a 1. • Ejemplo: • ¿Cuáles son las fracciones molares de los componentes de la solución que se forma cuando 92 g de glicerol se mezcla con 90 g de agua? (Peso molecular del agua = 18 uma; peso molecular del glicerol = 92 uma) • Solución: • 90 g de agua / 18 g = 5 mol de agua. • 92 g de glicerol / 92 g = 1 mol de glicerol • total de moles = 5 + 1 = 6 mol • X(AGUA) = 5 mol / 6 mol = 0, 833 • X(GLICEROL)=1 mol/ 6 mol = 0, 167 • Es una buena idea para comprobar asegurárse de que las fracciones molares suman 1: • X(AGUA)+ x(Glicerol) = 0, 833 + 0, 167 = 1, 000




Resumen • Ve el siguiente link para tener una visión completa con unidades físicas y químicas de concentración. https: //www. youtube. com/watch? v=4 YP 2 o 9 x 87 H 4 • Este link te hace un resumen de las unidades física y química.

• Espero te haya ayudado a comprender los cálculos de soluciones. • Resuelve problemas para reforzar el conocimiento. • Busca tutoriales sobre el tema. • Bibliografía: • Fundamentos de Química de Ralph A. Burns. 5° Ed. Ed Pearson.

• DROE. • Biól. Margarita Contreras Marmolejo. • 30 de Marzo del 2020. • CONALEP