Chemick reakcie Opakovanie uiva 8 ronka Chemick reakcie









- Slides: 12

Chemické reakcie Opakovanie učiva 8. ročníka

Chemické reakcie premeny, pri ktorých sa narušia staré väzby medzi atómami a vznikajú nové Reaktanty - látky, ktoré spolu reagujú Produkty – látky, ktoré reakciou vznikajú reaktanty produkty

Pokus: Reakcia sodíka s chlórom http: //www. chemie-interaktiv. net/html_flash/ff_naclsynthese 1. swf http: //www. chemie-interaktiv. net/html_flash/ff_naclsynthese_schalenmodell. swf

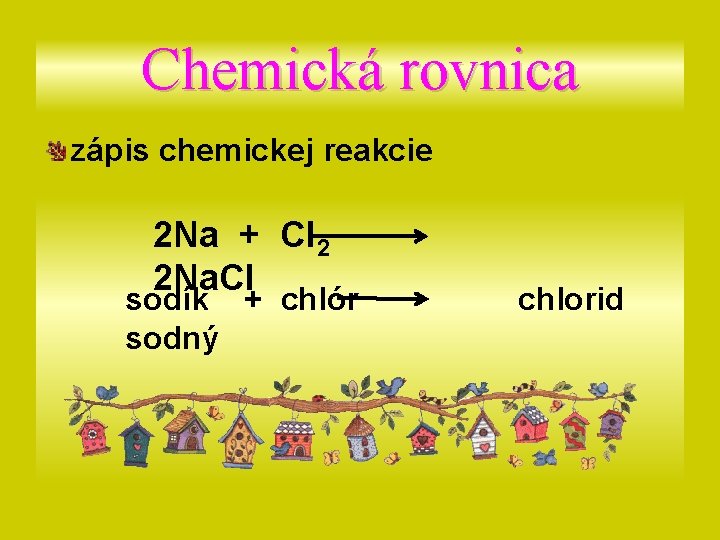
Chemická rovnica zápis chemickej reakcie 2 Na + Cl 2 2 Na. Cl sodík + chlór sodný chlorid

Zákon zachovania hmotnosti Hmotnosť reaktantov sa rovná hmotnosti produktov (v uzavretej sústave). Celkový počet atómov jednotlivých prvkov v reaktantoch je rovnaký ako celkový počet atómov jednotlivých. Antoine prvkov v produktoch. Lavoisier 1774 Michail Lomonosov 1748

Zákon zachovania hmotnosti počet a druh atómov sa pri chemických reakciách nemení pri chemických reakciách atómy nevznikajú ani nezanikajú atóm jedného prvku sa nemôže premeniť na atóm iného prvku v priebehu reakcie nastáva spájanie, oddeľovanie a preskupovanie atómov

Stechiometrické koeficienty na vyrovnanie počtov atómov v rovnici

Chemické zlučovanie z väčšieho počtu reaktantov vznikne jeden produkt napr. 4 z vodíka 5 a chlóru vzniká 2 chlorovodík 4 P Fe 2 H 2 Mg 4 Al +3 O 2 + Cl 2 +3 O 2 + O 2 2 2 P 2 O 5 Fe 2 O 3 HCl Mg. O Al 2 O 3

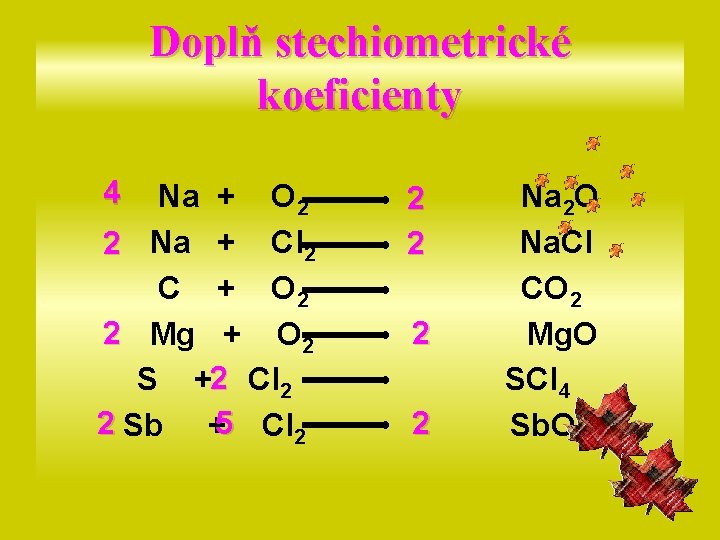
Doplň stechiometrické koeficienty 4 Na + O 2 2 Na + Cl 2 C + O 2 2 Mg + O 2 S +2 Cl 2 2 Sb +5 Cl 2 2 2 Na 2 O Na. Cl CO 2 Mg. O SCl 4 Sb. O 5

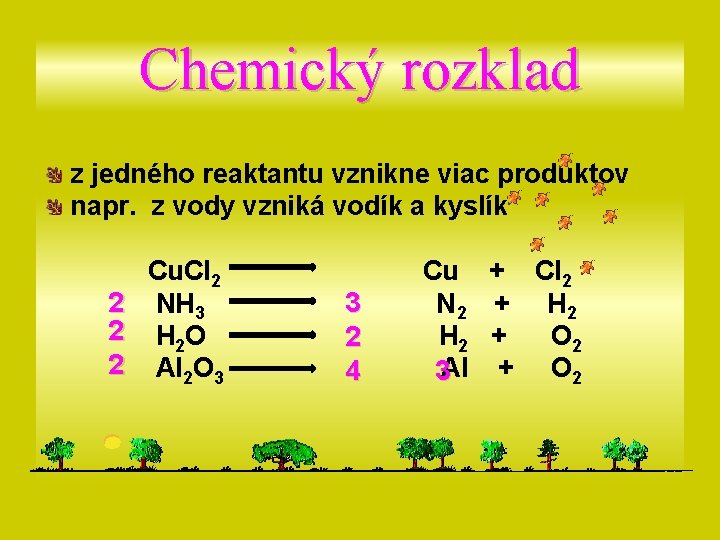
Chemický rozklad z jedného reaktantu vznikne viac produktov napr. z vody vzniká vodík a kyslík Cu. Cl 2 2 NH 3 2 H 2 O 2 Al 2 O 3 3 2 4 Cu + Cl 2 N 2 + H 2 + O 2 3 Al + O 2

Zdroje: E. Adamkovič, J. Šimeková, Chémia 9 www. gify. nou. cz http: //www. clker. com/

Ďakujem za pozornosť! Mgr. Mariana Pavelčáková © 2010























