Redoxn reakcie 1 REDOXN REAKCIE Chemick reakcie pri






- Slides: 16

Redoxné reakcie 1

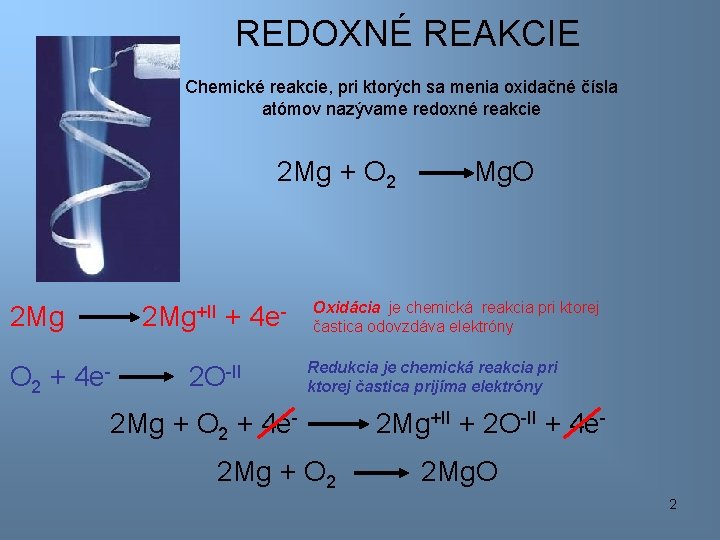
REDOXNÉ REAKCIE Chemické reakcie, pri ktorých sa menia oxidačné čísla atómov nazývame redoxné reakcie 2 Mg + O 2 2 Mg+II + 4 e- O 2 + 4 e- 2 O-II Mg. O Oxidácia je chemická reakcia pri ktorej častica odovzdáva elektróny Redukcia je chemická reakcia pri ktorej častica prijíma elektróny 2 Mg + O 2 + 4 e 2 Mg + O 2 2 Mg+II + 2 O-II + 4 e 2 Mg. O 2

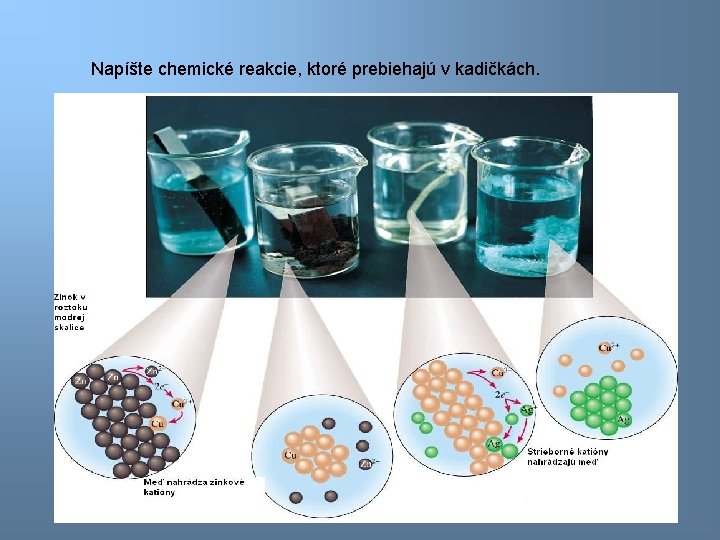
Napíšte chemické reakcie, ktoré prebiehajú v kadičkách. 3

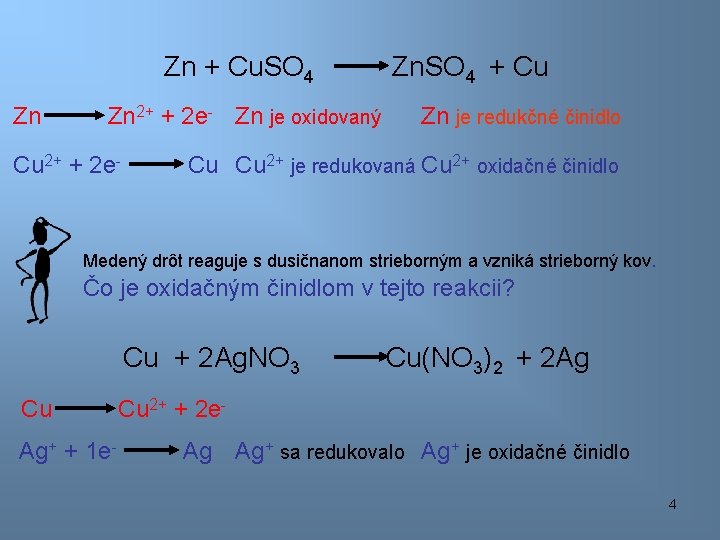
Zn + Cu. SO 4 Zn Zn 2+ + 2 e- Zn je oxidovaný Cu 2+ + 2 e- Zn. SO 4 + Cu Zn je redukčné činidlo Cu Cu 2+ je redukovaná Cu 2+ oxidačné činidlo Medený drôt reaguje s dusičnanom strieborným a vzniká strieborný kov. Čo je oxidačným činidlom v tejto reakcii? Cu + 2 Ag. NO 3 Cu Ag+ + 1 e- Cu(NO 3)2 + 2 Ag Cu 2+ + 2 e. Ag Ag+ sa redukovalo Ag+ je oxidačné činidlo 4

Oxidačné číslo alebo oxidačný stupeň vyjadruje počet elektrónov, ktoré by atóm odovzdal alebo prijal pri úplnej polarizácii väzieb. . Oxidačné číslo nie je skutočná fyzikálna veličina, slúži len ako pomôcka (hlavne) pri tvorbe názvoslovia anorganických zlúčenín. Jeho hodnota sa zapisuje rímskymi číslicami ako horný index napravo od atómu (resp. skupiny atómov) a pohybuje sa v intervale od -IV do VIII) 5

Oxidačné číslo 1. Voľné prvky majú oxidačné číslo Na, Be, K, Pb, H 2, O 2, P 4 = 0 2. Jednoatómové ióny majú oxidačné číslo rovné náboju iónu. Li+, Li = +I; Fe 3+, Fe = +III; O 2 -, O = -II 3. Oxidačné číslo kyslíka je obyčajne –II. V H 2 O 2 a O 22 - sa rovná –I. 6

4. Oxidačné číslo vodíka je +I. V hydridoch kovov má vodík oxidačné číslo –I. 5. V skupine IA majú kovy +I, v IIA skupine kovy +II a halogény –I. 6. Súčet oxidačných čísel v reakcii sa rovná nule Určite všetky oxidačné čísla v zlúčenine H 2 CO 3 ? O = -II H = +I 3 x(-II) + 2 x(+I) + ? = 0 C = +IV 7

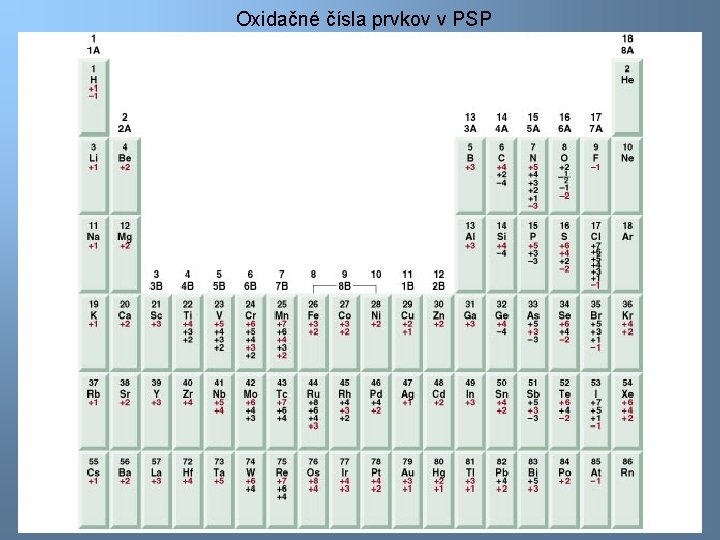
Oxidačné čísla prvkov v PSP 8

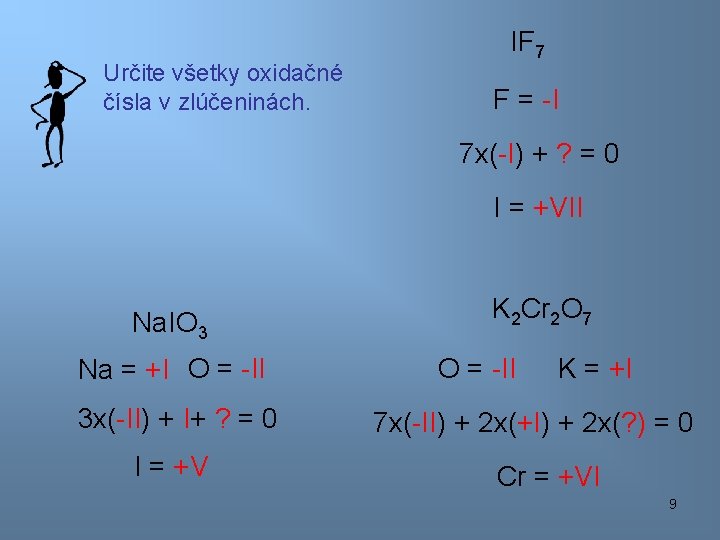
Určite všetky oxidačné čísla v zlúčeninách. IF 7 F = -I 7 x(-I) + ? = 0 I = +VII Na. IO 3 Na = +I O = -II 3 x(-II) + I+ ? = 0 I = +V K 2 Cr 2 O 7 O = -II K = +I 7 x(-II) + 2 x(+I) + 2 x(? ) = 0 Cr = +VI 9

Typy oxidačno-redukčných reakcií Syntéza A+B C 0 +IV -II 0 S + O 2 SO 2 Rozklad C +I +V -II 2 KCl. O 3 A+B +I -I 0 2 KCl + 3 O 2 10

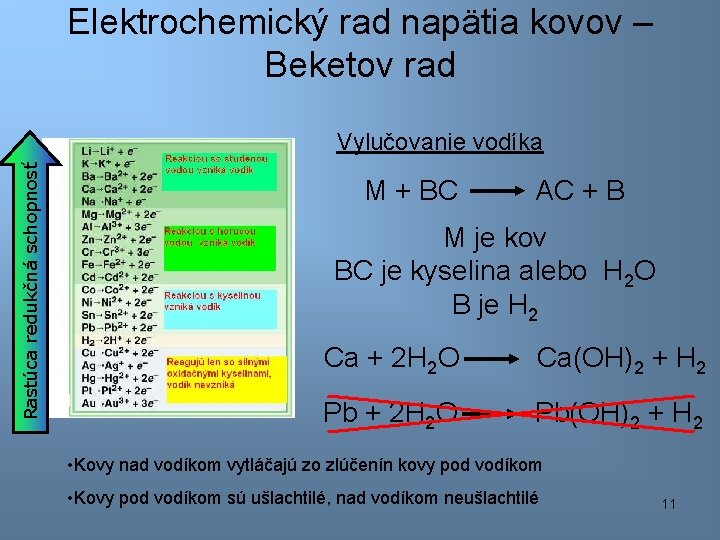
Elektrochemický rad napätia kovov – Beketov rad Rastúca redukčná schopnosť Vylučovanie vodíka M + BC AC + B M je kov BC je kyselina alebo H 2 O B je H 2 Ca + 2 H 2 O Ca(OH)2 + H 2 Pb + 2 H 2 O Pb(OH)2 + H 2 • Kovy nad vodíkom vytláčajú zo zlúčenín kovy pod vodíkom • Kovy pod vodíkom sú ušlachtilé, nad vodíkom neušlachtilé 11

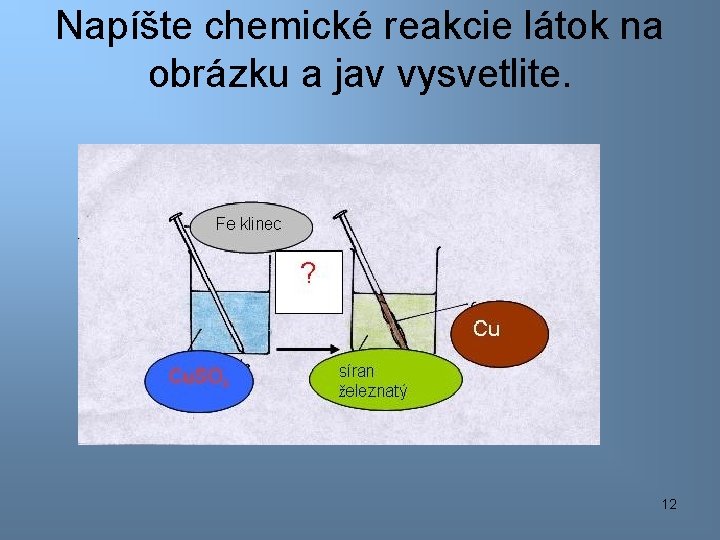
Napíšte chemické reakcie látok na obrázku a jav vysvetlite. 12

Korózia je zmena povrchu kovu pôsobením vonkajších činiteľov- vody, kyslíka, koróznych plynov. Hrdza – vzniká na povrchu železných predmetov, predmety ničí. Príčinou hrdze je vznik korózneho článku 2 Fe + O 2 + 2 H 2 O 2 Fe(OH)2 Medenka – Cu. CO 3. Cu(OH)2 – medené predmety chráni 13

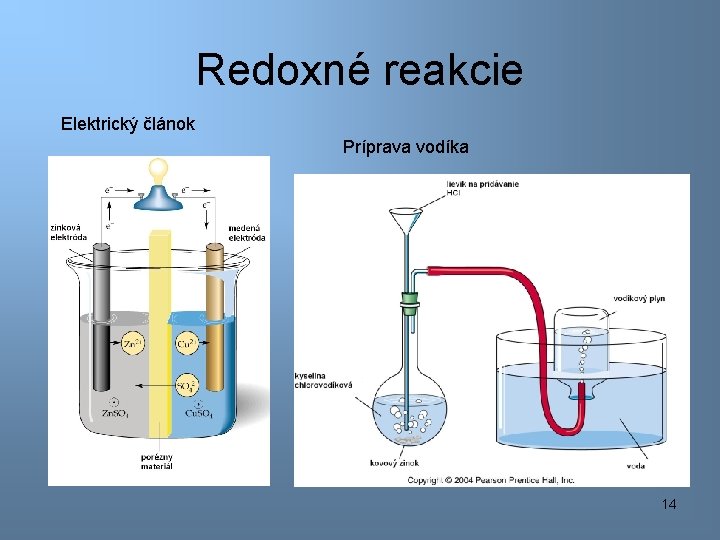
Redoxné reakcie Elektrický článok Príprava vodíka 14

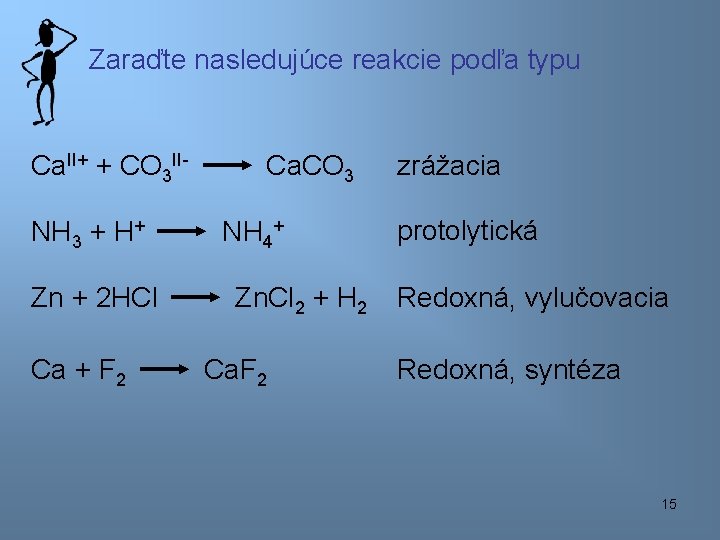
Zaraďte nasledujúce reakcie podľa typu Ca. II+ + CO 3 IINH 3 + H+ Zn + 2 HCl Ca + F 2 Ca. CO 3 NH 4+ Zn. Cl 2 + H 2 Ca. F 2 zrážacia protolytická Redoxná, vylučovacia Redoxná, syntéza 15

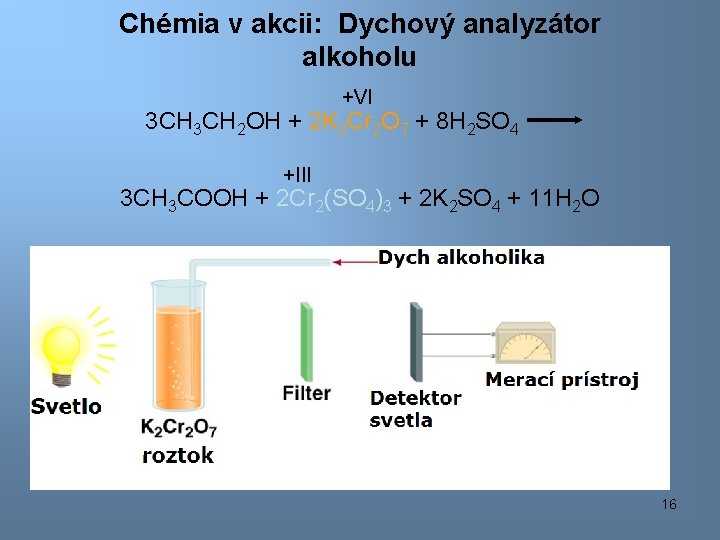
Chémia v akcii: Dychový analyzátor alkoholu +VI 3 CH 2 OH + 2 K 2 Cr 2 O 7 + 8 H 2 SO 4 +III 3 CH 3 COOH + 2 Cr 2(SO 4)3 + 2 K 2 SO 4 + 11 H 2 O 16
 Adriana chemick
Adriana chemick Adriana chemick
Adriana chemick Hydroxidy vzorce
Hydroxidy vzorce Adriana chemick
Adriana chemick Adriana chemick
Adriana chemick Adriana chemick
Adriana chemick Redoxn's
Redoxn's Beketov rad kovov
Beketov rad kovov Exotermické reakcie
Exotermické reakcie Redoxní reakce
Redoxní reakce Protolytické reakcie príklady
Protolytické reakcie príklady Koeficient reakcie
Koeficient reakcie Ionovy sucin vody
Ionovy sucin vody Exotermické reakcie príklady
Exotermické reakcie príklady Schema hasenia vapna
Schema hasenia vapna Vplyv teploty na rýchlosť chemickej reakcie
Vplyv teploty na rýchlosť chemickej reakcie Hypersenzitivita
Hypersenzitivita