Chapitre 8 Sauts lectroniques dans les molcules diatomiques

























- Slides: 39

Chapitre 8 Sauts électroniques dans les molécules diatomiques hn Guy Collin, 2014 -12 -29

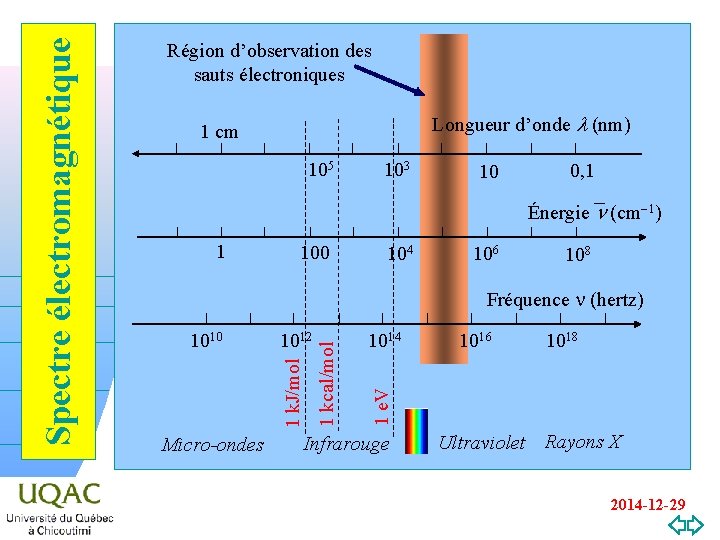
SAUTS ÉLECTRONIQUES DANS LES MOLÉCULES DIATOMIQUES La molécule diatomique absorbe de l’énergie sous forme rotationnelle et vibrationnelle. Elle peut aussi en absorber sous la forme de transition électronique. Cette absorption d’énergie est observable dans la région de l’ultraviolet. n Quelles en sont les lois ? n Est-ce que les transitions de rotation et de vibration sont en même temps excitées ? hnn Si oui, est-ce que les lois qui régissent ces transitions sont conservées ? n v=0 2014 -12 -29

105 103 10 0, 1 Énergie n (cm-1) 1 100 104 106 108 1012 Micro-ondes 1014 1016 1018 1 e. V 1010 1 kcal/mol Fréquence n (hertz) hn v=0 Longueur d’onde l (nm) 1 cm 1 k. J/mol Spectre électromagnétique Région d’observation des sauts électroniques Infrarouge Ultraviolet Rayons X 2014 -12 -29

Sauts électroniques dans une molécule Faits expérimentaux n n hn v=0 n Dans la partie visible et ultraviolette du domaine des radiations électromagnétiques, on observe des spectres d'émission et d'absorption. On observe des bandes sous faible dispersion. Ces bandes peuvent être résolues en raies sous dispersion élevée. 2014 -12 -29

Sauts électroniques dans une molécule Faits expérimentaux On peut lier les nombres d'ondes correspondant à certaines têtes de bandes par la formule empirique : n n = d + b k - c k 2 où k = nombre entier n hn n v=0 Les constantes b et c sont les mêmes que celles qui ont été introduites à propos des spectres de vibration. Pour une seule molécule, on peut trouver plusieurs groupes de bandes. 2014 -12 -29

Sauts électroniques dans une molécule Faits expérimentaux La structure de chaque bande peut également être analysée et les nombres d'onde des raies reliés par une formule empirique. n Cette formule fait intervenir la constante a des spectres de rotation. n Ces spectres se trouvent dans la région 0, 5 mm à 0, 1 mm et correspondent à des énergies de l'ordre de 240 hn à 1 200 k. J/mol. n L’ordre de grandeur est bien supérieur aux énergies v = 0 mises en jeu par la vibration ou la rotation. n 2014 -12 -29

États d’énergie électronique dans une molécule En première approximation, la molécule peut être traitée à l'aide de la théorie simple de BOHR ; c'est-àdire que l'on peut admettre l'existence d'orbitales sur lesquelles seraient placés les électrons. n À chaque orbitale correspondrait une énergie électronique bien définie. n Les orbitales seraient discrètes c'est-à-dire hn correspondraient à des valeurs discontinues de l'énergie. n v=0 2014 -12 -29

États d’énergie électronique dans une molécule n hn v=0 On peut aller plus loin et caractériser une orbitale par les nombres quantiques habituels : moment cinétique orbital et moment cinétique de spin s : F Valeur du moment cinétique orbital total 0 1 F État de l'atome. . . S P D F État de la molécule. . . S P D 2 etc. 2014 -12 -29

États d’énergie électronique dans une molécule n n n hn v=0 On complète l'indication de l'état en notant le spin total en haut et à gauche, comme pour l'électron, par la valeur 2 S + 1 (multiplicité). On aura ainsi des états 1 S, 1 P pour un spin total nul, 2 S, 2 P pour spin total 1/2, etc. On n’a observé pour chaque molécule étudiée qu'un nombre restreint de niveaux électroniques : une quarantaine dans le cas de N 2, de O 2, de NO, une vingtaine pour HCl. . . 2014 -12 -29

L'observation expérimentale des états d’énergie électronique Il existe aussi des règles de sélection assez strictes ; seul un petit nombre de transitions sont possibles. n Comme l’énergie mise en jeu est beaucoup plus grande que celle nécessaire pour la vibration ou la rotation, tous ces processus sont observables. n La théorie ne peut être menée à des conclusions hn valables que dans le cas de molécules très simples. n v=0 2014 -12 -29

Diagramme des états d'énergie et spectre observé Une molécule a donc plusieurs courbes de potentiel, une pour chaque état électronique. n À chaque niveau électronique correspond une courbe de potentiel avec les niveaux possibles d'énergie de vibration. n Sur chaque niveau de vibration viennent se superposer les niveaux possibles de rotation. hn n Les spectres observés résultent de transitions entre niveaux de vibration et de rotation correspondant à v = 0 deux états électroniques différents. 2014 -12 -29 n

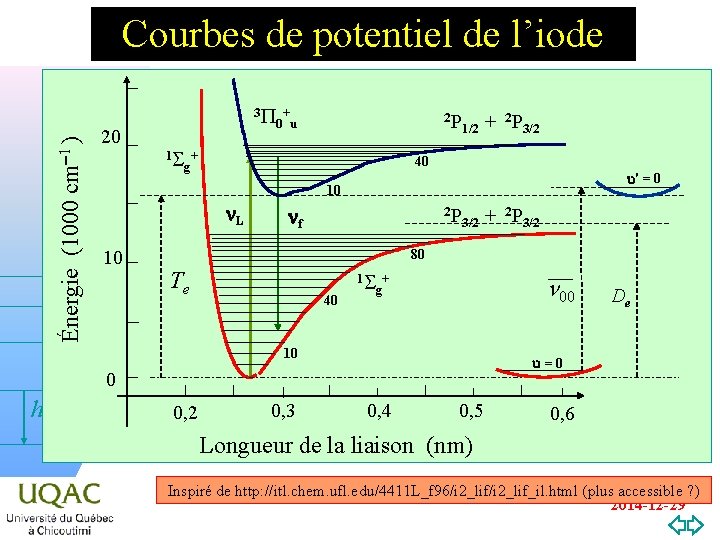
Énergie (1000 cm-1 ) Courbes de potentiel de l’iode 20 3 P + 0 u 2 P 1 S + g 1/2 40 u' = 0 10 n. L 10 nf 2 P 3/2 + 2 P 3/2 80 Te 40 1 S + g n 00 10 0, 2 0, 3 De u=0 0 hn + 2 P 3/2 0, 4 0, 5 0, 6 Longueur de la liaison (nm) v=0 Inspiré de http: //itl. chem. ufl. edu/4411 L_f 96/i 2_lif_il. html (plus accessible ? ) 2014 -12 -29

Diagramme des niveaux d'énergie et spectre observé n L'énergie de chaque niveau de vibration d’un état électronique excité est : Ceci devrait donner lieu à une série de bandes (et de raies) presque régulièrement espacées, de fréquence : n n = [n o + G(u)]2 - [0 + G(0)]1 = n o + u (we - we xe) - u 2 we xe hn • ou plus simplement : v=0 2014 -12 -29

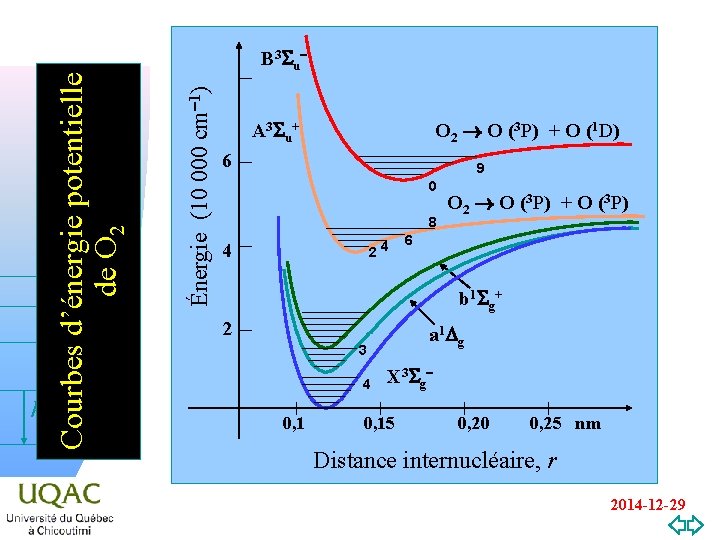
v=0 Énergie (10 000 cm-1) Courbes d’énergie potentielle de O 2 hn B 3 Su A 3 S u + O 2 O (3 P) + O (1 D) 6 9 0 8 24 4 O 2 O (3 P) + O (3 P) 6 b 1 S g + 2 a 1 Dg 3 4 0, 1 X 3 S g - 0, 15 0, 20 0, 25 nm Distance internucléaire, r 2014 -12 -29

Spectre électronique : analyse rotationnelle En ignorant l'énergie translationnelle : n E = Etot = Erot + Evibr + Eélec n Dans l'état électronique fondamental (Eélec = 0) : E = Bu. J(J+1) + we (u+1/2) - we xe (u+1/2)2 n Dans l'état électronique excité : E' = B'u. J ' (J '+1) + we'(u'+1/2) - we'xe' (u' +1/2)2 + Eélec n Les règles de sélection sont toujours les mêmes : hn. DJ = ± 1 et Du = 0, ± 1, ± 2, ± 3, etc. n Si Du = 0 , on a la bande 0 -0. n v=0 2014 -12 -29

Spectre électronique : analyse rotationnelle n n n hn v=0 n La suite de raies peut donc se mettre sous la forme d'un polynôme du 2 e degré : E = b + a m + c m 2 où b = Evibr + Eélec a = B + B' et c = B - B' Le problème se complique du seul fait que les valeurs de B et de B' sont en général très différentes. Afin d'indexer les raies convenablement, on peut utiliser la méthode de la deuxième différence. 2014 -12 -29

Spectre électronique : analyse vibrationnelle n Pour l'état électronique fondamental et pour l'état électronique excité, on a : = we (u + 1/2) - we xe (u + 1/2)2 u G'(u') = Eélec + we' (u' + 1/2) - we'xe' (u' + 1/2) 2 u G(u) n La différence d'énergie entre deux niveaux de vibration, u et u', appartenant à deux états électroniques différents peut se mettre sous la forme : hn v=0 2014 -12 -29

Spectre électronique : analyse vibrationnelle En émission, on doit s'attendre à autant de séries qu'il y a de niveaux de vibration à émettre (peuplés). n En ne retenant qu’un seul niveau excité, on a les hn transitions suivantes : v=0 Énergie n u' = 3 u' = 0 u = 0 Distance internucléaire, r 2014 -12 -29

Spectre électronique : analyse vibrationnelle n n En émission, on doit s'attendre à autant de séries qu'il y a de niveaux de vibration à émettre (peuplés). En ne retenant que les bandes qui partent du même niveau vibrationnel u' (u est la seule variable) : u Eorigine hn u Eterm v=0 = Eélec + we' (u'+1/2) - we'xe' (u'+1/2)2; = we (u+1/2) - we xe (u + 1/2)2. 2014 -12 -29

Transitions vibrationnelles en émission (à partir de u = u ) hn v=0 2014 -12 -29

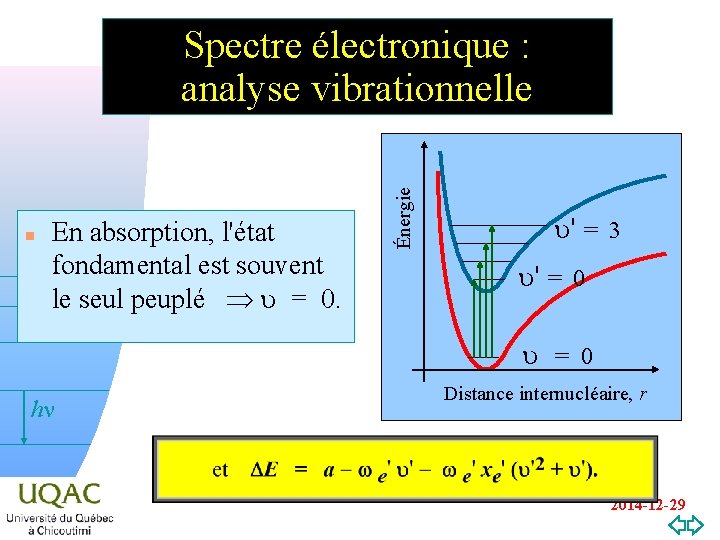
n En absorption, l'état fondamental est souvent le seul peuplé u = 0. Énergie Spectre électronique : analyse vibrationnelle u' = 3 u' = 0 u = 0 hn v=0 Distance internucléaire, r 2014 -12 -29

Transitions vibrationnelles en absorption (à partir de u = 0) hn v=0 2014 -12 -29

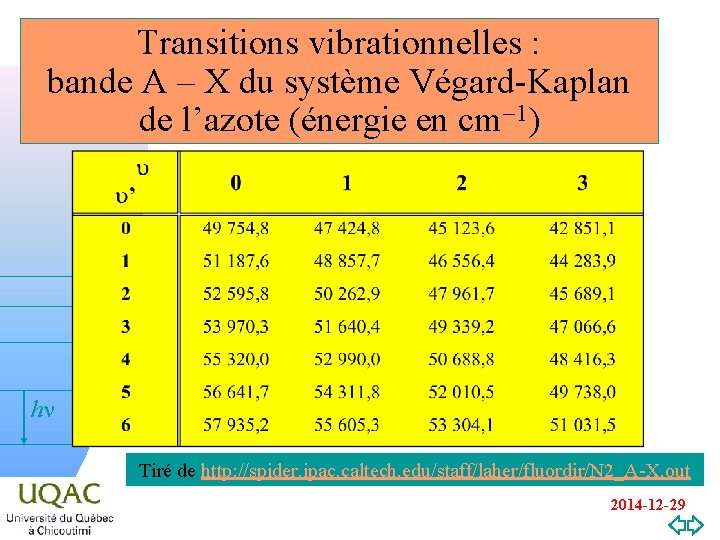
Transitions vibrationnelles : bande A – X du système Végard-Kaplan de l’azote (énergie en cm-1) hn v=0 Tiré de http: //spider. ipac. caltech. edu/staff/laher/fluordir/N 2_A-X. out 2014 -12 -29

En résumé. . . En émission, la deuxième différence permet de mesurer 2 we xe et donc we. n En absorption, on obtenait les valeurs we' xe' et we'. n On peut observer les niveaux de vibration jusqu'à une valeur élevée de u (u = 25 dans certains cas), donc obtenir une valeur précise de we, we xe et De pour chaque état électronique. n On peut observer les niveaux de rotation jusqu'à une valeur élevée de J , donc obtenir les moments d'inertie hn et la distance internucléaire moyenne avec une grande précision. n v=0 2014 -12 -29

Détermination des constantes moléculaires On peut faire ces déterminations pour chaque état électronique. n Un des succès de la théorie a été de relier l'énergie de dissociation de la molécule et l'énergie des fragments obtenus (voir Fig. 8. 3 ou la page 12 de ce hn diaporama). n v=0 2014 -12 -29

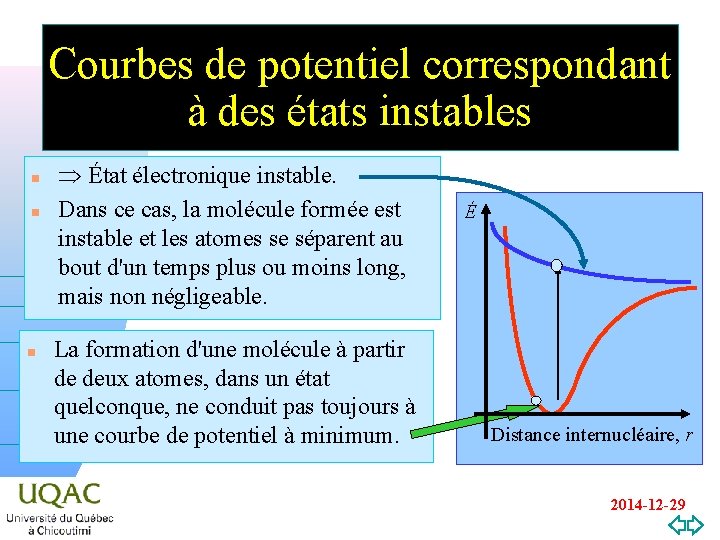
Courbes de potentiel correspondant à des états instables n n État électronique instable. Dans ce cas, la molécule formée est instable et les atomes se séparent au bout d'un temps plus ou moins long, mais non négligeable. La formation d'une molécule à partir de deux atomes, dans un état hnquelconque, ne conduit pas toujours à une courbe de potentiel à minimum. É n v=0 Distance internucléaire, r 2014 -12 -29

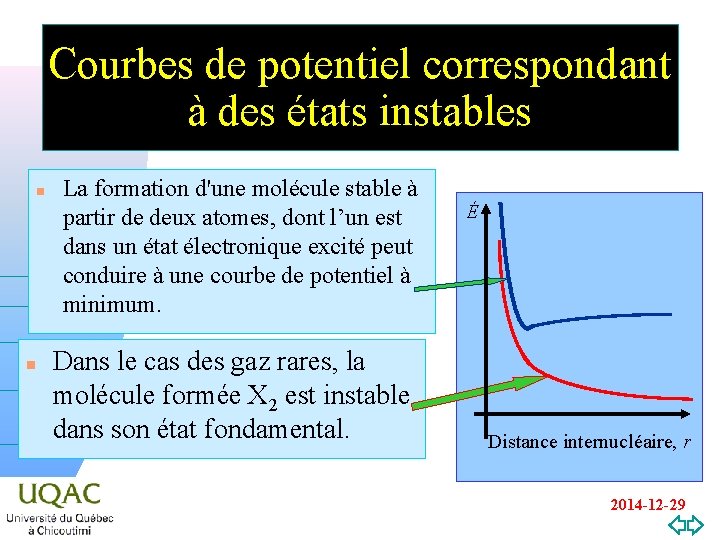
Courbes de potentiel correspondant à des états instables n La formation d'une molécule stable à partir de deux atomes, dont l’un est dans un état électronique excité peut conduire à une courbe de potentiel à minimum. Dans le cas des gaz rares, la molécule formée X 2 est instable hn dans son état fondamental. É n v=0 Distance internucléaire, r 2014 -12 -29

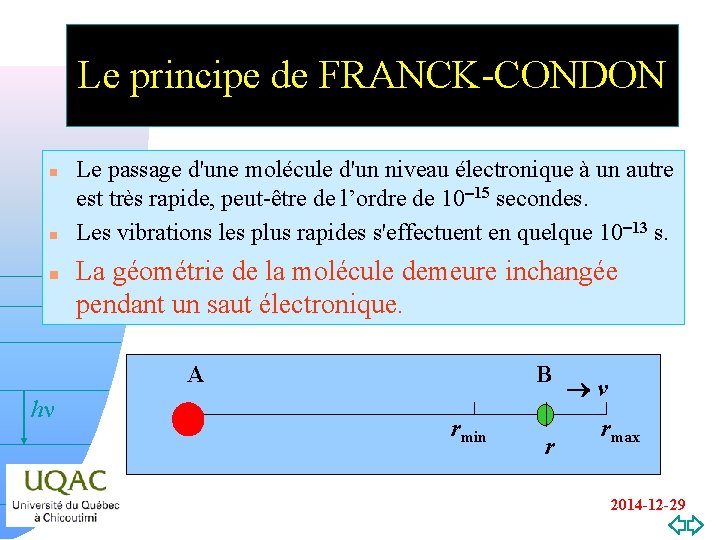
Le principe de FRANCK-CONDON n n n Le passage d'une molécule d'un niveau électronique à un autre est très rapide, peut-être de l’ordre de 10 -15 secondes. Les vibrations les plus rapides s'effectuent en quelque 10 -13 s. La géométrie de la molécule demeure inchangée pendant un saut électronique. A hn v=0 B rmin r v rmax 2014 -12 -29

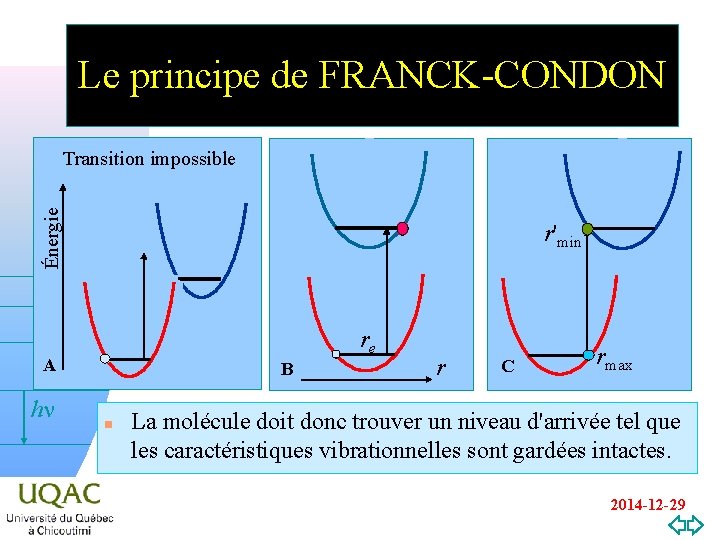
Le principe de FRANCK-CONDON Énergie Transition impossible r'min re A hn v=0 B n r C rmax La molécule doit donc trouver un niveau d'arrivée tel que les caractéristiques vibrationnelles sont gardées intactes. 2014 -12 -29

Le principe de FRANCK-CONDON Pour qu’un saut électronique se produise, les fonctions d’onde associées aux deux états doivent se chevaucher. n On interprète cette condition en termes classiques en disant que la distance internucléaire ne doit pas changer lors d’un saut électronique. hnn C'est le principe de FRANCK-CONDON. n v=0 2014 -12 -29

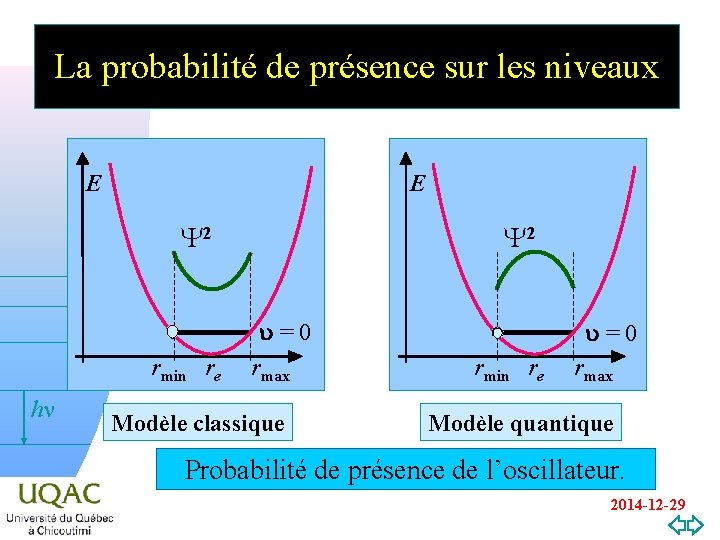
La probabilité de présence sur les niveaux E E Y 2 rmin re hn v=0 Y 2 u = 0 rmax Modèle classique u = 0 rmin re rmax Modèle quantique Probabilité de présence de l’oscillateur. 2014 -12 -29

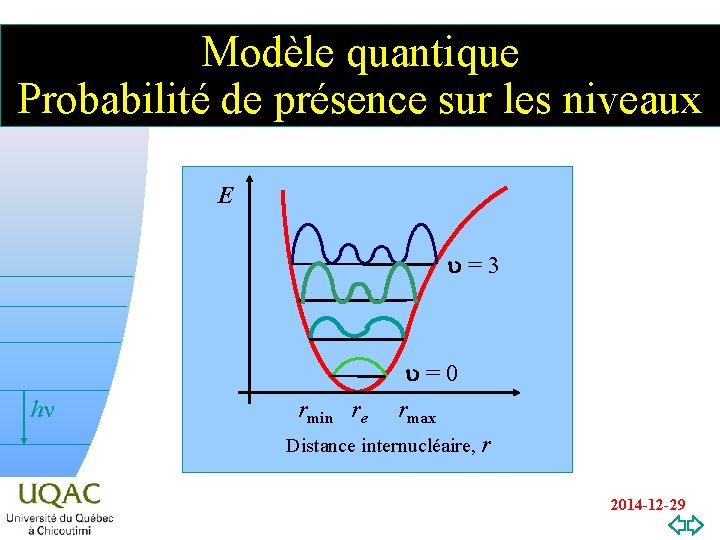
Modèle quantique Probabilité de présence sur les niveaux E u = 3 hn rmin re u = 0 rmax Distance internucléaire, r v=0 2014 -12 -29

L’intensité de la transition n n hn v=0 La probabilité de trouver la particule sur un élément dr varie considérablement avec l'abscisse r. La probabilité de transition sera donc très affectée par la position de la particule entre rmin et rmax. Ce paramètre intervient dans l'intensité de la transition (donc de la bande) observée. 2014 -12 -29

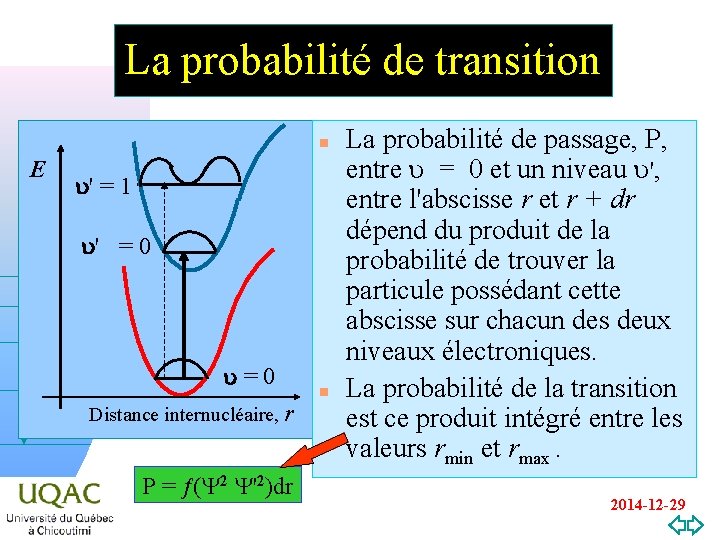
La probabilité de transition n E u' = 1 u' = 0 u = 0 hn Distance internucléaire, r v=0 P = (Y 2 Y'2)dr n La probabilité de passage, P, entre u = 0 et un niveau u', entre l'abscisse r et r + dr dépend du produit de la probabilité de trouver la particule possédant cette abscisse sur chacun des deux niveaux électroniques. La probabilité de la transition est ce produit intégré entre les valeurs rmin et rmax. 2014 -12 -29

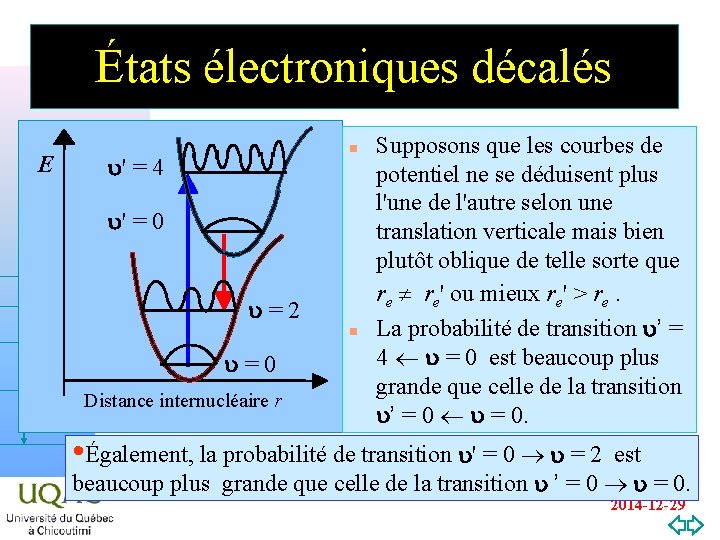
États électroniques décalés E n u' = 4 u' = 0 u = 2 n u = 0 hn Distance internucléaire r Supposons que les courbes de potentiel ne se déduisent plus l'une de l'autre selon une translation verticale mais bien plutôt oblique de telle sorte que re re' ou mieux re' > re. La probabilité de transition u’ = 4 u = 0 est beaucoup plus grande que celle de la transition u’ = 0 u = 0. • Également, la probabilité de transition u' = 0 u = 2 est v = 0 beaucoup plus grande que celle de la transition u ’ = 0 u = 0. 2014 -12 -29

Absorption - émission E u' = 0 hn v=0 états électroniques avec espacement similaire. u = 0 2014 -12 -29

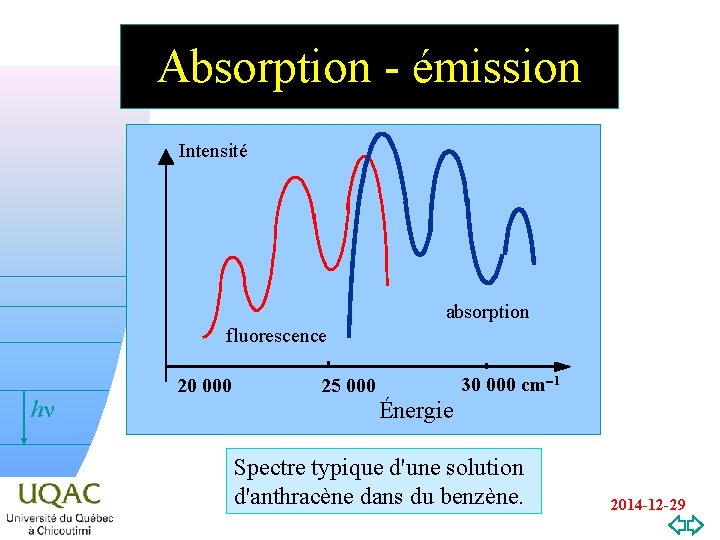
Absorption - émission Intensité absorption fluorescence hn v=0 20 000 30 000 cm-1 25 000 Énergie Spectre typique d'une solution d'anthracène dans du benzène. 2014 -12 -29

Effet isotopique n n Les énergies des couches électroniques ne dépendent pas de la masse du noyau mais seulement de sa charge. Les niveaux d'énergie électronique ne sont donc pas affectés par la substitution isotopique. hn v=0 2014 -12 -29

Conclusion n hn v=0 n Les transitions électroniques exigent une quantité d’énergie de beaucoup supérieure à celle requise pour exciter les mouvements internes d’une molécule. Ces transitions sont également soumises à leurs propres lois. Les transitions en rotation et en vibration sont donc simultanément excitées. Les règles de sélection et les lois sont conservées Ces possibilités existent tant en absorption qu’en émission (fluorescence). 2014 -12 -29
 Molcules
Molcules Fiche de lecture ficelle
Fiche de lecture ficelle Le petit prince chapitre 24 analyse
Le petit prince chapitre 24 analyse Petit pays chapitre 1
Petit pays chapitre 1 Résumé chapitre par chapitre tirez pas sur le scarabée
Résumé chapitre par chapitre tirez pas sur le scarabée Petit prince résumé
Petit prince résumé Chapitre 2 richesse et pauvreté dans le monde
Chapitre 2 richesse et pauvreté dans le monde Quand je suis frais je suis chaud
Quand je suis frais je suis chaud Le dernier jour d'un condamné situation de passage
Le dernier jour d'un condamné situation de passage Macro cible
Macro cible Les professeurs 1 of 1 dans la salle de classe.
Les professeurs 1 of 1 dans la salle de classe. Zone chaude froide magasin
Zone chaude froide magasin Texte dopinion
Texte dopinion Le dernier jour d'un condamné chapitre 49
Le dernier jour d'un condamné chapitre 49 Enfers
Enfers Quel beau nom que celui d'emmanuel
Quel beau nom que celui d'emmanuel Page de remerciement rapport de stage
Page de remerciement rapport de stage Situation initiale de conte
Situation initiale de conte Guide de la femme au foyer
Guide de la femme au foyer Slogan haribo
Slogan haribo échange des substances dissoutes
échange des substances dissoutes Les instructions dans la classe
Les instructions dans la classe Nous sommes des etoiles dans le ciel d'abraham
Nous sommes des etoiles dans le ciel d'abraham Groupe verbal
Groupe verbal Horloge de bowman
Horloge de bowman Manger est un mot variable ou invariable?
Manger est un mot variable ou invariable? Remplacer les mots soulignes par les pronoms convenables
Remplacer les mots soulignes par les pronoms convenables Les voitures les plus rapides du monde
Les voitures les plus rapides du monde Haribo c'est beau la vie pour les grand et les petit
Haribo c'est beau la vie pour les grand et les petit Preactionneurs
Preactionneurs Les lettres et les sons
Les lettres et les sons J'aime les bouches sans venin les cœurs sans stratagème
J'aime les bouches sans venin les cœurs sans stratagème Trouvez les réponses. écrivez-les en chiffres (numbers).
Trouvez les réponses. écrivez-les en chiffres (numbers). Les parts de les plantes
Les parts de les plantes Les arguments pour tous les sujets
Les arguments pour tous les sujets Les trois obstacles et les quatre démons
Les trois obstacles et les quatre démons Les 10 volcans les plus dangereux du monde
Les 10 volcans les plus dangereux du monde Les mots qu'on ne dit pas sont les fleurs du silence
Les mots qu'on ne dit pas sont les fleurs du silence Les histoires d'amour c'est comme les voyages en train
Les histoires d'amour c'est comme les voyages en train Fonctions techniques
Fonctions techniques