Les protenes Les protenes sn les molcules estructurals












- Slides: 14

Les proteïnes � Les proteïnes són les molècules estructurals dels éssers vius, encara que també realitzen altres funcions, com ara: ◦ ◦ ◦ � Inmunològica, com els anticossos que ens protegeixen dels organismes paràsits. Enzimàtica. Contràctil, com l’actina i miosina que són les proteïnes que contrauen els músculs del cos. Homeostàtica, perquè col·laboren en el manteniment del p. H, donat que formen solucions tampó. Transducció de senyals, com la rodopsina, que es troba a les cèl·lules de la retina dels vertebrats i que reacciona amb la llum, iniciant una cadena de reaccions que acaba generant un en impuls nerviós Protectora o defensiva, com la trombina i el fibrinògen que són les proteïnes responsables de la coagulació de la sang. Els maons fonamentals de les proteïnes, són els aminoàcids, aquests formen llargues cadenes polimèriques, que són els pèptids, i finalment els pèptids s’associen entre

Tipus de proteïnes. � Les proteïnes es solen dividir en dos tipus diferenciats: ◦ ◦ � � � Les proteïnes fibroses. Les proteïnes globulars. Les proteïnes fibroses formen llargs filaments cilíndrics de proteïnes, amb una resistència mecànica mot gran. Les proteïnes fibroses estan formades per aminoàcids amb cadenes laterals hidrofòbiques per la qual cosa són insolubles, i químicament inerts. Poden tenir funcions d’emmagatzematge, però la seva funció típica és com a suport estructural, formant el teixit connectiu, la fibra muscular i tendons dels animals i la matriu orgànica dels ossos dels vertebrats. Per això també se les anomena escleroproteïnes, exemples d’aquestes són la queratina, el col·lagen, l’elastina i la fibrina. Les proteïnes globulars, en canvi es pleguen en forma esfèrica, i solubles en aigua, formant col·loides. Degut a la seva solubilitat també es degraden més fàcilment que les proteïnes fibroses. Les proteïnes globulars tenen un ventall de funciones més ampli, actuant com a enzims, catalitzant les reaccions del metabolisme; missatgers, actuant com a hormones; transportadores, formant els porus de la membrana cel·lular, a traves dels quals Exemples de proteïnes fibroses, dreta i globulars a dalt. A dalt veiem una molècula d’hemoglobina, una proteïna globular, i a la dreta una proteïna fibrosa, el tropocolàgen, que forma estructures formant una hèlix triple, amb tres fibres peptídiques.

Estructura de les proteïnes. � � Les proteïnes tenen fins a quatre nivells d’organització ◦ El primer nivell d’organització és l’estructura primària, que consisteix senzillament a la seqüència d’aminoàcids. ◦ El segon nivell d’organització és l’estructura secundària que consisteix en la conformació que adopta cada segment concret del pèptid. ◦ El tercer nivell d’organització és l’estructura terciària que consisteix en el plegament que adopta cada pèptid en funció de les conformacions que adopten els diferents segments. ◦ El quart nivell d’organització és l’estructura quaternària, que consisteix, finalment, en la forma en que s'enllacen mitjançant ponts d’hidrogen, els diferents pèptids que componen la proteïna. Les proteïnes per tant són molt sensibles a la seva estructura, així ens trobem que: ◦ La insulina de l’home és específica de la nostra espècie i diferent a la del porc, perquè té una seqüència d’aminoàcids diferent. ◦ La clara de l’ou solidifica a l’escalfar-se perquè es desnaturalitza i canvia la seva estructura. ◦ Els prions són proteïnes infeccioses, que canvien la seva conformació, deixen de realitzar les seves funcions i indueixen canvies estructurals a altres proteïnes, propagant així la malaltia Són les causants de la malaltia de Creutzfeldt-Jakob en humans, l’Encefalopatia Espongiforme Bovina al ramat boví, i l’Scrapie o Tremolor al ramat caprí i oví.

Desnaturalització de proteïnes. � � � � L’activitat biològica de les proteïnes és molt sensible a la seva conformació. De fet només són capaces de realitzar les seves funcions si tenen una conformació mol definida. Així la seda natural només té les seves propietats mecàniques si té una conformació en làmines β, i un plegament apropiat, que només adopta quan passa per les glàndules secretores de l’animal. Per tant no val només sintetitzar un polímer amb la mateixa seqüència d'aminoàcids que trobem a la natura, GLY-SER-GLY-ALA-GLY, hauríem de ser capaços de reproduïm la conformació i el plegament que adopta la fibroïna en sortir de l’insecte. Per efecte de la temperatura o agents químics, com el p. H, agents oxidants o reductors, o agents infecciosos, les proteïnes poden desnaturalitzar-se, és a dir canvien la seva conformació i per tant esdevenen incapaces de realitzar la seva funció. La major part dels canvis que observem en un aliment quan es cuina és degut a la desnaturalització de les proteïnes que conté, per això canvien les seves propietats físiques i químiques. La desnaturalització de les proteïnes és un efecte irreversible, una vegada ha perdut la seva conformació ja no la pot recuperar, per tant si aquesta desnaturalització es produeix dintre d’un ésser viu, pot desencadenar malalties i fins i tot provocar la mort de l’individu. Larva de Bombix Mori, cuc de seda, elaborant el seu capell, per realitzar la metamorfòsi. Del fil que forma el capell es d’on s’elabora la seda. L’albúmina és una proteïna que té textura de gel. Quan s’escalfa, per exemple per fer un ou ferrat, es desnaturalitza i es torna sòlida.

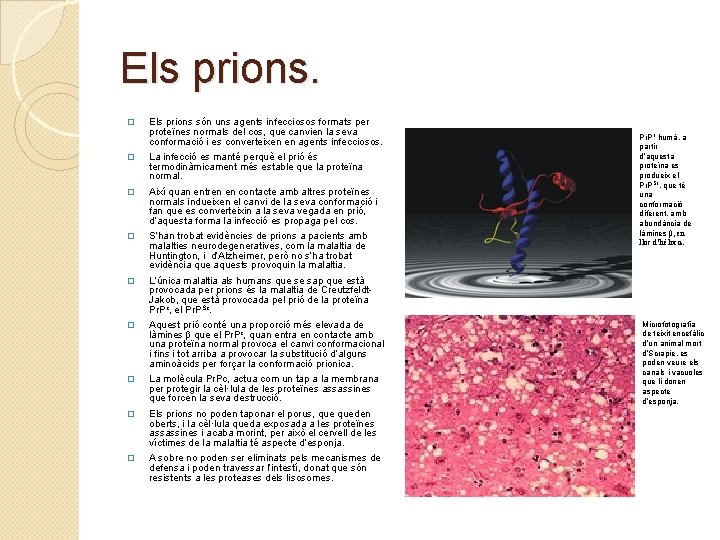
Els prions. � Els prions són uns agents infecciosos formats per proteïnes normals del cos, que canvien la seva conformació i es converteixen en agents infecciosos. � La infecció es manté perquè el prió és termodinàmicament més estable que la proteïna normal. � Així quan entren en contacte amb altres proteïnes normals indueixen el canvi de la seva conformació i fan que es converteixin a la seva vegada en prió, d’aquesta forma la infecció es propaga pel cos. � S’han trobat evidències de prions a pacients amb malalties neurodegeneratives, com la malaltia de Huntington, i d’Alzheimer, però no s’ha trobat evidència que aquests provoquin la malaltia. � L’única malaltia als humans que se sap que està provocada per prions és la malaltia de Creutzfeldt. Jakob, que està provocada pel prió de la proteïna Pr. Pc, el Pr. PSc. � Aquest prió conté una proporció més elevada de làmines β que el Pr. Pc, quan entra en contacte amb una proteïna normal provoca el canvi conformacional i fins i tot arriba a provocar la substitució d’alguns aminoàcids per forçar la conformació prionica. � La molècula Pr. Pc, actua com un tap a la membrana per protegir la cèl·lula de les proteïnes assassines que forcen la seva destrucció. � Els prions no poden taponar el porus, queden oberts, i la cèl·lula queda exposada a les proteïnes assassines i acaba morint, per això el cervell de les víctimes de la malaltia té aspecte d’esponja. � A sobre no poden ser eliminats pels mecanismes de defensa i poden travessar l’intestí, donat que són resistents a les proteases dels lisosomes. Pr. Pc humà, a partir d’aquesta proteïna es produeix el Pr. PSc, que té una conformació diferent, amb abundància de làmines β, en lloc d’hèlix α. Microfotografia de teixit encefàlic d’un animal mort d’Scrapie, es poden veure els canals i vacuoles que li donen aspecte d’esponja.

Els enzims. � Les proteïnes no són només les substàncies estructurals del cos dels éssers vius, sinó que també realitzen important funcions. � Per exemple, moltes d’elles són hormones, com la insulina o la timopoietina. � Els enzims són substàncies de tipus proteic que actuen com a catalitzadors de les reaccions que tenen lloc en el nostre cos. � Sovint les reaccions que tenen lloc en el nostre cos requereixen condicions extremes de temperatura i p. H. � A sobre si es realitzen en aquestes condicions resulten enormement inespecífiques. � La funció dels enzims és facilitar que les reaccions es realitzin en condicions suaus de temperatura i p. H. � Com a contrapartida, en aquestes condicions tan suaus, les reaccions es tornen molt específiques, de tal manera que cada enzim està especialitzat en un tipus d’enllaç químic. ◦ Per exemple, els animals no podem digerir la cel·lulosa perquè les unitats de glucosa estan unides mitjançant un enllaç β-1 -4 glicosídic, i no tenim l’enzim necessari per hidrolitzar aquest enllaç, la β-1 -4 glicosidasa, per això necessitem el concurs de bacteris simbiòtics que si en tenen. ◦ El contrari passa amb l’amilosa i l’amilopectina com que estan units mitjançant enllaços α-1 -4 glicosídics, 1 -6 glicosídics a les ramificacions de l’amilopectina, i contem amb els enzims necessaris, l’ α-1 -4 glicosidasa i la 1 -6 glicosidasa, podem digerir el midó. Esquema típic d’una catàlisi enzimàtica. L’enzim, com tots els catalitzadors, no intervé sobre l’energia que allibera la reacció, que continua sent la mateixa, sinó sobre l’energia d’activació. Com que redueix l’energia d’activació la reacció es pot realitzar en condicions suaus. Lloc actiu Estructura de la triosafosfat isomerasa. Conformació en forma de diagrama de cintes rodejat pel model d’emplenament d’espai de la proteïna. Aquesta proteïna es una eficient enzima involucrada en el procés de transformació de sucres en energia a les cèl·lules.

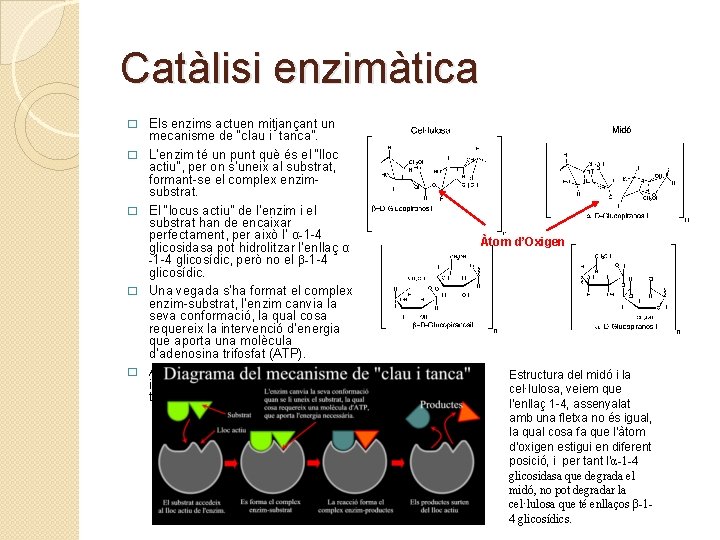
Catàlisi enzimàtica � � � Els enzims actuen mitjançant un mecanisme de “clau i tanca”. L’enzim té un punt què és el “lloc actiu”, per on s’uneix al substrat, formant-se el complex enzimsubstrat. El “locus actiu” de l’enzim i el substrat han de encaixar perfectament, per això l’ α-1 -4 glicosidasa pot hidrolitzar l’enllaç α -1 -4 glicosídic, però no el β-1 -4 glicosídic. Una vegada s’ha format el complex enzim-substrat, l’enzim canvia la seva conformació, la qual cosa requereix la intervenció d’energia que aporta una molècula d’adenosina trifosfat (ATP). Aquest canvi de conformació indueix una tensió a l’enllaç, que el trenca. Àtom d’Oxigen Estructura del midó i la cel·lulosa, veiem que l’enllaç 1 -4, assenyalat amb una fletxa no és igual, la qual cosa fa que l’àtom d’oxigen estigui en diferent posició, i per tant l’α-1 -4 glicosidasa que degrada el midó, no pot degradar la cel·lulosa que té enllaços β-14 glicosídics.

Catàlisi enzimàtica. Mecanisme de Michaelis-Menten (1). Un exemple de catàlisi enzimàtica és el mecanisme de Michaelis-Menten. � Aquest mecanisme el van descobrir Leonor Michaelis i Maud Menten al 1913. � Els enzims actuen mitjançant un complex activat, que és el complex enzim-substrat. � La reacció, per tant succeeix en dues etapes: � ◦ ◦ A la primera etapa s’uneixen l’enzim i el substrat. A la segona etapa es produeix la reacció. Leonor Michaelis 1875 -1949 � Si l’enzim segueix un mecanisme de Michaelis-Menten, la primera etapa és ràpida i per tant arriba a l’equilibri, mentre que la segona és lenta i és per tant l’etapa limitant de la reacció. Maud Menten 1879 -1960

Catàlisi enzimàtica. Mecanisme de Michaelis-Menten (2). Si considerem el següent mecanisme de reacció: � Tenim que la primera reacció es troba en equilibri, mentre que la segona és l’etapa limitant de la reacció, per tant: � � Com que l’enzim no es consumeix a la reacció tenim que la seva concentració es manté constant, per tant la seva variació al llarg de la reacció és 0, així la concentració de l’enzim arriba a un estat d’equilibri amb la següent constant: � Si considerem el balanç de matèria per l’enzim, podem veure que la concentració inicial de l’enzim és:

Catàlisi enzimàtica. Mecanisme de Michaelis-Menten (3). � Si ara unim les dues expressions obtenim: � Substituïm aquesta expressió a l’expressió de la velocitat de reacció, i s’obté: � En el cas límit que hi ha tant de substrat que no queda enzim lliure tenim que tot l’enzim es troba en forma de complex enzim substrat i per tant:

Catàlisi enzimàtica. Mecanisme de Michaelis-Menten (4). � Com a conseqüència ens quedarà la següent equació de velocitat: Aquest mecanisme indica que la velocitat arriba a un màxim on l’enzim queda saturat pel substrat i s’arriba a una velocitat constant de producció de l’enzim. � Això passa quan: � � Que depèn de la constant d’equilibri de cada enzim.

Coenzims i cofactors. � Alguns enzims necessiten l’assistència d’altres substàncies orgàniques o inorgàniques per a realitzar la seva funció. � La diferència entre els coenzims i els cofactors és que mentre que els coenzims no es veuen alterats químicament durant la reacció, els cofactors sí que ho fan. � Els cofactors aporten l’energia necessària per a realitzar la reacció, o bé portar o emportar-se els protons necessaris per a realitzar una reacció de rèdox, així són cofactors: ◦ El Nicotinamin Adenosin Dinucleòtid (NAD) que pot oscil·lar entre dos estat, l’estat reduït, NADH i l’estat oxidat NAD, per tant en una reacció d’oxidació entrarà NAD i sortirà NADH, i en canvi en una reacció de reducció entrarà NADH i sortirà NAD. � ◦ Una funció semblant té el Nicotinamin Adenosin Dinucleòtid fosforilat (NADP) que també pot oscil·lar entre un estat reduït (NADPH) i un altre oxidat (NADP). ◦ L’Adenosina trifosfat (ATP) és la molècula d’intercanvi energètic del sistemes biològics, per tant les reaccions que requereixen energia, consumiran ATP’s, i en canvi les reaccions que produeixen energia produiran ATP’s. Els coenzims en canvi no aporten res a la reacció, però actuen com a activadors o inhibidors dels enzims, sense el seu concurs l’enzim no pot funcionar. � El que fan els coenzims és canviar la conformació de l’enzim, això és el que es diu una transició alostèrica. � Hi ha transicions alostèriques que fan que el lloc actiu encaixi amb el substrat, i per tant activen l’enzim i d’altres fan la funció contrària i per tant inhibeixen l’enzim. Transició alostèrica d’un enzim entre els estats R i T, estabilitzada per un agonista, un inhibidor i un substrat. L’inhibidor força la conformació innactiva, mentre que la presència de l’agonista activa l’enzim i fa que pugui actuar sobre el substrat. Diagrama de cintes que representa l’estructura d’una anhidrasa carbònica de tipus II. L’esfera gris representa al cofactor zinc situat en el centre actiu

Regulació enzimàtica. � Quan els enzims no s’han de fer servir, s’han d’inactivar perquè s’aturin les reaccions que catalitzen i no causin dany al cos. � Per exemple durant un fort exercici físic s’ha d’activar el metabolisme de la glucosa i per tant s’ha d’activar l’α-1 -4 -glucosidasa, que descomposa el glicògen, mentre que després d’un àpat s’ha de fer l’operació inversa, per tant s’ha d’inactivar l’α-1 -4 -glucosidasa. � Els coenzims i cofactors ja regulen grollerament el enzims, però els inhibidors són capaços de fer una regulació més selectiva. � Hi ha quatre tipus d’inhibició: ◦ Inhibició competitiva: L’inhibidor i el substrat no es poden unir alhora, per tant l’inhibidor i el substrat competeixen pel lloc actiu, guanya el qui estigui en major concentració. ◦ Inhibició acompetitiva: L’inhibidor només pot unirse al complex enzim-substrat, una vegada es forma el complex enzim-substrat-inhibidor l’enzim queda inactivat. ◦ Inhibició no competitiva: L’inhibidor pot unir-se tant al complex enzim-substrat com a l’enzim i queda inactivat. Com l’inhibidor pot unir-se en qualsevol moment a l’enzim, aquesta només depén de la concentració d’inhibidor, per tant varia la Vmax de l’enzim, és a dir, no atura l’enzim però sí que regula la seva velocitat màxima de reacció. ◦ Inhibició mixta: L’inhibidor i el substrat es poden unir alhora, com a la inhibició no competitiva, però la unió de l’inhibidor afecta a la unió del substrat i vic eversa. En aquests casos el què succeeix és que l’inhibidor produeix una transició alostèrica a l’enzim, fixant-se en un punt d’unió diferent del lloc actiu del substrat. Com a conseqüència l’enzim no queda inhibit, però varia la seva velocitat màxima de reacció.

Heteroproteïnes. Les heteroproteïnes o proteïnes conjugades són un conjunt de proteïnes globulars que es caracteritzen per contenir una part no formada per aminoàcids. � Normalment es classifiquen en funció del seu grup prostètic, molts dels quals també poden actuar com a cofactors. � Els grups prostètics són molècules orgàniques de petita grandària que són necessaris per que la proteïna pugui realitzar les seves funcions. � Així trobem: � ◦ ◦ ◦ Fosfoproteïnes: Són proteïnes que contenen àcid fosfòric, i normalment presenten activitat com a àcid. Normalment són enzims com la caseina α, β i γ. Glucoproteïnes: Consisteixen en un glúcid unit a una proteïna i realitzen moltes funcions, com a enzims, hormones, factors de coagulació o immunitàries, com les immunoglobulines. Lipoproteïnes: És el resultat de la unió d’un lípid i una proteïna, abunden a les membranes mitocondrials i al sèrum, com els quilomicrons de l’intestí. Nucleoproteïnes: Són proteïnes unides a àcids nucleics, com les histones que formen la cromatina. Cromoproteïnes: Es caracteritzen per tenir una part no proteica que absorbeix llum a l’espectre ultraviolat-visible, per això presenten color. La més coneguda és l’hemoglobina, però també la trobem a proteïnes que actuen com a magatzem d’oxigen, com la mioglobina, enzims respiratoris, com els citocroms i les flavoproteïnes i pigments de la retina, com la rodopsina i la iodopsina. Esquema d’un quilomicró, una lipoproteïna, de baixa densitat (LDL). Les proteïnes Apo. E i Apo. CII que provenen de les HDL es representen en color groc i vermell, respectivament. Esquema de l’hemoglobina, està formada per quatre unitats peptídiques cadascuna portant un grup hemo