Chapitre 4 Atomes molcules et transformations chimiques Pour


































- Slides: 69

Chapitre 4: Atomes, molécules et transformations chimiques Pour comprendre une réaction chimique, nous allons nous placer à l’échelle microscopique.

1/ Les atomes et les molécules • Molécule: Une molécule est constituée de plusieurs atomes. • Atome: Un atome est une petite brique de matière, INCASSABLE, représentée par une petite boule.

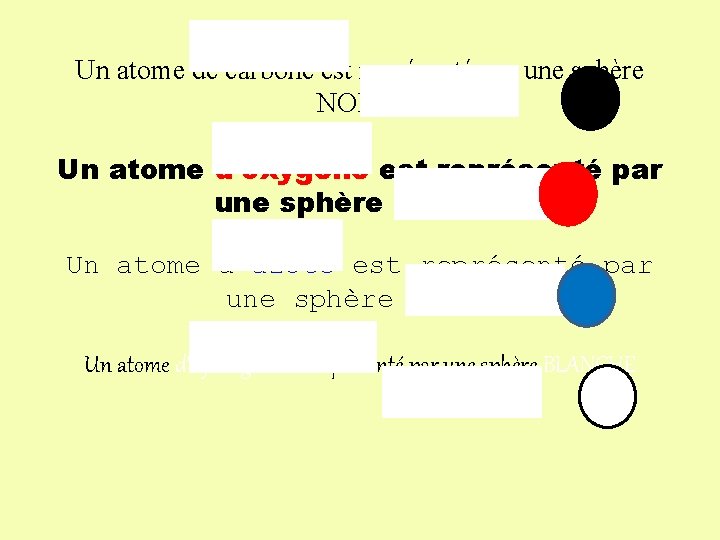
Un atome de carbone est représenté par une sphère NOIRE Un atome d’oxygène est représenté par une sphère ROUGE Un atome d’azote est représenté par une sphère BLEUE Un atome d’hydrogène est représenté par une sphère BLANCHE

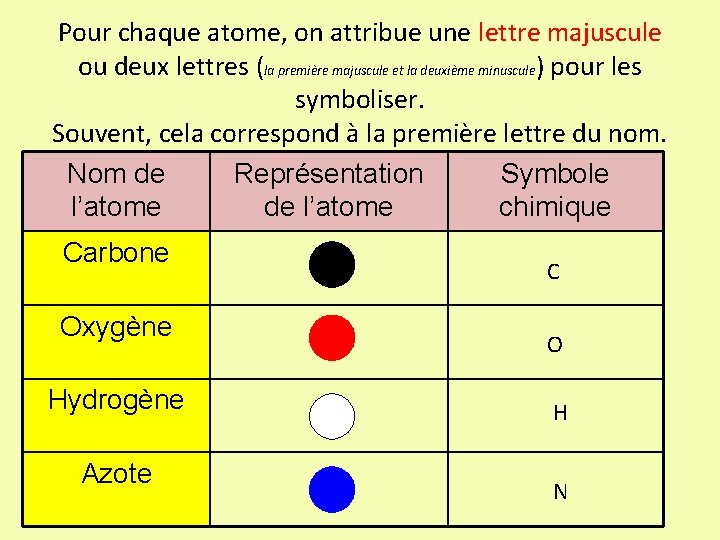
Pour chaque atome, on attribue une lettre majuscule ou deux lettres (la première majuscule et la deuxième minuscule) pour les symboliser. Souvent, cela correspond à la première lettre du nom. Nom de Représentation Symbole l’atome de l’atome chimique Carbone Oxygène Hydrogène Azote C O H N

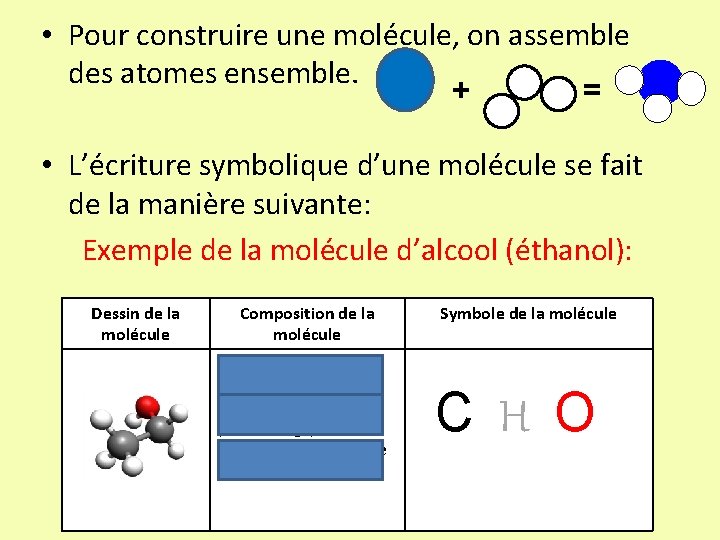
• Pour construire une molécule, on assemble des atomes ensemble. + = • L’écriture symbolique d’une molécule se fait de la manière suivante: Exemple de la molécule d’alcool (éthanol): Dessin de la molécule Composition de la molécule • 2 atomes de carbone (boules noires) • 1 atome d’oxygène (boule rouge) • 6 atomes d’hydrogène (boule blanche) Symbole de la molécule C H O

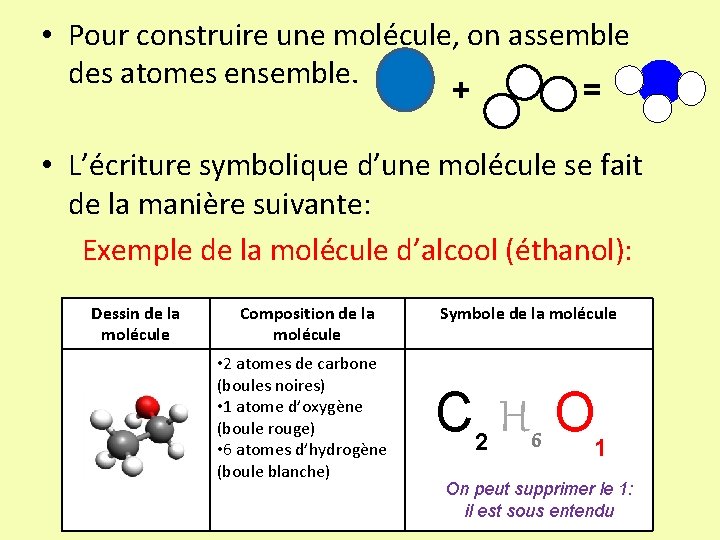
• Pour construire une molécule, on assemble des atomes ensemble. + = • L’écriture symbolique d’une molécule se fait de la manière suivante: Exemple de la molécule d’alcool (éthanol): Dessin de la molécule Composition de la molécule • 2 atomes de carbone (boules noires) • 1 atome d’oxygène (boule rouge) • 6 atomes d’hydrogène (boule blanche) Symbole de la molécule C 2 H 6 O 1 On peut supprimer le 1: il est sous entendu

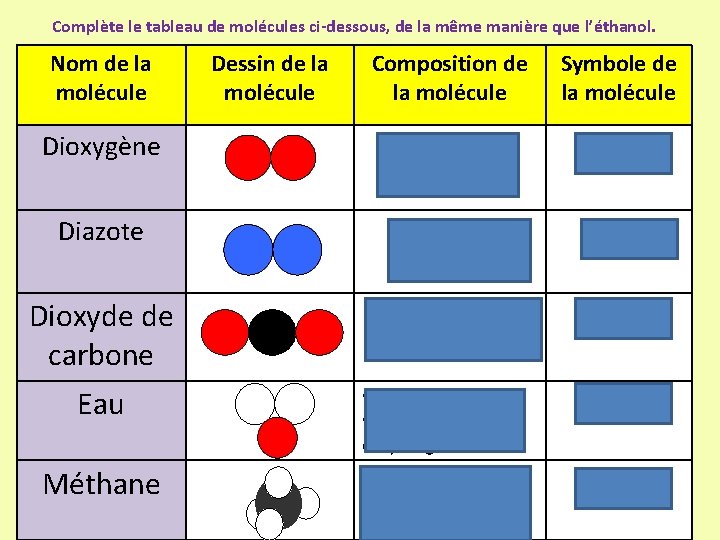
Complète le tableau de molécules ci-dessous, de la même manière que l’éthanol. Nom de la molécule Dessin de la molécule Composition de la molécule Symbole de la molécule Dioxygène 2 atomes d’oxygène O 2 Diazote 2 atomes d’azote N 2 Dioxyde de carbone • 1 atome de carbone • 2 atomes d’oxygène CO 2 Eau • 1 atome d’oxygène • 2 atomes d’hydrogène H 2 O Méthane • 1 atome de carbone • 4 atomes d’hydrogène CH 4

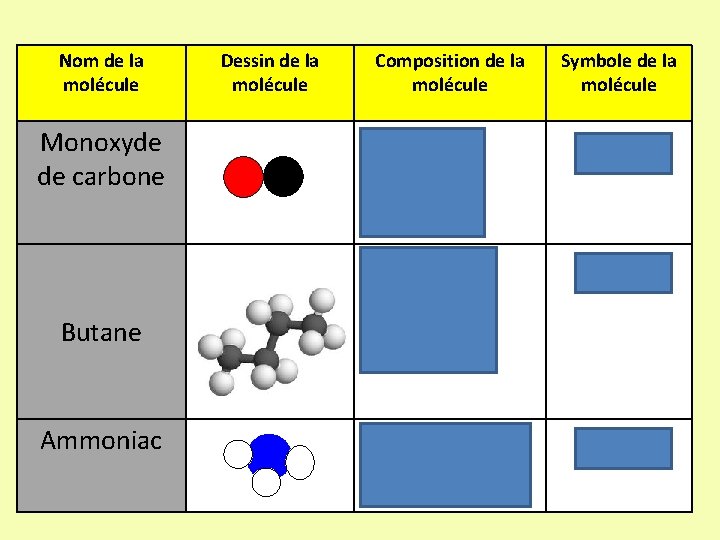
Nom de la molécule Monoxyde de carbone Butane Ammoniac Dessin de la molécule Composition de la molécule • 1 atome d’oxygène • 1 atome de carbone • 4 atomes de carbone • 10 atomes d’oxygène • 1 atome d’azote • 3 atomes d’hydrogène Symbole de la molécule CO C 4 H 10 NH 3

Pour savoir si tu as bien compris, fais l’exercice cidessous

Vérifie si tu as vraiment tout bien compris encore une fois

Réalise ces exercices intéractifs

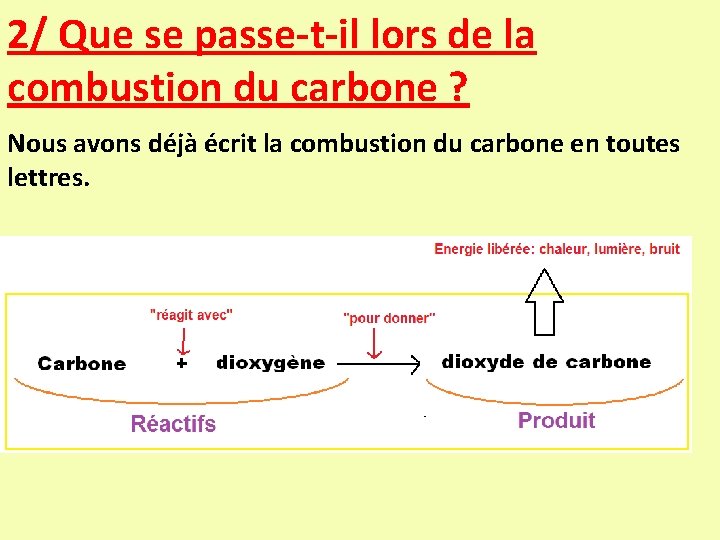
2/ Que se passe-t-il lors de la combustion du carbone ? Nous avons déjà écrit la combustion du carbone en toutes lettres.

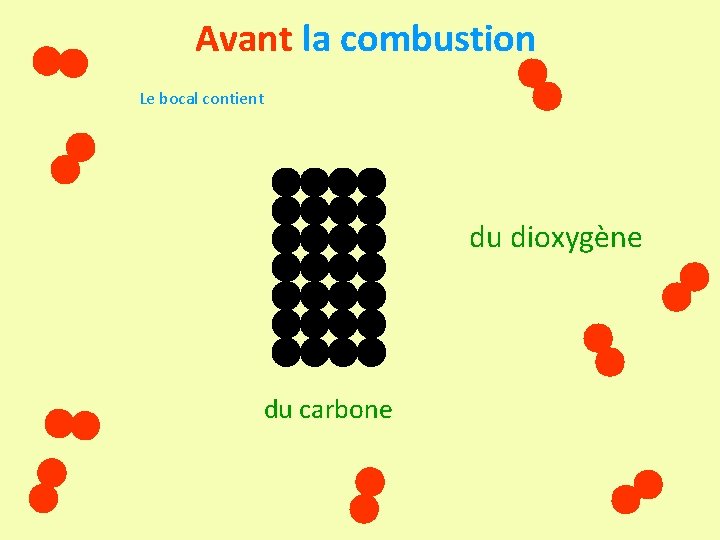
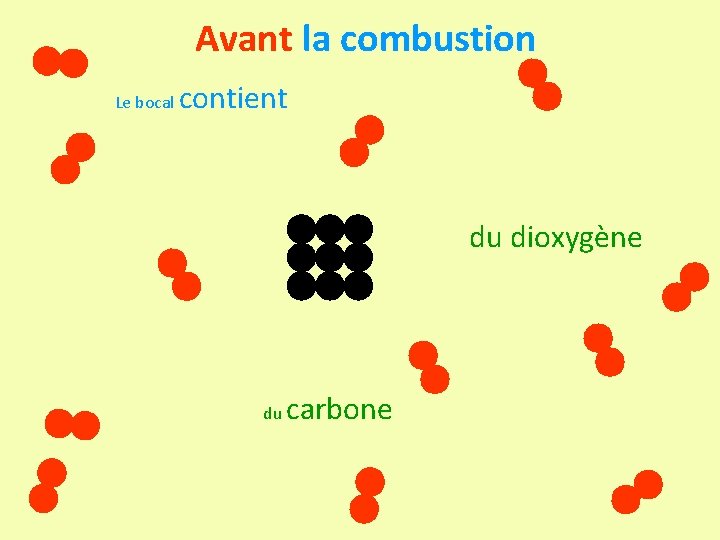
Avant la combustion Le bocal contient du dioxygène du carbone

Démarrage de la combustion source de chaleur

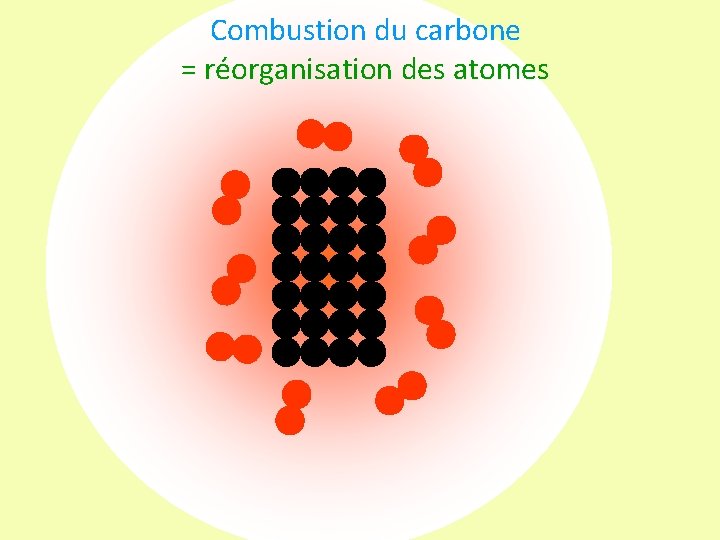
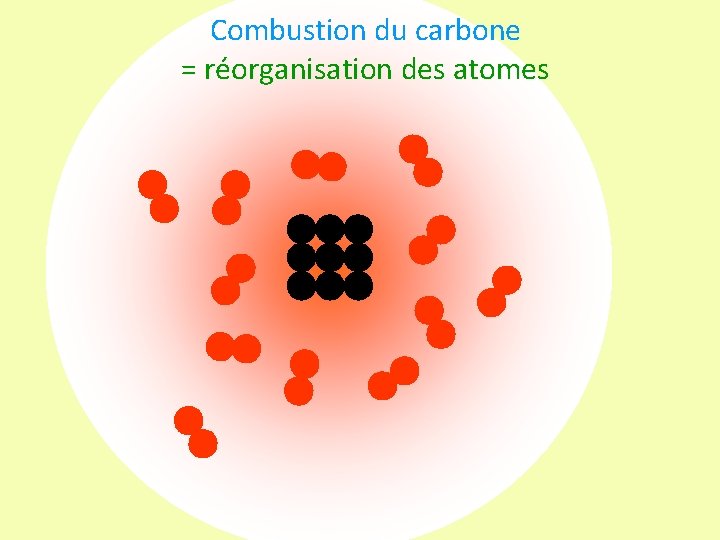
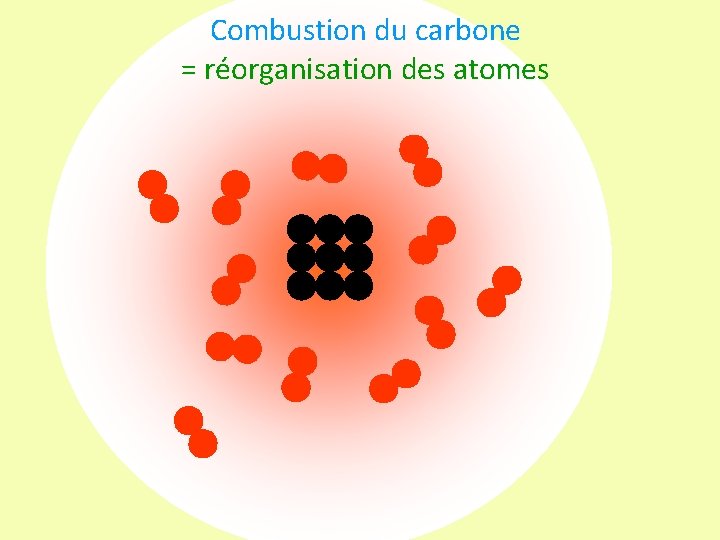
Combustion du carbone = réorganisation des atomes

Combustion du carbone = réorganisation des atomes

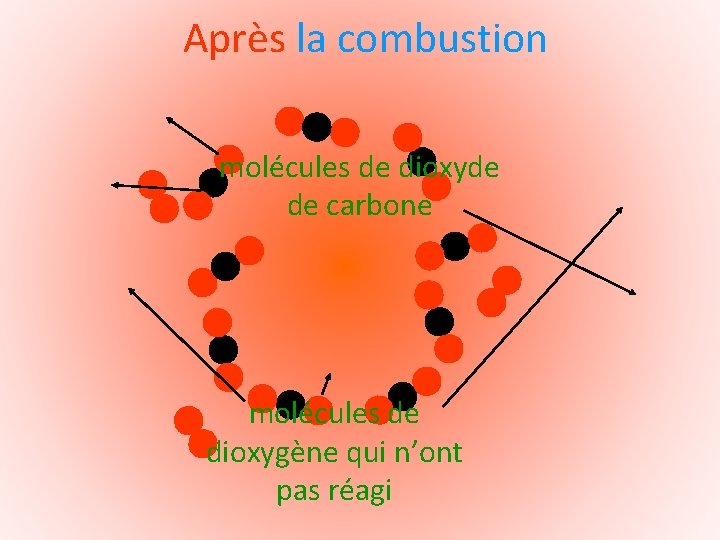
Après la combustion

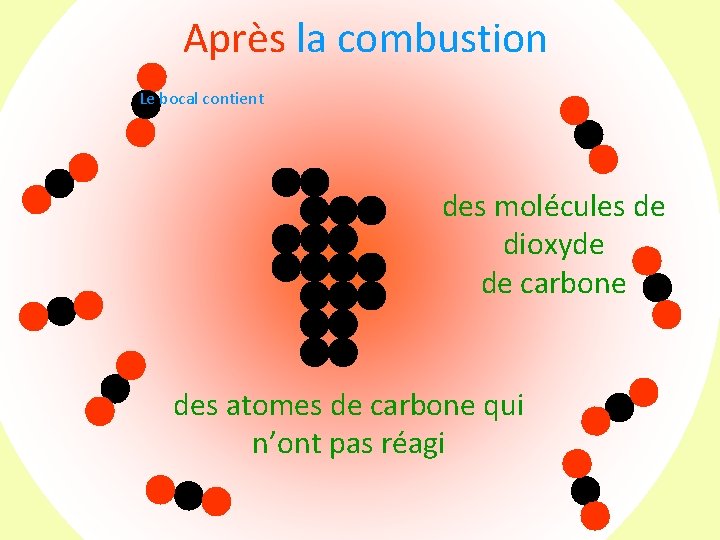
Après la combustion Le bocal contient des molécules de dioxyde de carbone

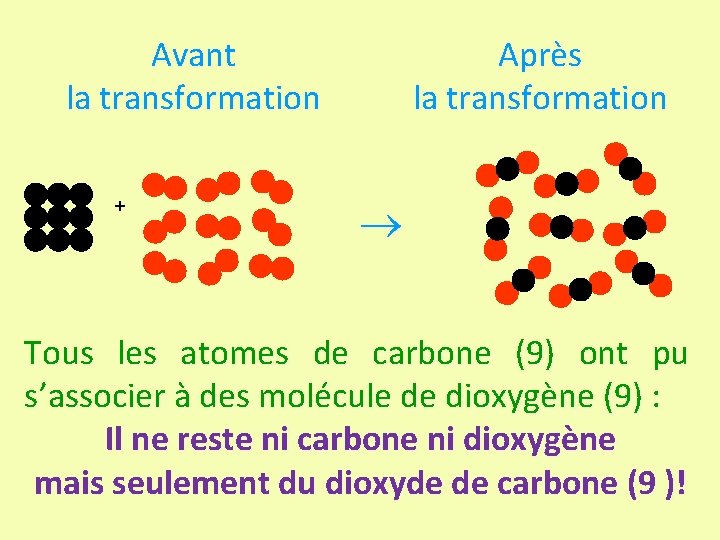
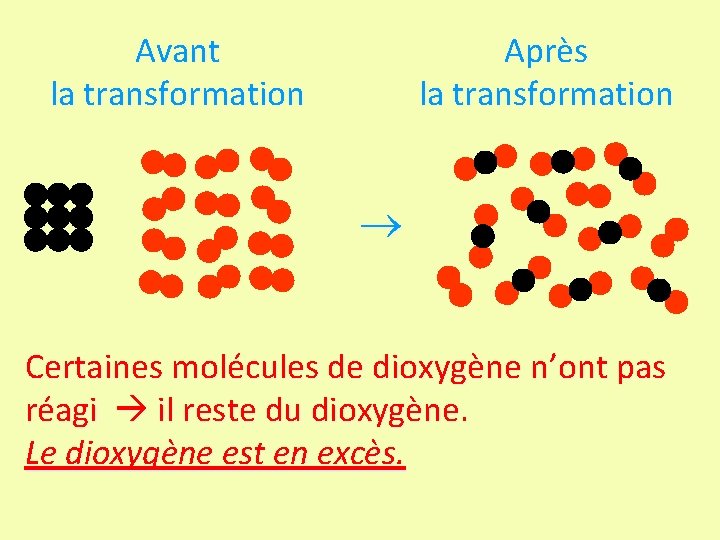
Avant la transformation + Après la transformation Tous les atomes de carbone (9) ont pu s’associer à des molécule de dioxygène (9) : Il ne reste ni carbone ni dioxygène mais seulement du dioxyde de carbone (9 )!

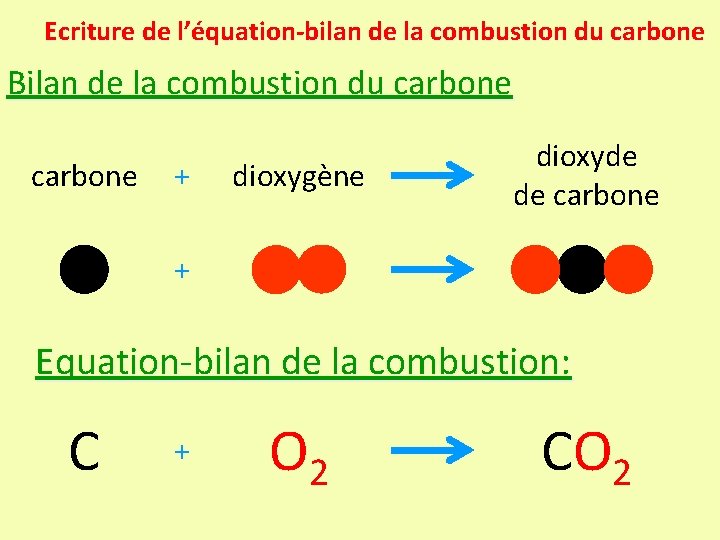
Ecriture de l’équation-bilan de la combustion du carbone Bilan de la combustion du carbone + dioxygène dioxyde de carbone + Equation-bilan de la combustion: C + O 2 CO 2

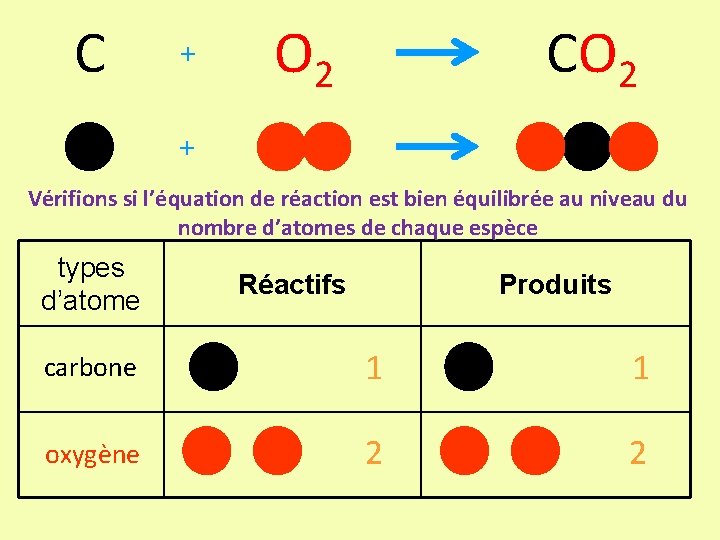
C + O 2 CO 2 + Vérifions si l’équation de réaction est bien équilibrée au niveau du nombre d’atomes de chaque espèce types d’atome Réactifs Produits carbone 1 1 oxygène 2 2

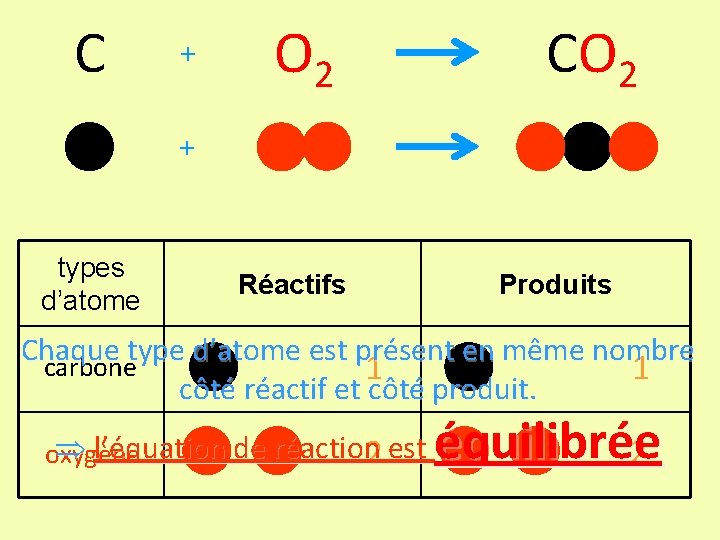
C + O 2 CO 2 + types d’atome Réactifs Produits Chaque type d’atome est présent en même nombre carbone 1 1 côté réactif et côté produit. l’équation de réaction 2 est oxygène équilibrée 2

Conclusion: L’équation-bilan de réaction de la combustion du carbone s’écrit : C + O 2 CO 2 Au cours d’une transformation chimique : • les molécules des réactifs sont cassées, leurs atomes Énoncé oral : se réarrangent et servent à construire les 1 atome de carbone réagit avec 1 molécule de produits. dioxygène pour former 1 molécule de dioxyde de • Aucun atome ne disparaît et aucun n’apparaît : il y a carbone conservation des atomes Une transformation chimique est donc une réorganisation des atomes.

Remarque importante: Pourquoi reste-t-il parfois du carbone dans le bocal en fin de combustion ? Regarde les animations suivantes et essaie de comprendre

Avant la combustion Le bocal contient du dioxygène du carbone

Démarrage de la combustion source de chaleur

Combustion du carbone = réorganisation des atomes

Combustion du carbone = réorganisation des atomes

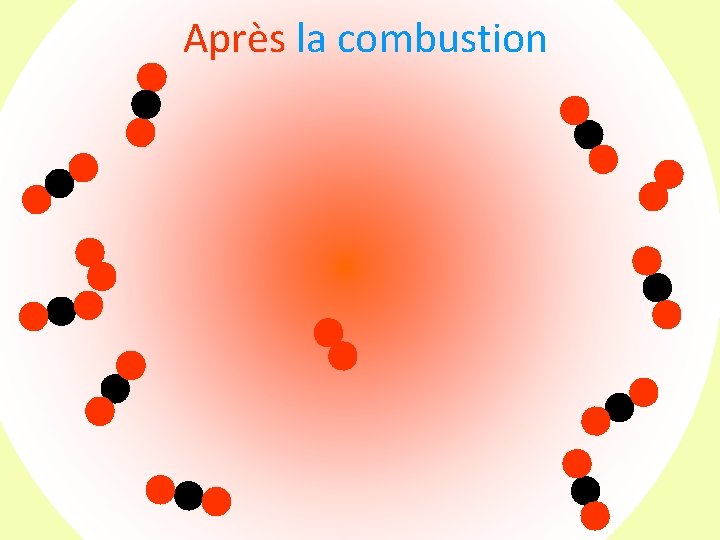
Après la combustion

Après la combustion Le bocal contient des molécules de dioxyde de carbone des atomes de carbone qui n’ont pas réagi

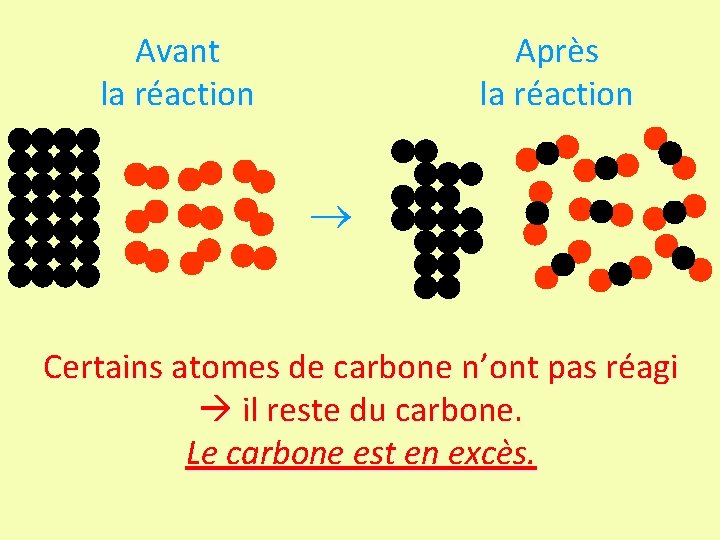
Avant la réaction Après la réaction Certains atomes de carbone n’ont pas réagi il reste du carbone. Le carbone est en excès.

Remarque importante: Pourquoi reste-t-il parfois du dioxygène dans le bocal en fin de combustion ? Regarde les animations suivantes et essaie de comprendre

Avant la combustion Le bocal contient du dioxygène du carbone

Démarrage de la combustion source de chaleur

Combustion du carbone = réorganisation des atomes

Combustion du carbone = réorganisation des atomes

Après la combustion molécules de dioxyde de carbone molécules de dioxygène qui n’ont pas réagi

Après la combustion

Avant la transformation Après la transformation Certaines molécules de dioxygène n’ont pas réagi il reste du dioxygène. Le dioxygène est en excès.

En complément: Explication de la combustion du carbone

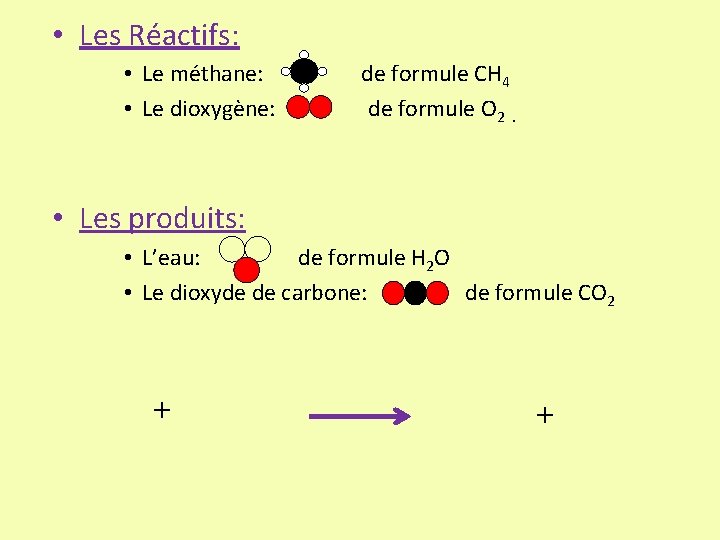
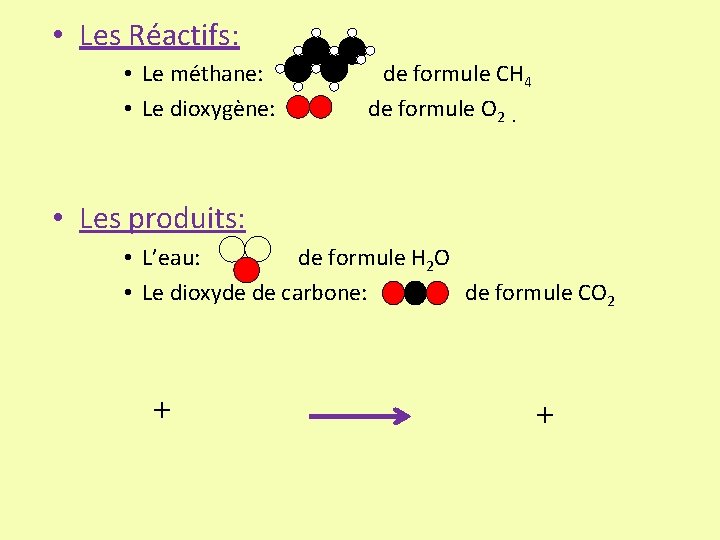
3/ Quelle est l’équation-bilan de la combustion du méthane ? • Les Réactifs: • Le méthane: • Le dioxygène: de formule CH 4 de formule O 2. • Les produits: • L’eau: de formule H 2 O • Le dioxyde de carbone: de formule CO 2

• Les Réactifs: • Le méthane: • Le dioxygène: de formule CH 4 de formule O 2. • Les produits: • L’eau: de formule H 2 O • Le dioxyde de carbone: de formule CO 2 + +

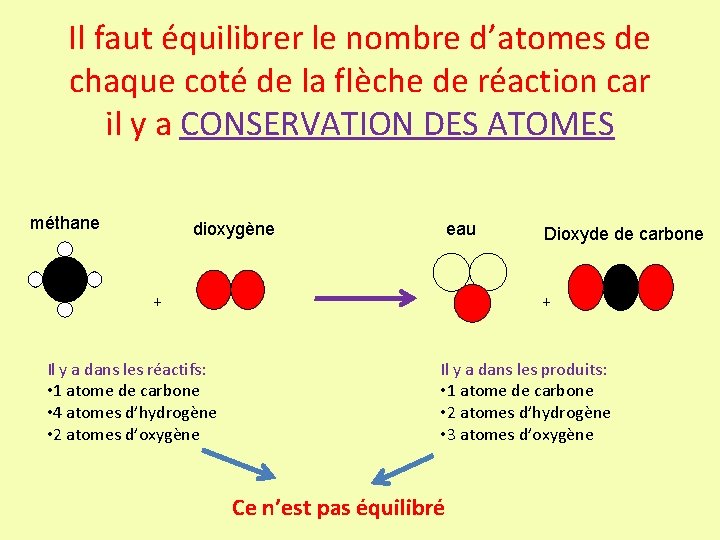
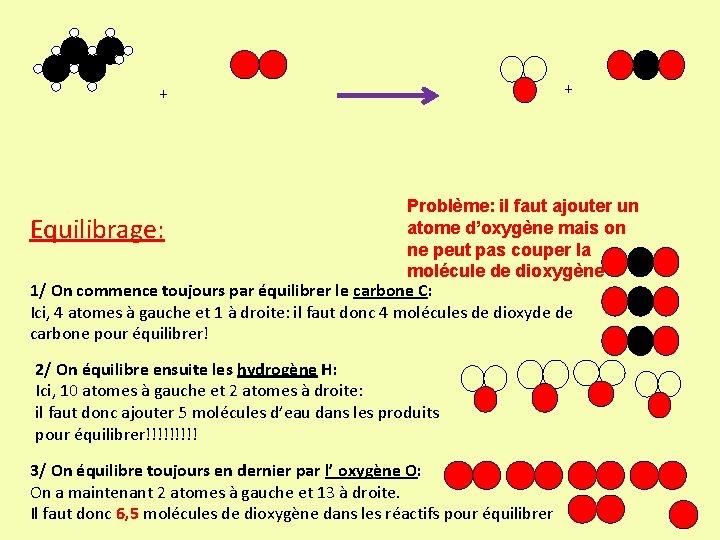
Il faut équilibrer le nombre d’atomes de chaque coté de la flèche de réaction car il y a CONSERVATION DES ATOMES méthane dioxygène eau + Il y a dans les réactifs: • 1 atome de carbone • 4 atomes d’hydrogène • 2 atomes d’oxygène Dioxyde de carbone + Il y a dans les produits: • 1 atome de carbone • 2 atomes d’hydrogène • 3 atomes d’oxygène Ce n’est pas équilibré

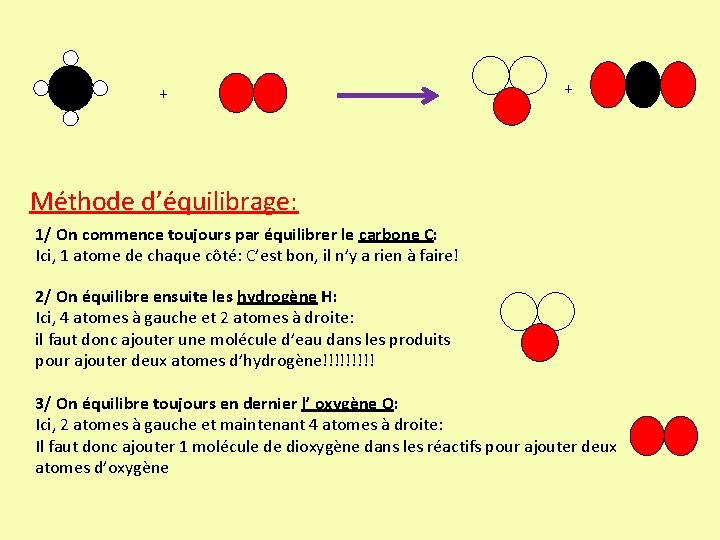
+ + Méthode d’équilibrage: 1/ On commence toujours par équilibrer le carbone C: Ici, 1 atome de chaque côté: C’est bon, il n’y a rien à faire! 2/ On équilibre ensuite les hydrogène H: Ici, 4 atomes à gauche et 2 atomes à droite: il faut donc ajouter une molécule d’eau dans les produits pour ajouter deux atomes d’hydrogène!!!!! 3/ On équilibre toujours en dernier l’ oxygène O: Ici, 2 atomes à gauche et maintenant 4 atomes à droite: Il faut donc ajouter 1 molécule de dioxygène dans les réactifs pour ajouter deux atomes d’oxygène

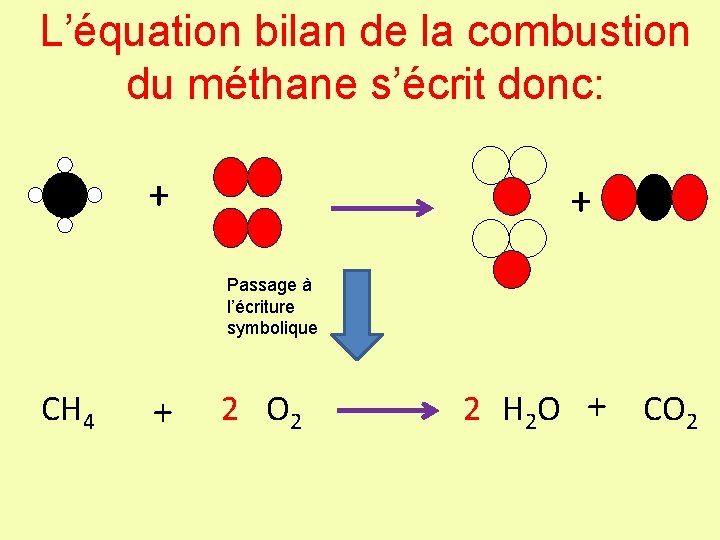
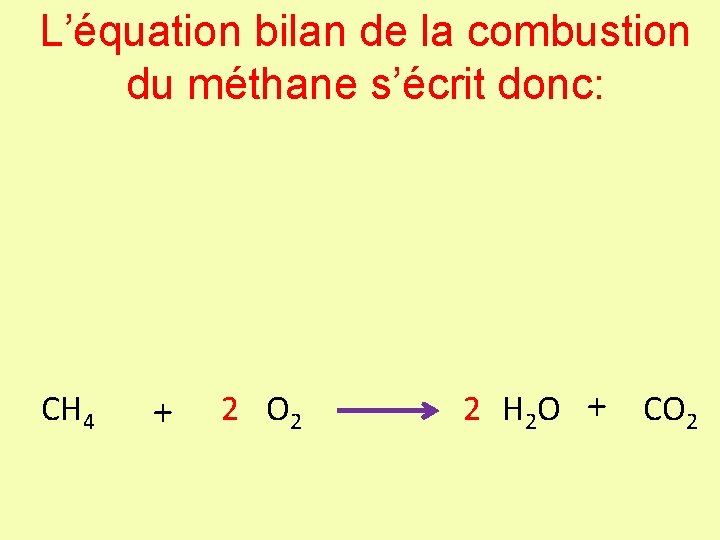
L’équation bilan de la combustion du méthane s’écrit donc: + + Passage à l’écriture symbolique CH 4 + 2 O 2 2 H 2 O + CO 2

L’équation bilan de la combustion du méthane s’écrit donc: CH 4 + 2 O 2 2 H 2 O + CO 2

4/ Quelle est l’équation-bilan de la combustion du butane ? • Les Réactifs: • Le butane : • Le dioxygène: de formule C 4 H 10 de formule O 2. • Les produits: • L’eau: de formule H 2 O • Le dioxyde de carbone: de formule CO 2

• Les Réactifs: • Le méthane: • Le dioxygène: de formule CH 4 de formule O 2. • Les produits: • L’eau: de formule H 2 O • Le dioxyde de carbone: de formule CO 2 + +

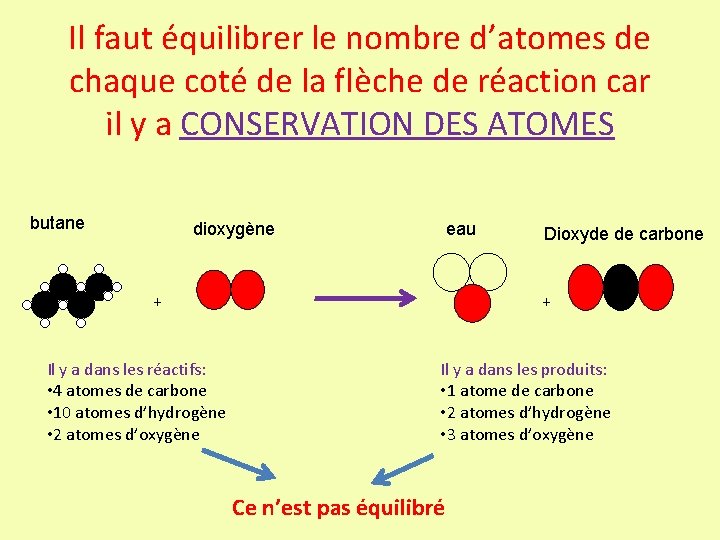
Il faut équilibrer le nombre d’atomes de chaque coté de la flèche de réaction car il y a CONSERVATION DES ATOMES butane dioxygène eau + Il y a dans les réactifs: • 4 atomes de carbone • 10 atomes d’hydrogène • 2 atomes d’oxygène Dioxyde de carbone + Il y a dans les produits: • 1 atome de carbone • 2 atomes d’hydrogène • 3 atomes d’oxygène Ce n’est pas équilibré

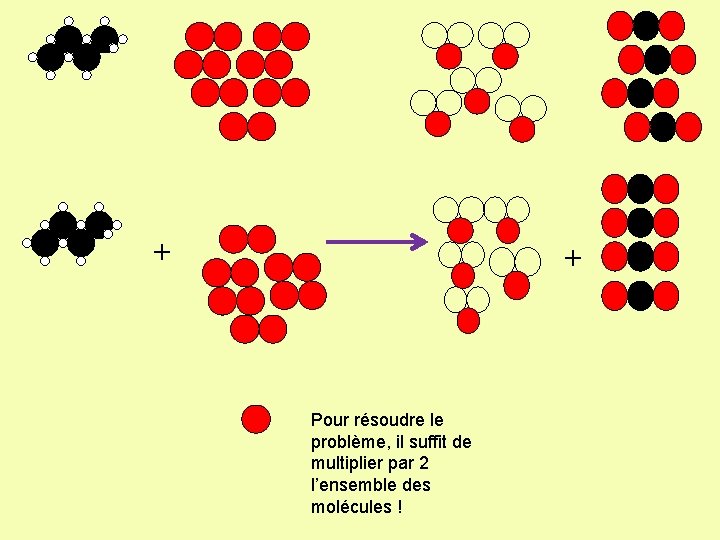
+ + Problème: il faut ajouter un atome d’oxygène mais on Equilibrage: ne peut pas couper la molécule de dioxygène 1/ On commence toujours par équilibrer le carbone C: Ici, 4 atomes à gauche et 1 à droite: il faut donc 4 molécules de dioxyde de carbone pour équilibrer! 2/ On équilibre ensuite les hydrogène H: Ici, 10 atomes à gauche et 2 atomes à droite: il faut donc ajouter 5 molécules d’eau dans les produits pour équilibrer!!!!! 3/ On équilibre toujours en dernier par l’ oxygène O: On a maintenant 2 atomes à gauche et 13 à droite. Il faut donc 6, 5 molécules de dioxygène dans les réactifs pour équilibrer

+ + Pour résoudre le problème, il suffit de multiplier par 2 l’ensemble des molécules !

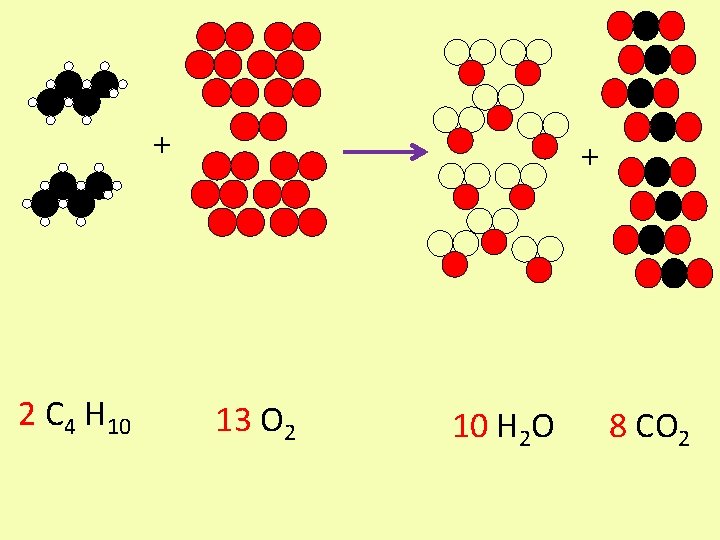
+ 2 C 4 H 10 + 13 O 2 10 H 2 O 8 CO 2

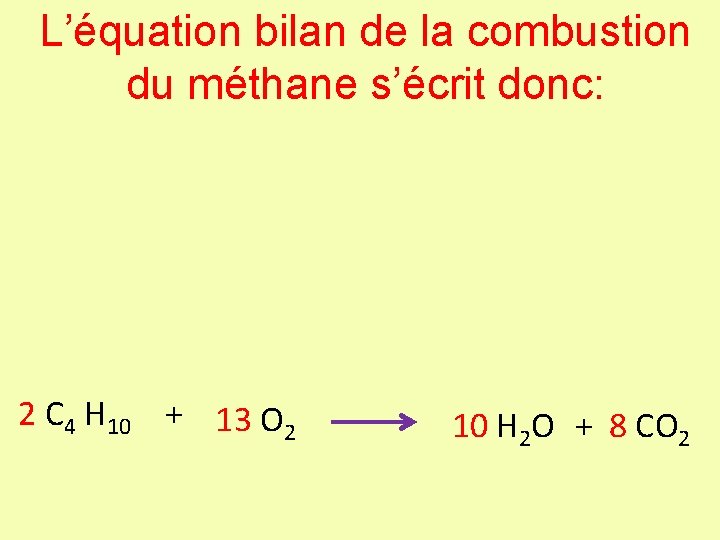
L’équation bilan de la combustion du méthane s’écrit donc: 2 C 4 H 10 + 13 O 2 10 H 2 O + 8 CO 2

Réalise ces exercices intéractifs

Sur Physikos, tu peux trouver plein d’animation pour t’entrainer

Voici une liste d’exercices de ton manuel –Tu les écris sur ton cahier. –Tu te corriges grâce aux réponses

Ex 14 p 70 : a) Réactifs : 3 C ; 8 H ; (5 x 2)= 10 O Produits : 3 C ; (3 x 2)+4= 10 O ; (4 x 2)= 8 H Réaction équilibrée b) Réactifs : 2 H ; 2 O Produits : 2 H ; 1 O Réaction non équilibrée H 2 + 02 → H 2 O H 2 + O 2 → 2 H 2 0 2 H 2 + O 2 → 2 H 2 O c) Réactifs : 1 C ; (1+2)= 3 O Produits : 2 C ; (2 x 2)= 4 O Réaction non équilibrée CO + O 2 → 2 CO 2 2 CO + O 2 → 2 CO 2

Ex 16 p 71 : a) C 4 H 10 + O 2→ CO 2 + H 2 O C 4 H 10 + O 2→ 4 CO 2 + 5 H 2 O C 4 H 10 + 6, 5 O 2→ 4 CO 2 + 5 H 2 O 2 C 4 H 10 + 13 O 2→ 8 CO 2 + 10 H 2 O b) C + O 2→ CO C + O 2→ 2 CO 2 C + O 2→ 2 CO c) C 5 H 12 + O 2→ CO 2 + H 2 O C 5 H 12 + O 2→ 5 CO 2 + 6 H 2 O C 5 H 12 + 8 O 2→ 5 CO 2 + 6 H 2 O

Ex 17 p 71 : 1. Chimiste britannique qui réalisa la synthèse de l’eau en 1783. 2. Dihydrogène : H 2 3. Equation de réaction : H 2 + O 2 → H 2 O H 2 + O 2 → 2 H 2 O 2 H 2 + O 2 → H 2 O

Ex 19 p 71 : 1. Réactifs : - dioxyde de carbone : CO 2 - eau : H 2 O 2. Produits : - glucose : C 6 H 12 O 6 - dioxygène : O 2 3. Equation de réaction : CO 2 + H 2 O → C 6 H 12 O 6 + O 2 6 CO 2 + 6 H 2 O → C 6 H 12 O 6 + 6 O 2

Ex 20 p 71 : 1. Réactifs : - alcool : C 2 H 6 O - dioxygène : O 2 2. Produits : - dioxyde de carbone : CO 2 - eau : H 2 O 3. Bilan littéral : alcool + dioxygène → dioxyde de carbone + eau 4. Equation de réaction : C 2 H 6 O + O 2 → CO 2 + H 2 O C 2 H 6 O + O 2 → 2 CO 2 + 3 H 2 O C 2 H 6 O + 3 O 2 → 2 CO 2 + 3 H 2 O

5/ Démarche d’investigation Octobre rouge • Voici une situation issu du film « a la poursuite d’Octobre Rouge » , film américain réalisé par John Mc. Tiernan sorti en 1990, d'après le roman Octobre rouge de Tom Clancy paru en 1984. Bonne réflexion!

Il faut sauver le sous-marin « octobre rouge » Commandant Ramius, les ballasts (poches d’air pour remonter à la surface) ne marchent plus !!! Quoi !!! C’est la cata … Comment remonter à la surface ?

Que proposez vous de faire pour remonter a la surface ? Nous transportons un stock de calcaire (craie), nous pourrions le faire réagir avec de l’acide: cela produit du gaz léger qui pourrait donc nous alléger et nous faire remonter à la surface!

Pff…! Cela ne marchera jamais … Avant de tenter quoi que ce soit, vérifiez si ça a une chance de marcher … A vos ordres mon capitaine !

J’attends votre rapport sur mon bureau dans 15 à 20 min!

Plan du rapport (à faire sur une feuille) 1/ Ce que je pense… (/2) 2/ Ce que je vais faire… (/2) 3/ Je réalise l’expérience (/2) 4/ Ce que j’observe (/2) 5/ Conclusion (/2) +2 points pour la rédaction

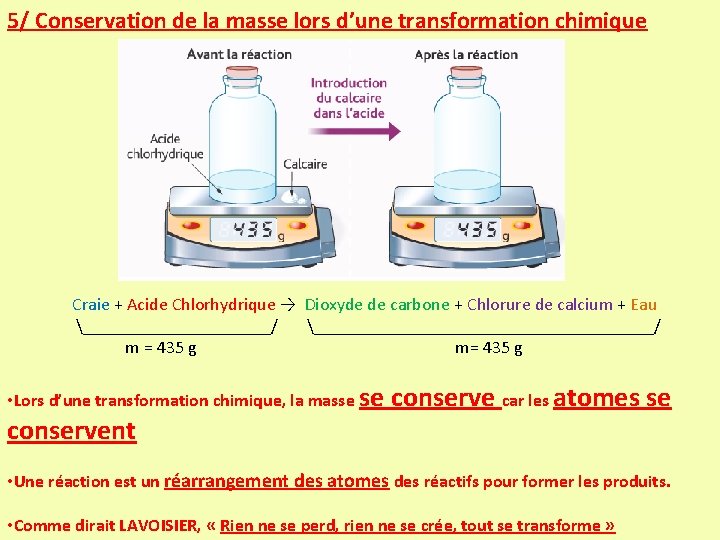
5/ Conservation de la masse lors d’une transformation chimique Craie + Acide Chlorhydrique → Dioxyde de carbone + Chlorure de calcium + Eau ___________/ ___________________/ m = 435 g m= 435 g • Lors d’une transformation chimique, la masse se conservent conserve car les atomes se • Une réaction est un réarrangement des atomes des réactifs pour former les produits. • Comme dirait LAVOISIER, « Rien ne se perd, rien ne se crée, tout se transforme »

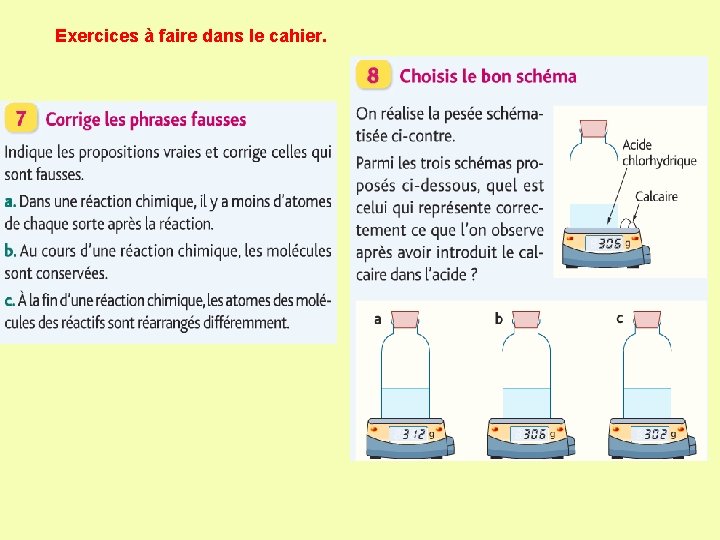
Exercices à faire dans le cahier.