Chapitre 4 Atomes molcules et transformations chimiques nous











































- Slides: 76

Chapitre 4: Atomes, molécules et transformations chimiques nous allons nous placer à l’échelle microscopique.

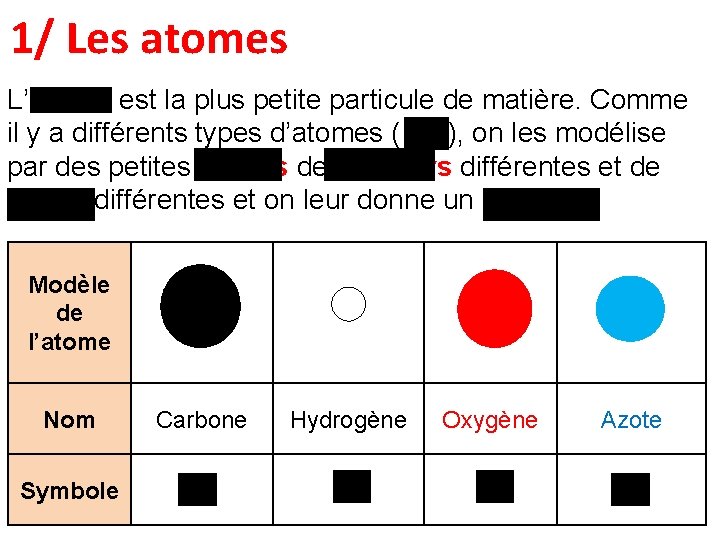
1/ Les atomes L’atome est la plus petite particule de matière. Comme il y a différents types d’atomes (118), on les modélise par des petites boules de couleurs différentes et de tailles différentes et on leur donne un symbole Modèle de l’atome Nom Carbone Hydrogène Oxygène Azote Symbole C H O N

Atome et molécule: exercices

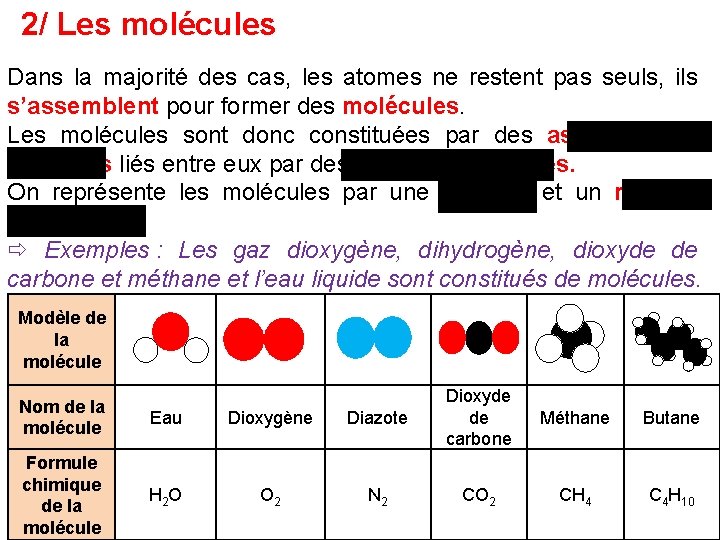
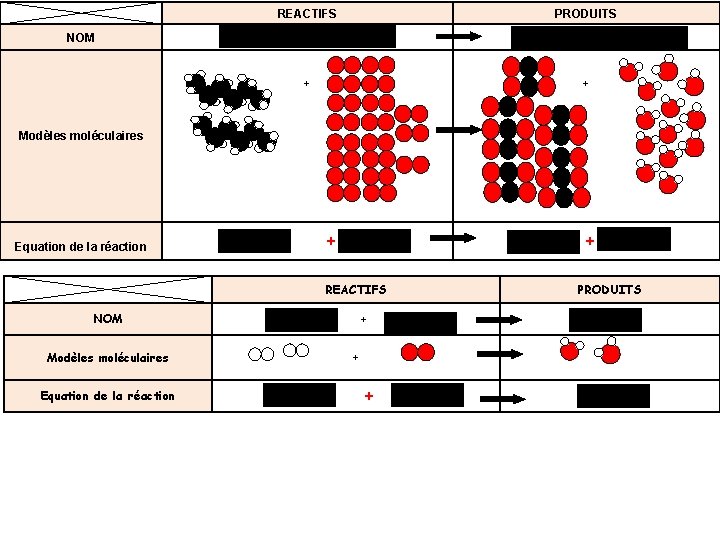
2/ Les molécules Dans la majorité des cas, les atomes ne restent pas seuls, ils s’assemblent pour former des molécules. Les molécules sont donc constituées par des assemblages d’atomes liés entre eux par des liaisons chimiques. On représente les molécules par une formule et un modèle moléculaire. Exemples : Les gaz dioxygène, dihydrogène, dioxyde de carbone et méthane et l’eau liquide sont constitués de molécules. Modèle de la molécule Nom de la molécule Eau Dioxygène Formule chimique de la molécule H 2 O O 2 Diazote Dioxyde de carbone Méthane Butane N 2 CO 2 CH 4 C 4 H 10

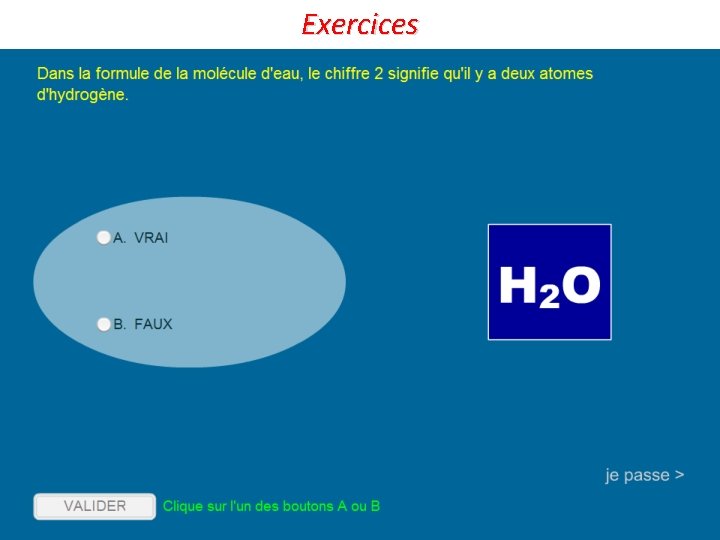
Modèle de la molécule Nom de la molécule Eau Dioxygène Formule chimique de la molécule H 2 O O 2 Diazote Dioxyde de carbone Méthane Butane N 2 CO 2 CH 4 C 4 H 10 Que représentent les chiffres en indice ? Ils indiquent le nombre d’atomes dans la molécule. Exemple : Dans H 2 O, il y a 2 atomes d’hydrogène et 1 atome d’oxygène. Que représentent les lettres ? Elles indiquent le nom des atomes dans la molécule Quand il n’y a pas de chiffre en indice, que cela signifie-t-il ? Il est sous-entendu « 1 » .

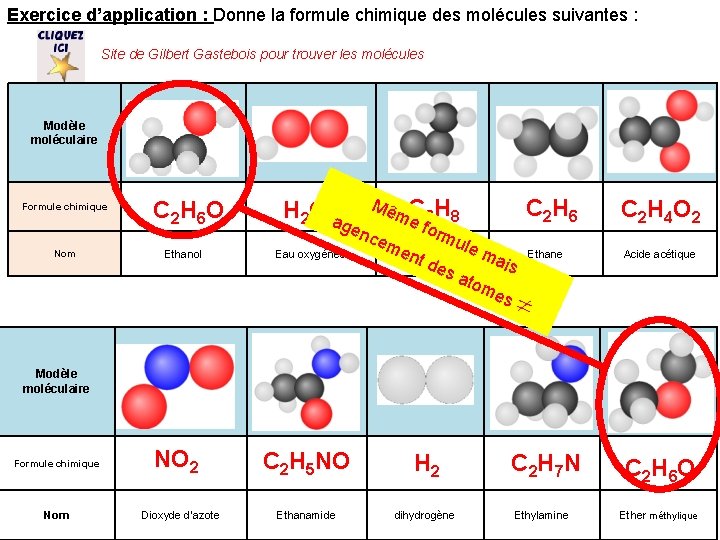
Exercice d’application : Donne la formule chimique des molécules suivantes : Site de Gilbert Gastebois pour trouver les molécules Modèle moléculaire Formule chimique Nom C 2 H 6 O Ethanol Mê C H me 3 8 gen form cem ule en. Propane Eau oxygénée ma t de is sa tom es H 2 O 2 a C 2 H 6 Ethane C 2 H 4 O 2 Acide acétique Modèle moléculaire Formule chimique Nom NO 2 Dioxyde d’azote C 2 H 5 NO H 2 Ethanamide dihydrogène C 2 H 7 N Ethylamine C 2 H 6 O Ether méthylique

Molécules en représentation 3 D

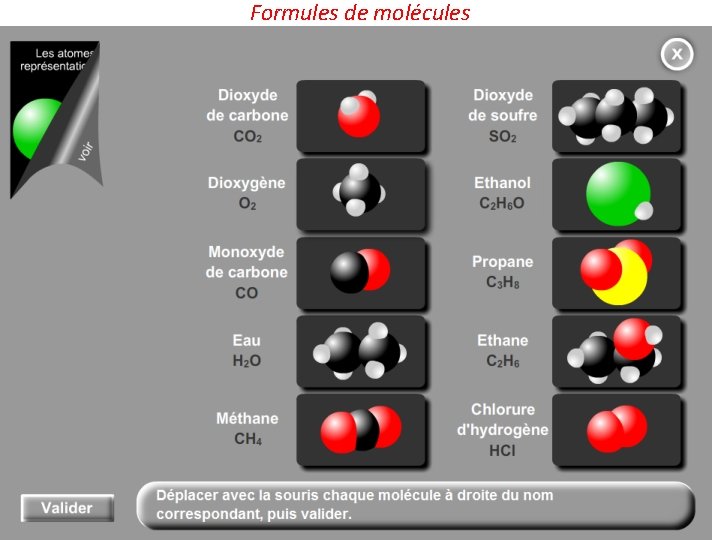
Formules de molécules

Composition des molécules

Exercices

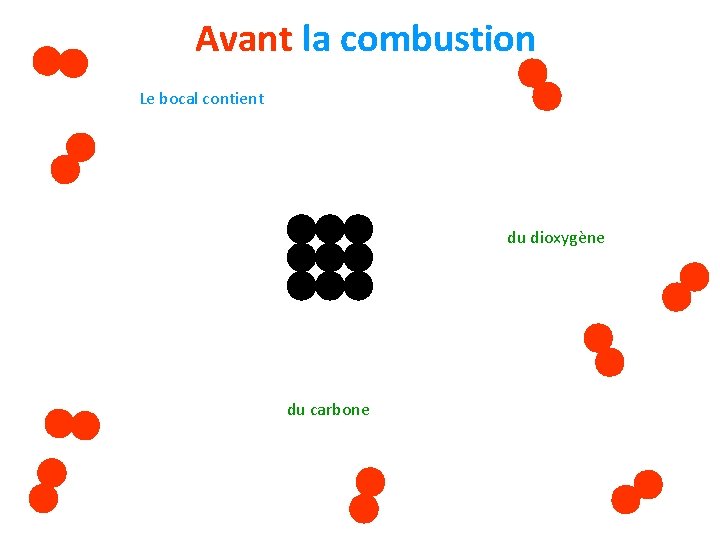
3/ Que se passe-t-il lors d’une transformation chimique ? A/ Lors de la combustion du carbone dans le dioxygène. Prenons un cas particulier: q 9 molécules de dioxygène q 9 atomes de carbone Regardez ce qu’il se passe…

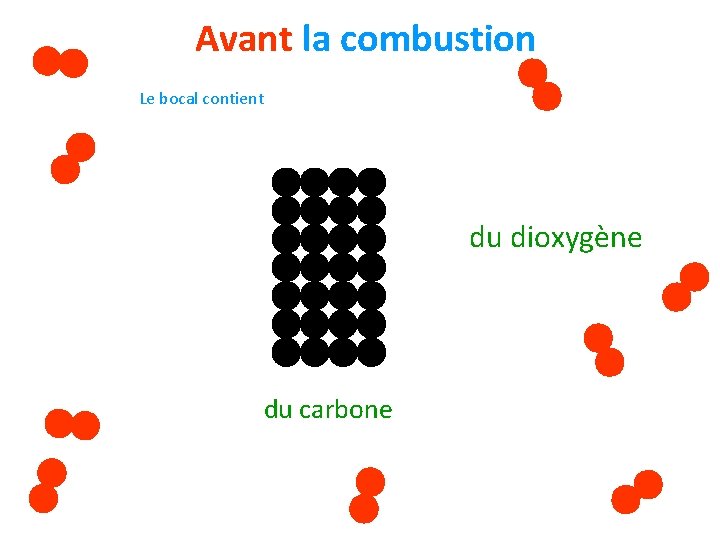
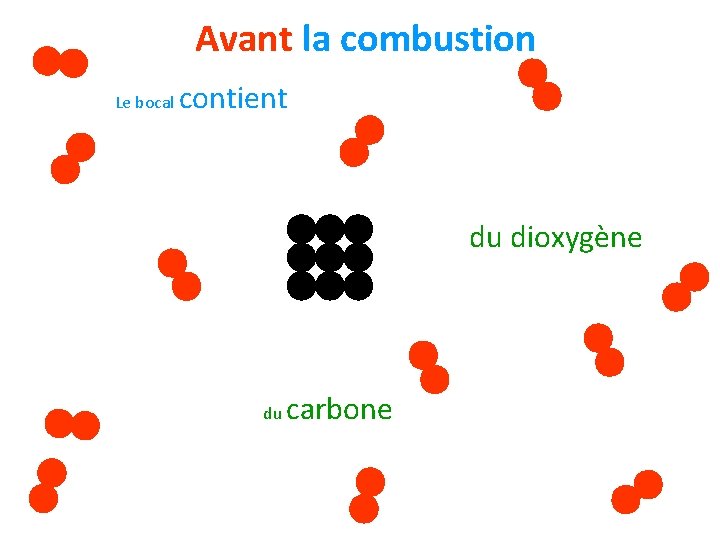
Avant la combustion Le bocal contient du dioxygène du carbone

Démarrage de la combustion source de chaleur

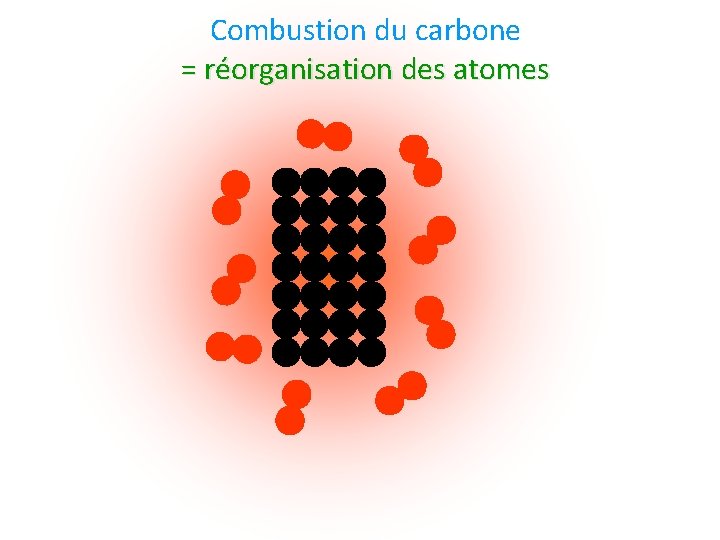
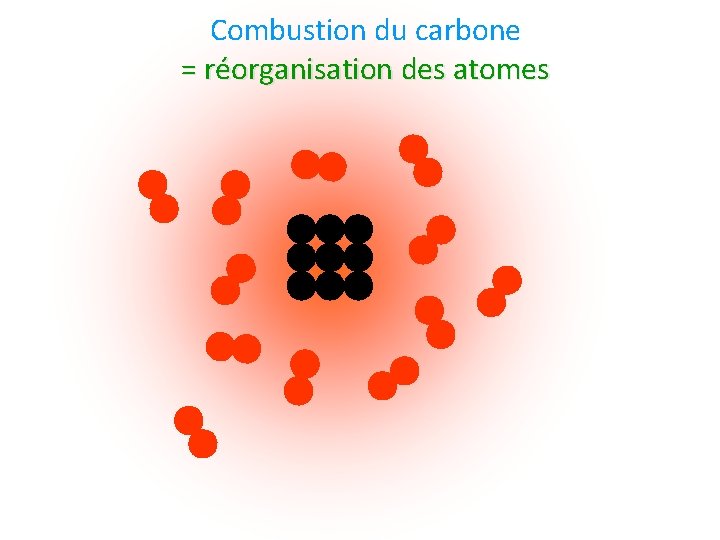
Combustion du carbone = réorganisation des atomes

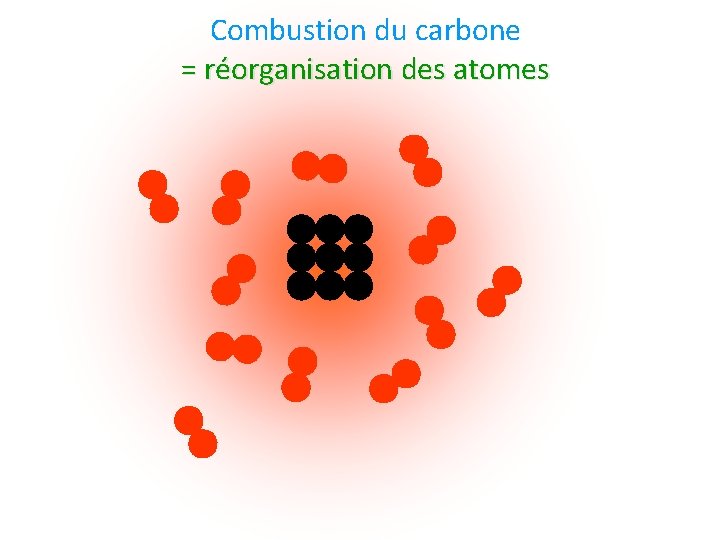
Combustion du carbone = réorganisation des atomes

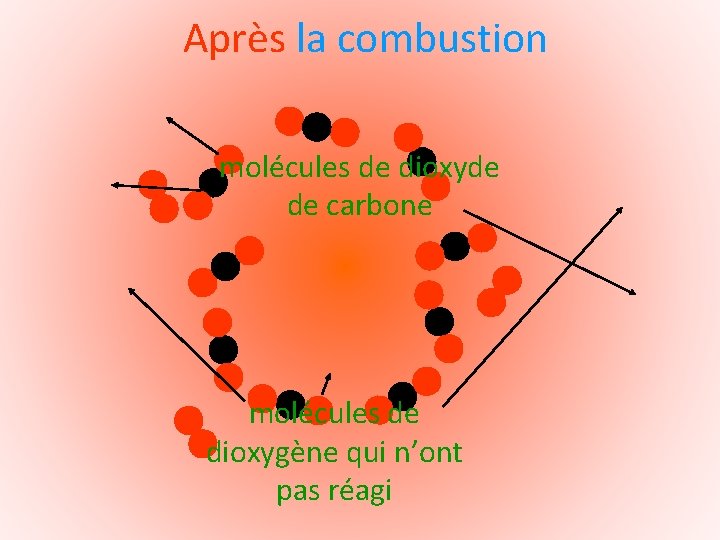
Après la combustion

Après la combustion Le bocal contient des molécules de dioxyde de carbone

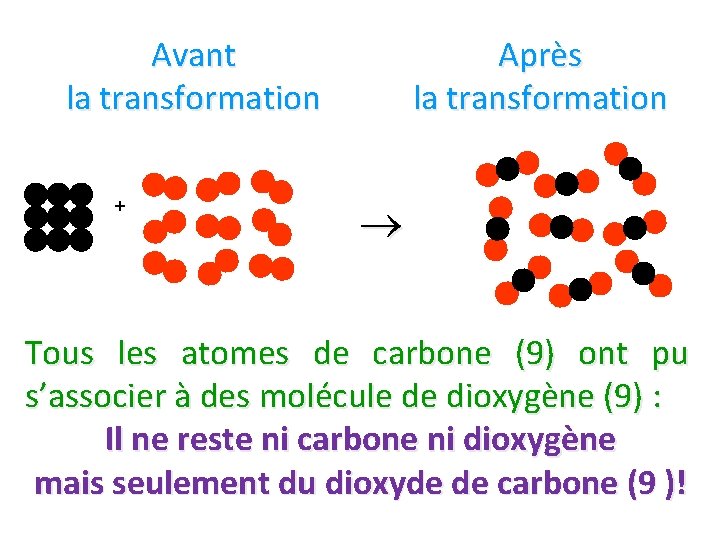
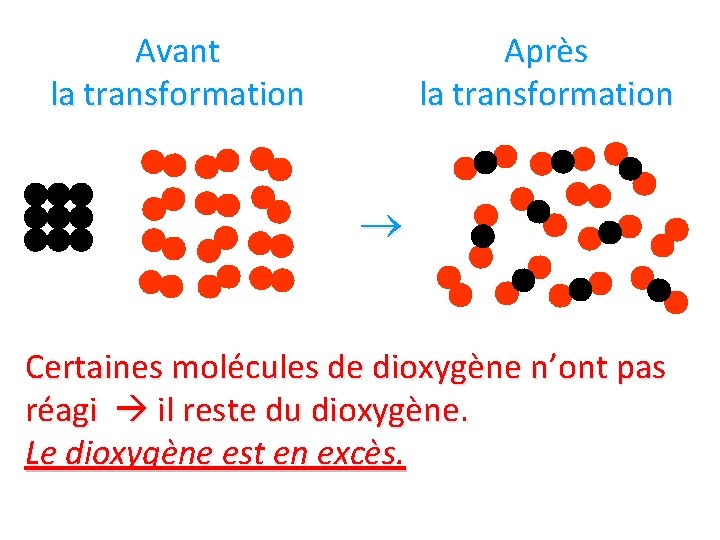
Avant la transformation + Après la transformation Tous les atomes de carbone (9) ont pu s’associer à des molécule de dioxygène (9) : Il ne reste ni carbone ni dioxygène mais seulement du dioxyde de carbone (9 )!

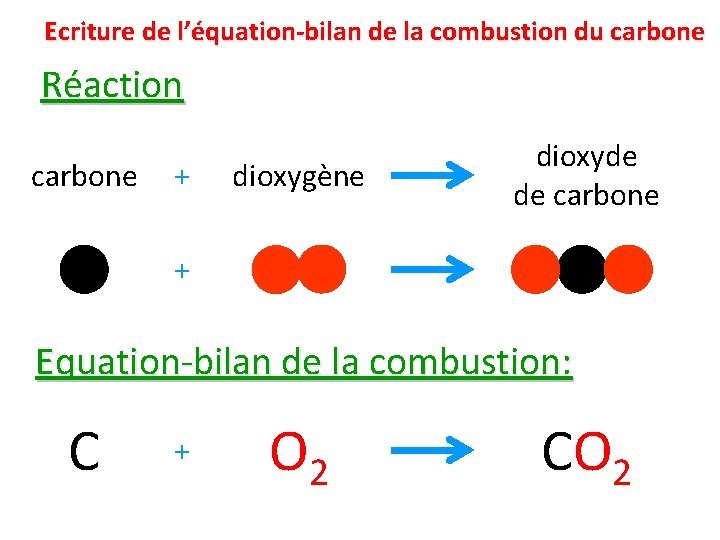
Ecriture de l’équation-bilan de la combustion du carbone Réaction carbone + dioxygène dioxyde de carbone + Equation-bilan de la combustion: C + O 2 CO 2

Mettons cette foisci beaucoup de carbone dans un tout petit peu de dioxygène Regardez ce qu’il se passe…

Avant la combustion Le bocal contient du dioxygène du carbone

Démarrage de la combustion source de chaleur

Combustion du carbone = réorganisation des atomes

Combustion du carbone = réorganisation des atomes

Après la combustion

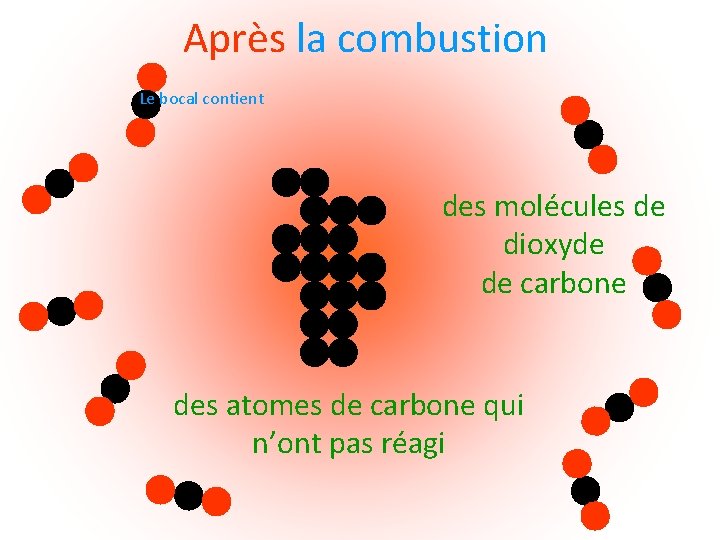
Après la combustion Le bocal contient des molécules de dioxyde de carbone des atomes de carbone qui n’ont pas réagi

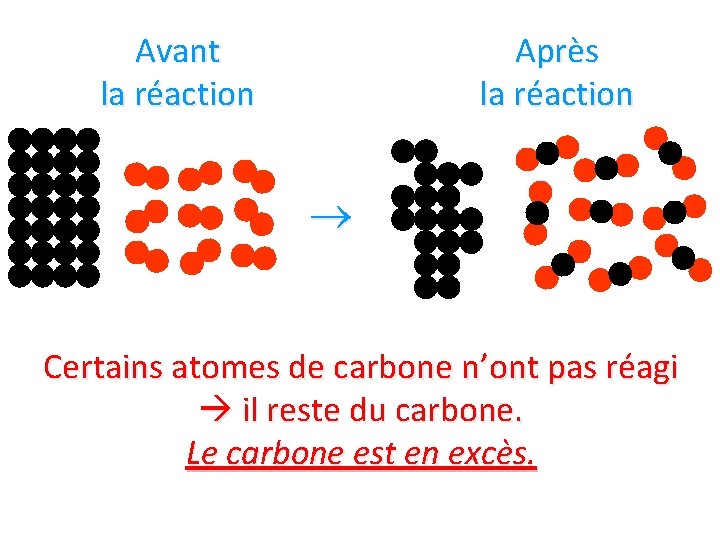
Avant la réaction Après la réaction Certains atomes de carbone n’ont pas réagi il reste du carbone. Le carbone est en excès.

Mettons cette fois-ci peu de carbone dans un beaucoup de dioxygène Regardez ce qu’il se passe…

Avant la combustion Le bocal contient du dioxygène du carbone

Démarrage de la combustion source de chaleur

Combustion du carbone = réorganisation des atomes

Combustion du carbone = réorganisation des atomes

Après la combustion molécules de dioxyde de carbone molécules de dioxygène qui n’ont pas réagi

Après la combustion

Avant la transformation Après la transformation Certaines molécules de dioxygène n’ont pas réagi il reste du dioxygène. Le dioxygène est en excès.

Une transformation chimique s’arrête quand un des réactifs a totalement disparu !!!

Re to ur àv de otre co f urs euil le

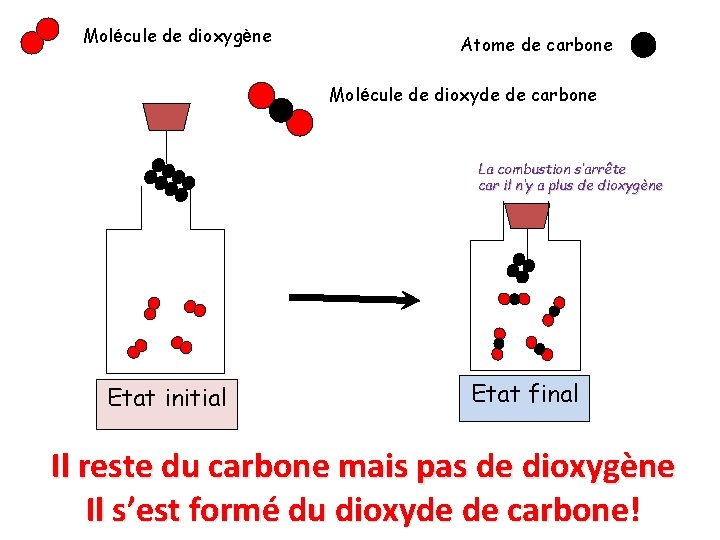
Molécule de dioxygène Atome de carbone Molécule de dioxyde de carbone La combustion s’arrête car il n’y a plus de dioxygène Etat initial Etat final Il reste du carbone mais pas de dioxygène Il s’est formé du dioxyde de carbone!

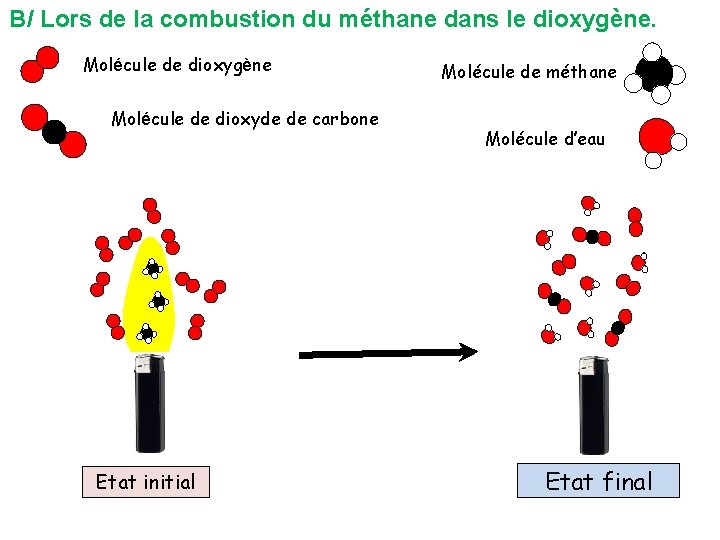
B/ Lors de la combustion du méthane dans le dioxygène. Molécule de dioxygène Molécule de dioxyde de carbone Etat initial Molécule de méthane Molécule d’eau Etat final

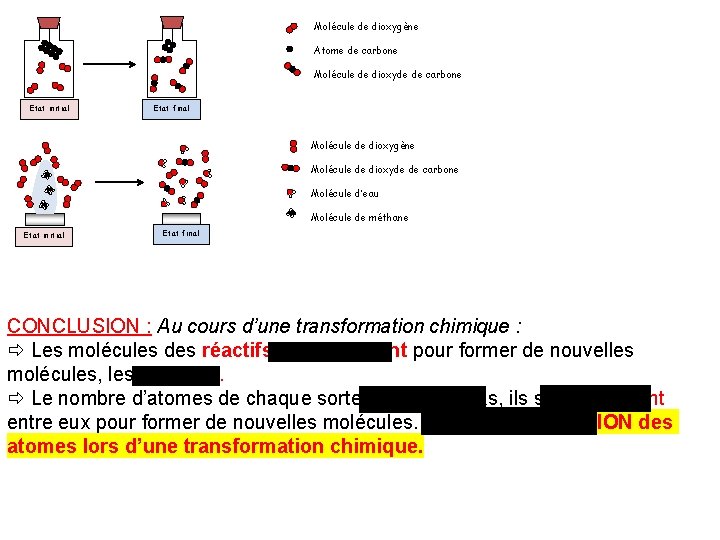
Molécule de dioxygène Atome de carbone Molécule de dioxyde de carbone Etat initial Etat final Molécule de dioxygène Molécule de dioxyde de carbone Molécule d’eau Molécule de méthane Etat initial Etat final CONCLUSION : Au cours d’une transformation chimique : Les molécules des réactifs disparaissent pour former de nouvelles molécules, les produits. Le nombre d’atomes de chaque sorte ne change pas, ils se réarrangent entre eux pour former de nouvelles molécules. Il y a CONSERVATION des atomes lors d’une transformation chimique.

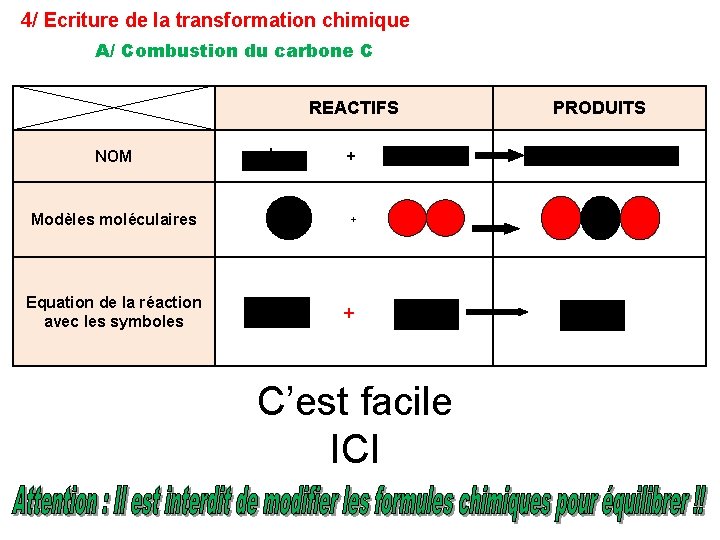
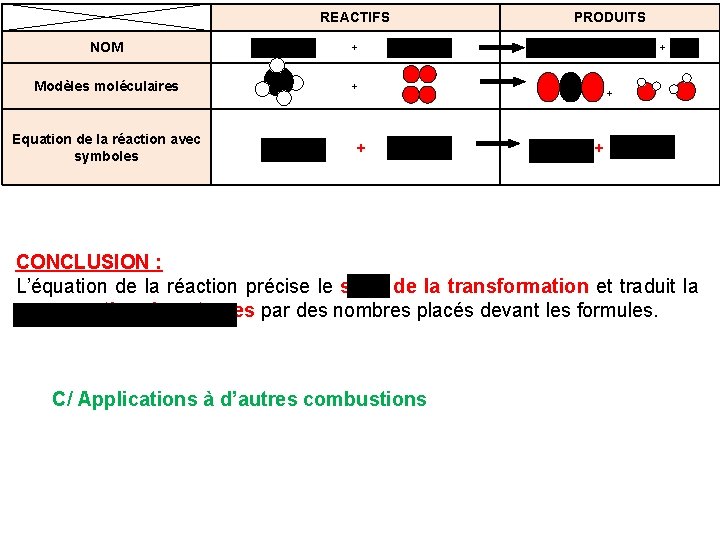
4/ Ecriture de la transformation chimique A/ Combustion du carbone C NOM carbone Modèles moléculaires Equation de la réaction avec les symboles REACTIFS PRODUITS + dioxygène dioxyde de carbone O 2 CO 2 + C’est facile ICI

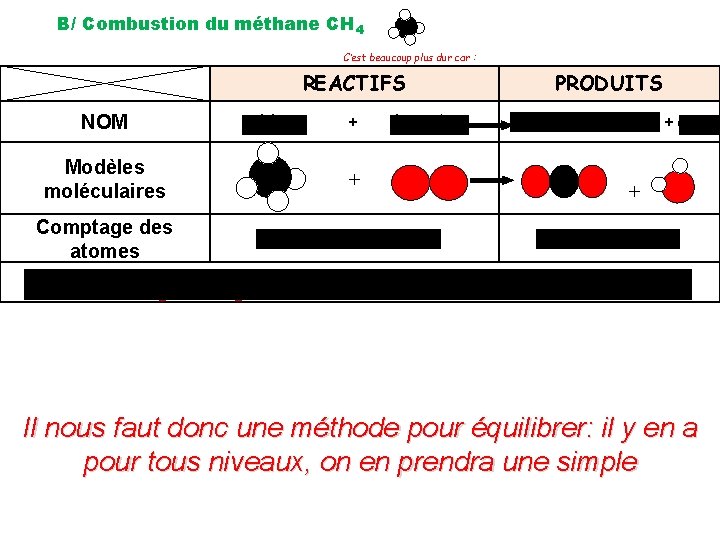
B/ Combustion du méthane CH 4 C’est beaucoup plus dur car : REACTIFS NOM méthane Modèles moléculaires Comptage des atomes + dioxygène + 1 C +4 H PRODUITS dioxyde de carbone + eau + +2 O 3 O+1 C+2 H Ce n’est pas équilibré au niveau des atomes !!!! Il nous faut donc une méthode pour équilibrer: il y en a pour tous niveaux, on en prendra une simple

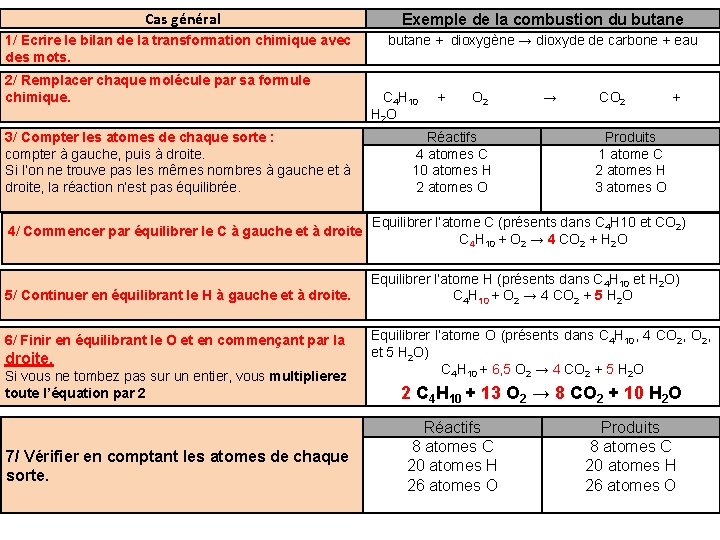
Cas général 1/ Ecrire le bilan de la transformation chimique avec des mots. 2/ Remplacer chaque molécule par sa formule chimique. 3/ Compter les atomes de chaque sorte : compter à gauche, puis à droite. Si l’on ne trouve pas les mêmes nombres à gauche et à droite, la réaction n’est pas équilibrée. 4/ Commencer par équilibrer le C à gauche et à droite 5/ Continuer en équilibrant le H à gauche et à droite. 6/ Finir en équilibrant le O et en commençant par la droite. Si vous ne tombez pas sur un entier, vous multiplierez toute l’équation par 2 7/ Vérifier en comptant les atomes de chaque sorte. Exemple de la combustion du butane + dioxygène → dioxyde de carbone + eau C 4 H 10 H 2 O + O 2 Réactifs 4 atomes C 10 atomes H 2 atomes O → CO 2 + Produits 1 atome C 2 atomes H 3 atomes O Equilibrer l’atome C (présents dans C 4 H 10 et CO 2) C 4 H 10 + O 2 → 4 CO 2 + H 2 O Equilibrer l’atome H (présents dans C 4 H 10 et H 2 O) C 4 H 10 + O 2 → 4 CO 2 + 5 H 2 O Equilibrer l’atome O (présents dans C 4 H 10, 4 CO 2, et 5 H 2 O) C 4 H 10 + 6, 5 O 2 → 4 CO 2 + 5 H 2 O 2 C 4 H 10 + 13 O 2 → 8 CO 2 + 10 H 2 O Réactifs 8 atomes C 20 atomes H 26 atomes O Produits 8 atomes C 20 atomes H 26 atomes O

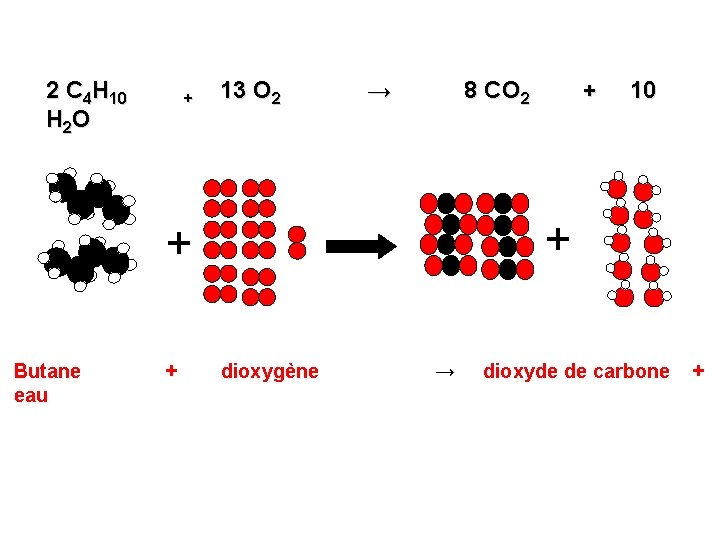
2 C 4 H 10 H 2 O + 13 O 2 → 8 CO 2 + 10 + + Butane eau + dioxygène → dioxyde de carbone +

Cas général 1/ Ecrire le bilan de la transformation chimique avec des mots. 2/ Remplacer chaque molécule par sa formule chimique. 3/ Compter les atomes de chaque sorte : compter à gauche, puis à droite. Si l’on ne trouve pas les mêmes nombres à gauche et à droite, la réaction n’est pas équilibrée. 4/ Commencer par équilibrer le C à gauche et à droite 5/ Continuer en équilibrant le H à gauche et à droite. 6/ Finir en équilibrant le O et en commençant par la droite. Si vous ne tombez pas sur un entier, vous multiplierez toute l’équation par 2 7/ Vérifier en comptant les atomes de chaque sorte. Exemple de la combustion du butane méthane + dioxygène → dioxyde de carbone + eau CH 4 H 2 O + O 2 Réactifs 1 atomes C 4 atomes H 2 atomes O → CO 2 + Produits 1 atome C 2 atomes H 3 atomes O Equilibrer l’atome C (présents dans CH 4 et CO 2) CH 4 + O 2 → CO 2 + H 2 O Equilibrer l’atome H (présents dans CH 4 et H 2 O) CH 4 + O 2 → CO 2 + 2 H 2 O CH 4 + 2 O 2 → CO 2 + 2 H 2 O Réactifs 1 atomes C 4 atomes H 4 atomes O Produits 1 atomes C 4 atomes H 4 atomes O

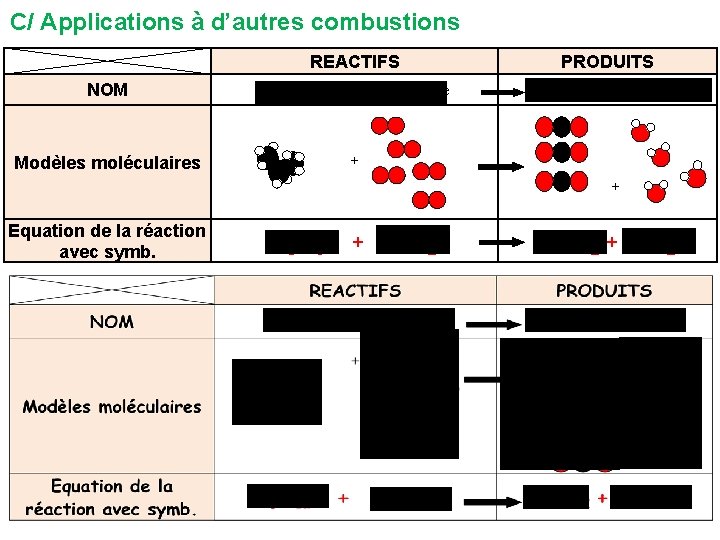
NOM méthane Modèles moléculaires Equation de la réaction avec symboles REACTIFS PRODUITS + dioxyde de carbone + eau dioxygène + CH 4 + + 2 O 2 CO 2 + 2 H 2 O CONCLUSION : L’équation de la réaction précise le sens de la transformation et traduit la conservation des atomes par des nombres placés devant les formules. C/ Applications à d’autres combustions

C/ Applications à d’autres combustions REACTIFS NOM propane Modèles moléculaires + dioxygène PRODUITS dioxyde de carbone + eau + + Equation de la réaction avec symb. C 3 H 8 + 5 O 2 3 CO 2 + 4 H 2 O

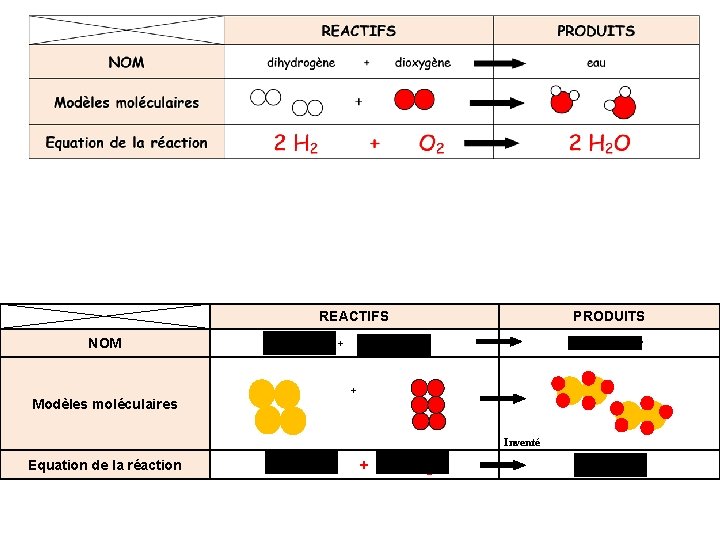
REACTIFS NOM hexane + PRODUITS dioxygène dioxyde de carbone + eau + + Modèles moléculaires Equation de la réaction 2 C 6 H 14 + 19 O 2 12 CO 2 + 14 H 2 O REACTIFS NOM dihydrogène Modèles moléculaires Equation de la réaction + PRODUITS dioxygène eau O 2 2 H 2 O + 2 H 2 +

REACTIFS NOM fer + PRODUITS dioxygène Oxyde de fer + Modèles moléculaires Inventé Equation de la réaction 4 Fe + 3 O 2 2 Fe 2 O 3

5/ La masse est-elle conservée lors d’une transformation chimique ? Essayons donc d’aider notre ami tintin, embarqué à bord du plus célèbre sous-marin de la BD « Le Trésor de Rackham le Rouge » Professeur, j’ai un problème ! Mon sous- marin ne remonte plus. Que puis -je faire ? J’ai un stock de craie, d’acide et de soude à bord, est-ce que cela peut m’aider ? 1 Tintin, tu peux essayer de mélanger les craies et l’acide. Ça produit un gaz (CO 2 je crois) qui te fera remonter à la surface car il allègera ton sous-marin ! 2 3

1/ Ce que je pense et ce que je vais faire… RAISONNER ( /2) Je pense que Haddock a raison car la masse totale des molécules ne changera pas lors de la réaction chimique. En effet, les molécules ne peuvent pas sortir du sous-marin. Je vais peser les réactifs (craie + acide chlorhydrique) au début puis tout au long de la réaction avec une balance. Attention, il faut un bocal FERME. Le matériel que je vais utiliser est : Erlenmeyer fermé avec bouchon, craie, acide chlorhydrique, balance, spatule, pipette. 2/ Je réalise mon expérience… proprement et dans le calme. (appelle le professeur) 3/ Ce que j’observe…S’INFORMER ( /2) Les résultats CHIFFRES de mon expérience sont : AU début de l’expérience : L’ensemble ( craie + acide dans l’erlenmeyer + bouchon) pèse 200, 00 g Au cours de l’expérience, la craie se rongée par l’acide et du dioxyde de carbone se forme. La masse est et reste toujours de 200, 00 g. Je réalise un schéma légendé et PROPRE de l’expérience que j’ai faite et j’indique les résultats chiffrés:

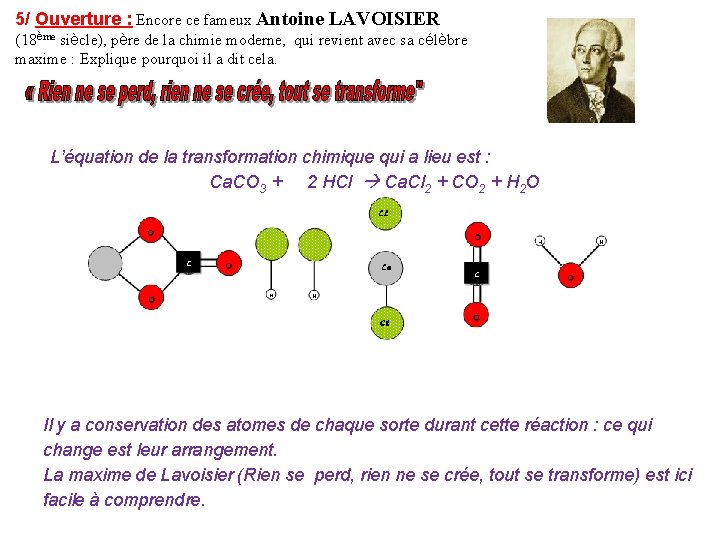
5/ Ouverture : Encore ce fameux Antoine LAVOISIER (18ème siècle), père de la chimie moderne, qui revient avec sa célèbre maxime : Explique pourquoi il a dit cela. L’équation de la transformation chimique qui a lieu est : Ca. CO 3 + 2 HCl Ca. Cl 2 + CO 2 + H 2 O Il y a conservation des atomes de chaque sorte durant cette réaction : ce qui change est leur arrangement. La maxime de Lavoisier (Rien se perd, rien ne se crée, tout se transforme) est ici facile à comprendre.

Conservation de la masse selon Lavoisier

Ex erc i ce s

1 2 3

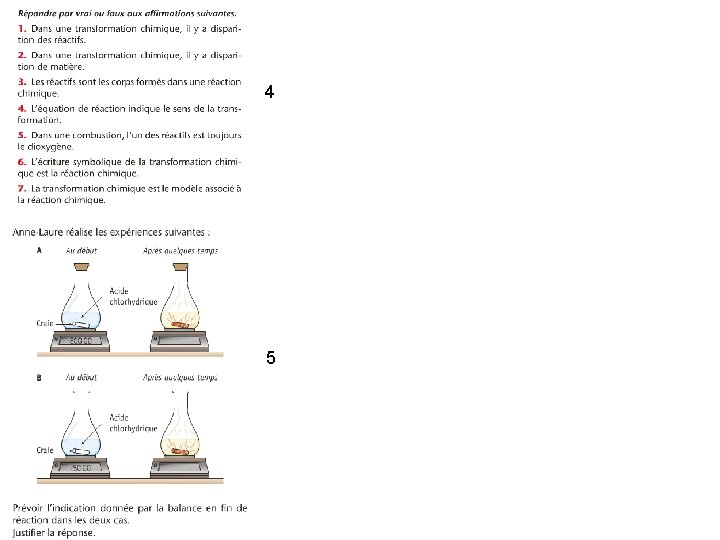
4 5

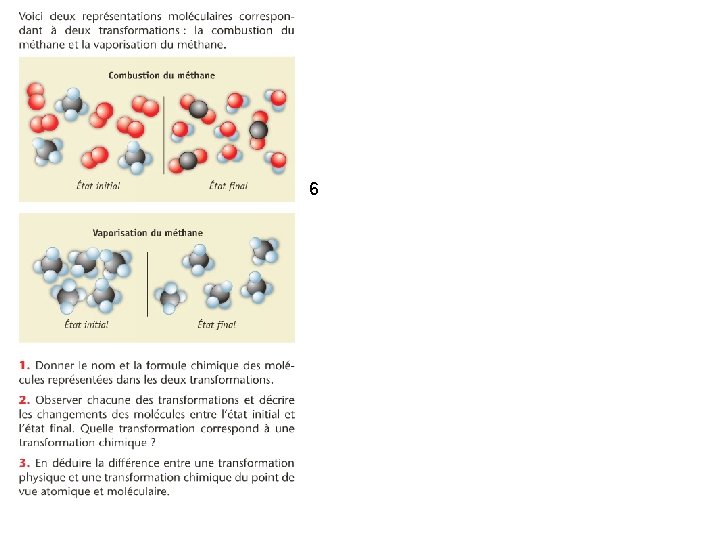
6

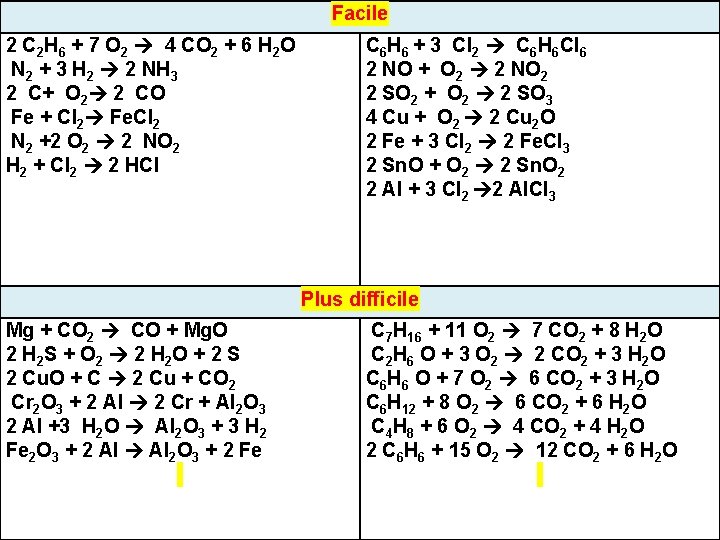
7 2 C 2 H 6 + 7 O 2 4 CO 2 + 6 H 2 O N 2 + 3 H 2 2 NH 3 2 C+ O 2 2 CO Fe + Cl 2 Fe. Cl 2 N 2 +2 O 2 2 NO 2 H 2 + Cl 2 2 HCl Facile C 6 H 6 + 3 Cl 2 C 6 H 6 Cl 6 2 NO + O 2 2 NO 2 2 SO 2 + O 2 2 SO 3 4 Cu + O 2 2 Cu 2 O 2 Fe + 3 Cl 2 2 Fe. Cl 3 2 Sn. O + O 2 2 Sn. O 2 2 Al + 3 Cl 2 2 Al. Cl 3 Plus difficile Mg + CO 2 CO + Mg. O 2 H 2 S + O 2 2 H 2 O + 2 S 2 Cu. O + C 2 Cu + CO 2 Cr 2 O 3 + 2 Al 2 Cr + Al 2 O 3 2 Al +3 H 2 O Al 2 O 3 + 3 H 2 Fe 2 O 3 + 2 Al 2 O 3 + 2 Fe C 7 H 16 + 11 O 2 7 CO 2 + 8 H 2 O C 2 H 6 O + 3 O 2 2 CO 2 + 3 H 2 O C 6 H 6 O + 7 O 2 6 CO 2 + 3 H 2 O C 6 H 12 + 8 O 2 6 CO 2 + 6 H 2 O C 4 H 8 + 6 O 2 4 CO 2 + 4 H 2 O 2 C 6 H 6 + 15 O 2 12 CO 2 + 6 H 2 O

9 8

Ex 14 p 70 : a) Réactifs : 3 C ; 8 H ; (5 x 2)= 10 O Produits : 3 C ; (3 x 2)+4= 10 O ; (4 x 2)= 8 H Þ Réaction équilibrée b) Réactifs : 2 H ; 2 O Produits : 2 H ; 1 O Þ Réaction non équilibrée H 2 + 02 → H 2 O H 2 + O 2 → 2 H 2 0 2 H 2 + O 2 → 2 H 2 O c) Réactifs : 1 C ; (1+2)= 3 O Produits : 2 C ; (2 x 2)= 4 O Réaction non équilibrée CO + O 2 → 2 CO 2 2 CO + O 2 → 2 CO 2

Ex 16 p 71 : a) C 4 H 10 + O 2→ CO 2 + H 2 O C 4 H 10 + O 2→ 4 CO 2 + 5 H 2 O C 4 H 10 + 6, 5 O 2→ 4 CO 2 + 5 H 2 O 2 C 4 H 10 + 13 O 2→ 8 CO 2 + 10 H 2 O b) C + O 2→ CO C + O 2→ 2 CO 2 C + O 2→ 2 CO c) C 5 H 12 + O 2→ CO 2 + H 2 O C 5 H 12 + O 2→ 5 CO 2 + 6 H 2 O C 5 H 12 + 8 O 2→ 5 CO 2 + 6 H 2 O

Ex 17 p 71 : 1. Chimiste britannique qui réalisa la synthèse de l’eau en 1783. 2. Dihydrogène : H 2 3. Equation de réaction : H 2 + O 2 → H 2 O H 2 + O 2 → 2 H 2 O 2 H 2 + O 2 → H 2 O

Ex 19 p 71 : 1. Réactifs : - dioxyde de carbone : CO 2 - eau : H 2 O 2. Produits : - glucose : C 6 H 12 O 6 - dioxygène : O 2 3. Equation de réaction : CO 2 + H 2 O → C 6 H 12 O 6 + O 2 6 CO 2 + 6 H 2 O → C 6 H 12 O 6 + 6 O 2

Ex 20 p 71 : 1. Réactifs : - alcool : C 2 H 6 O - dioxygène : O 2 2. Produits : - dioxyde de carbone : CO 2 - eau : H 2 O 3. Bilan littéral : alcool + dioxygène → dioxyde de carbone + eau 4. Equation de réaction : C 2 H 6 O + O 2 → CO 2 + H 2 O C 2 H 6 O + O 2 → 2 CO 2 + 3 H 2 O C 2 H 6 O + 3 O 2 → 2 CO 2 + 3 H 2 O

Equilibrer des réactions chimiques 1

Equilibrer des réactions chimiques 2

Equilibrer des réactions chimiques 3

Equilibrer des réactions chimiques 4

Vérifie si tu as vraiment tout bien compris encore une fois

En complément: Explication de la combustion du carbone

Réalise ces exercices intéractifs

Molécules et coefficients

Equilibrage réactions avec ballons

Un peu de tout 1

Un peu de tout 2

Molécules en 3 D avec lunettes