Achtung Die Vorlesung Anorganische Chemie II entfllt am




















- Slides: 25

Achtung: Die Vorlesung Anorganische Chemie II entfällt am Dienstag 18. Juni Prüfung: Donnerstag 27. Juni 9: 15 – 11: 15

Anorganische Reaktionsmechanismen in Lösungen Konturkarte der Energieflächen des linearen H + H 2 = H 2 + H Systems Quelle: Moore/Hummel Physikalische Chemie De Gruyter 1986 Sattelpunkt auf der Potentialhyperfläche

Literatur • Holleman Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage Walter de Gruyter (2007) • E. Riedel (Hrsg. ): Moderne Anorganische Chemie, 3. Auflage Walter de Gruyter (2007) • James H. Espenson: Chemical Kinetics and Reaction Mechanisms; Mc. Graw -Hill, Inc. , New York (1995) • Ralph G. Wilkins: Kinetics and mechanisms of reactions of transition metal complexes; 2. Auflage. VCH Verlagsgesellschaft, Weinheim, New York (1991) • James E. Huheey, Ellen A. Keiter, Richard L. Keiter: Anorganische Chemie, Prinzipien von Struktur und Reaktivität; Ralph Steudel Hrsg. 4. Auflage de Gruyter (2012)

Inhalte v. Temperaturabhängigkeit der Geschwindigkeitskonstante v. Zusammengesetzte Geschwindigkeitskonstanten v. Druckabhängigkeit der Geschwindigkeitskonstante, Aktivierungsvolumen v. Chemische Interpretation der Aktivierungsparameter v. Theorie des Übergangszustandes v. Energiediagramme v. Prinzip der mikroskopischen Reversibilität v. Spezielle Eigenschaften der Reaktionen in einem Lösungsmittel v. Diffusionskontrollierte Geschwindigkeitskonstanten v. Kinetik von Ionenreaktionen: a) Einfluss der Dielektrizitätskonstante des Lösungsmittels b) Einfluss gelöster Salze v. Kinetische Isotopie-Effekte v. Kinetik des Isotopenaustauschs

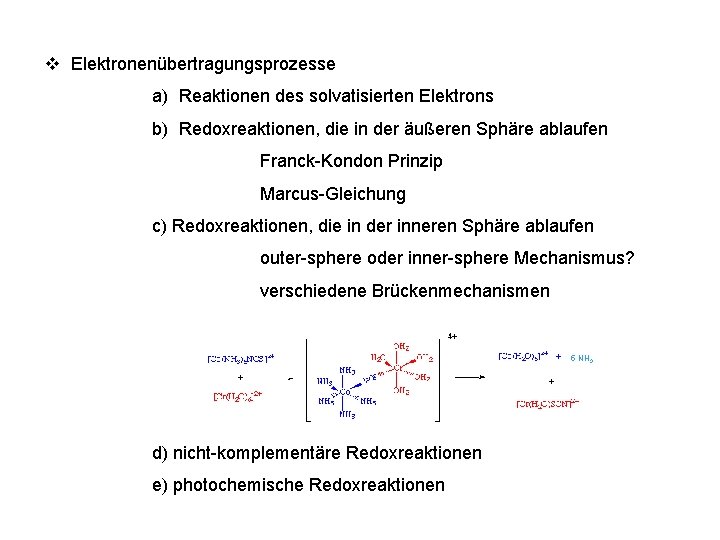
v Elektronenübertragungsprozesse a) Reaktionen des solvatisierten Elektrons b) Redoxreaktionen, die in der äußeren Sphäre ablaufen Franck-Kondon Prinzip Marcus-Gleichung c) Redoxreaktionen, die in der inneren Sphäre ablaufen outer-sphere oder inner-sphere Mechanismus? verschiedene Brückenmechanismen 5 NH 3 d) nicht-komplementäre Redoxreaktionen e) photochemische Redoxreaktionen

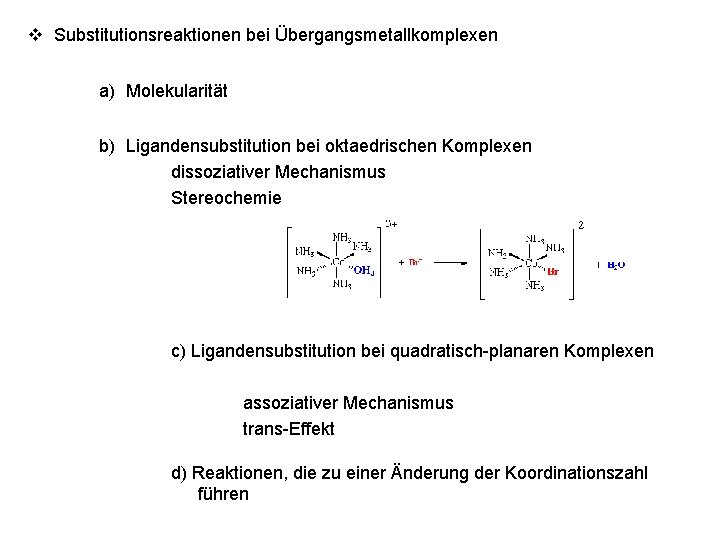
v Substitutionsreaktionen bei Übergangsmetallkomplexen a) Molekularität b) Ligandensubstitution bei oktaedrischen Komplexen dissoziativer Mechanismus Stereochemie c) Ligandensubstitution bei quadratisch-planaren Komplexen assoziativer Mechanismus trans-Effekt d) Reaktionen, die zu einer Änderung der Koordinationszahl führen

Chemie in wässrigen und nichtwässrigen Lösungen • Sehr viele Reaktionen, die der anorganische Chemiker im Labor beobachtet, finden in Lösung statt. • Wasser ist das wichtigste polare Lösungsmittel. • Unpolare organische Lösungsmittel wie Toluol oder Cyclohexan werden eingesetzt, um unpolare Verbindungen zu lösen. Diese beiden LM bilden keine Solvate und zeigen keine Eigendissoziation. • Gut koordinierende polare LM, die aber nicht dissoziieren, sind z. B. DMSO (Dimethylsulfoxid), oder Acetonitril. Es handelt sich dabei um Lewis-Basen, die sich an Kationen und andere Lewis-saure Zentren anlagern. Acetonitril wird oft als ersetzbarer Ligand verwendet.

Eigenschaften von LM • Schmelzpunkt und Siedepunkt grenzen den für chemische Reaktionen nutzbaren flüssigen Bereich ein. • Dielektrizitätskonstante ε. Die Coulomb‘sche Energie zwischen Ionen ist ε des Mediums umgekehrt proportional. • d. h. die Anziehungsenergie zwischen zwei Ionen in Wasser beträgt bei gleichem Abstand d nur 1, 22% der Anziehungsenergie im Vakuum. • Nur LM mit großer ε ermöglichen eine elektrolytische Dissoziation. In LM mit kleinen Dielektrizitätskonstanten gibt es nur „schwache Elektrolyte“.

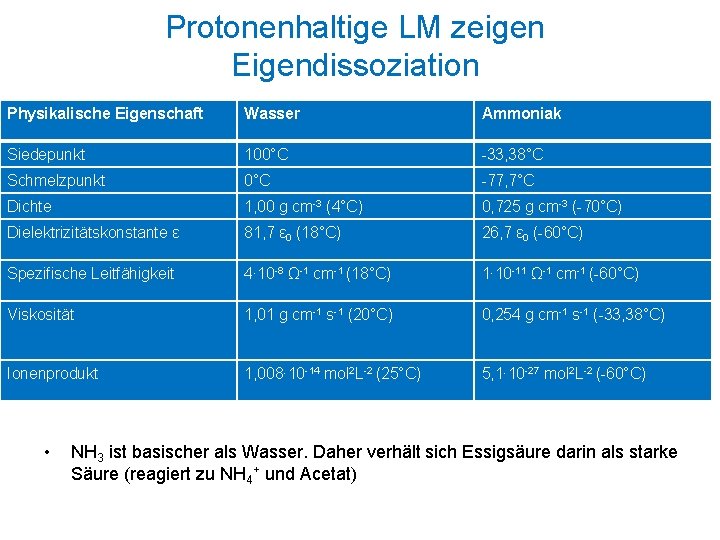
Protonenhaltige LM zeigen Eigendissoziation Physikalische Eigenschaft Wasser Ammoniak Siedepunkt 100°C -33, 38°C Schmelzpunkt 0°C -77, 7°C Dichte 1, 00 g cm-3 (4°C) 0, 725 g cm-3 (-70°C) Dielektrizitätskonstante ε 81, 7 ε 0 (18°C) 26, 7 ε 0 (-60°C) Spezifische Leitfähigkeit 4∙ 10 -8 Ω-1 cm-1 (18°C) 1∙ 10 -11 Ω-1 cm-1 (-60°C) Viskosität 1, 01 g cm-1 s-1 (20°C) 0, 254 g cm-1 s-1 (-33, 38°C) Ionenprodukt 1, 008∙ 10 -14 mol 2 L-2 (25°C) 5, 1∙ 10 -27 mol 2 L-2 (-60°C) • NH 3 ist basischer als Wasser. Daher verhält sich Essigsäure darin als starke Säure (reagiert zu NH 4+ und Acetat)

Salzschmelzen als Lösungsmittel • Sehr widerstandsfähig gegen Zersetzung bei hohen Temperaturen und anderen extremen Bedingungen. • Manche Reaktionen, die in Wasser nicht möglich sind, weil das Wasser mit-reagiert, lassen sich in Salzschmelzen ausführen, z. B. Reaktionen mit Chlor oder Fluor in geschmolzenen Chloriden bzw. Fluoriden. • Höhere Konzentrationen an koordinierenden Anionen, als in gesättigten wässrigen Lösungen erhalten werden können. • Beim Schmelzen des Salzes wird die Fernordnung des Kristalls zerstört, es bleibt jedoch eine Nahordnung weiter bestehen. • Lösungen von Metallen in Salzschmelzen möglich, z. B. lösen sich Alkalimetalle gut in geschmolzenen Alkalimetallhalogeniden.

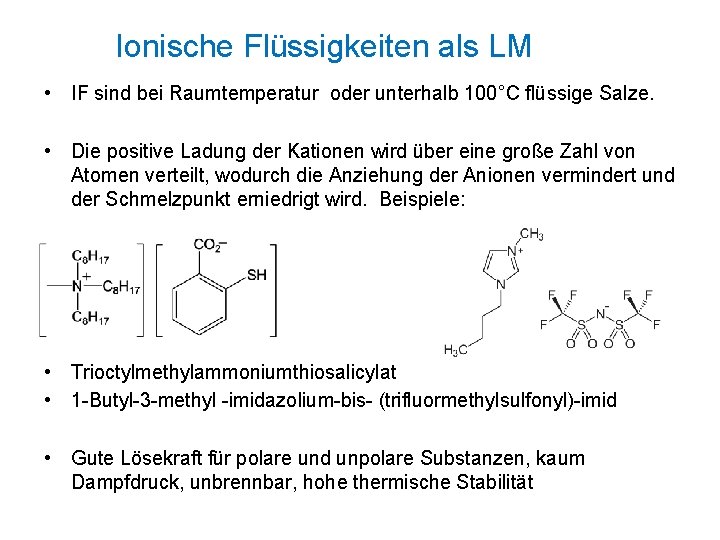
Ionische Flüssigkeiten als LM • IF sind bei Raumtemperatur oder unterhalb 100°C flüssige Salze. • Die positive Ladung der Kationen wird über eine große Zahl von Atomen verteilt, wodurch die Anziehung der Anionen vermindert und der Schmelzpunkt erniedrigt wird. Beispiele: • Trioctylmethylammoniumthiosalicylat • 1 -Butyl-3 -methyl -imidazolium-bis- (trifluormethylsulfonyl)-imid • Gute Lösekraft für polare und unpolare Substanzen, kaum Dampfdruck, unbrennbar, hohe thermische Stabilität

Das Studium von Reaktionsmechanismen - ermöglicht das Design von Synthesewegen zu neuen Verbindungen - ermöglicht die Entwicklung optimaler Katalysatoren

Reaktionen von Komplexverbindungen können extrem schnell oder sehr langsam sein d 3 In einer Femtosekunde legt das Licht eine Strecke von 0, 3 µm zurück. aus: William W. Porterfield, Inorganic Chemistry, San Diego, 1993

Anwendung von Femtosekundenlasern • • • Das „Arbeitspferd“ ist der Titan-Saphir-Laser, der im infraroten Bereich arbeitet. Mit Hilfe ultrakurzer Lichtpulse lassen sich Strukturänderungen der an der Reaktion beteiligten Moleküle analysieren und reaktive Zwischenverbindungen untersuchen. Besonders wichtig zur Aufklärung photochemischer Reaktionen z. B. Photosynthese, Atmosphärenchemie Quelle: Institut für Physik, Universität Kassel

Zerfall des Ionepaares Na+I- in der Gasphase in Atome 1 fs=10 -15 sec: diese Zeit benötigt eine chemische Bindung, um aufzubrechen Eine Molekülschwingung verändert den Bindungszustand. Gleichgewichtsabstand 0. 28 nm. Bei längeren Abständen ist die Bindung ionisch, bei kürzeren kovalent. Bei einem bestimmten kritischen Abstand entscheidet sich, ob das Molekül in die Atome zerfällt. Da Laser sehr kurze und intensive elektromagnetische Strahlungspulse emittieren können, sind sie zur Untersuchung von Vorgängen auf einer sehr kurzen Zeitskala geeignet. Quelle: Atkins/Jones: Chemie - einfach alles, Wiley-VCH 2006

Ein Reaktionsmechanismus beschreibt die aufeinanderfolgenden molekularen Vorgänge während einer chemischen Reaktion von den Reagenzien bis zu den Produkten. (Wir wollen sozusagen die Bewegungen der Atome während der Bildung und Umwandlung der Moleküle beobachten. ) Der Reaktionsmechanismus zeigt, ob eine gegebene chemische Reaktion als einzelner molekularer Prozess abläuft – als Elementarreaktion – oder als Aufeinanderfolge mehrerer Elementarreaktionen, und ob es dann nur einen einzigen Reaktionsweg gibt, oder mehrere im Wettbewerb befindliche Reaktionsfolgen vorliegen. Wenn mehrere Reaktionsschritte (=Elementarreaktionen) hintereinander stattfinden, treten in allen Fällen kurzlebige Zwischenverbindungen auf.

Man bemüht sich, Struktur und Zusammensetzung jeder vermuteten Zwischenverbindungen zu bestimmen. Eventuell durch sehr schnelle spektroskopische Techniken. In manchen Fällen gelingt es, ein Reagenz zu finden, das mit der kurzlebigen Zwischenverbindung zu einem stabilen Produkt reagiert (“chemical trapping“). Struktur und Zusammensetzung des „gefangenen“ Produkts lassen dann auf die Eigenschaften der Zwischenverbindung schließen. Eine weitere Möglichkeit, die Zwischenverbindung zu stabilisieren, ist “freeze trapping“ (sehr rasches Abschrecken auf tiefe Temperaturen). K. Moffat und R. Henderson

– „freeze trapping“ wird z. B. kombiniert mit – Röntgenstrukturanalyse, – EPR (electron paramagnetic resonance) Spektroskopie, – Elektronenmikroskopie – solid-state NMR – 57 Fe-Mössbauer-Spektroskopie (für Eisen enthaltende Moleküle), um die Zwischenverbindungen zu charakterisieren

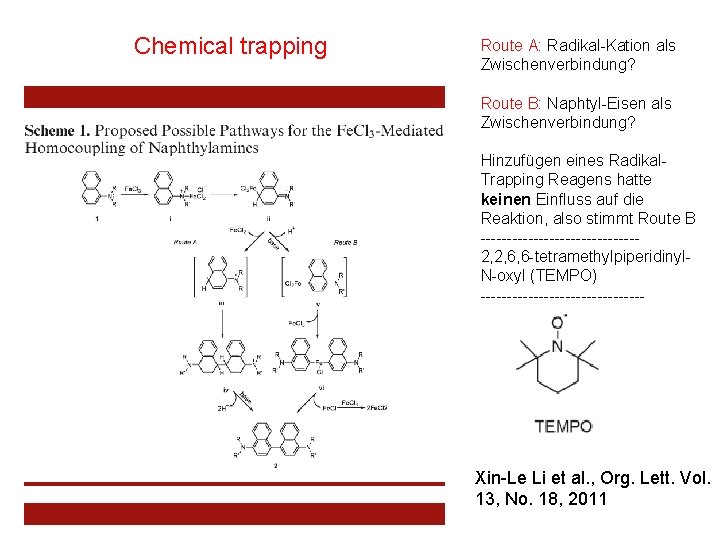
Chemical trapping Route A: Radikal-Kation als Zwischenverbindung? Route B: Naphtyl-Eisen als Zwischenverbindung? Hinzufügen eines Radikal. Trapping Reagens hatte keinen Einfluss auf die Reaktion, also stimmt Route B ---------------2, 2, 6, 6 -tetramethylpiperidinyl. N-oxyl (TEMPO) ---------------- Xin-Le Li et al. , Org. Lett. Vol. 13, No. 18, 2011

• An der experimentellen und theoretischen Erforschung von Reaktionsgeschwindigkeiten und Reaktionsmechanismen gewisser Typen von Reaktionen wird seit Jahrzehnten intensiv geforscht, die Erkenntnisse werden immer detaillierter. Besonders betrifft das: • Elektronentransfer-Reaktionen • Nucleophile Substitutionen, besonders Hydrolysereaktionen

Theoretische Modelle wurden entwickelt, die Reaktionsgeschwindigkeiten von Elementarreaktionen erklären oder sogar voraussagen können. Die Grundlage für diese theoretischen Modelle bildet die Abhängigkeit der Geschwindigkeitskonstante von Temperatur und Druck. Aus dieser experimentell zu bestimmenden Abhängigkeit lässt sich auf die Aktivierungsparameter schließen: Aktivierungsenthalpie, Aktivierungsentropie und Aktivierungsvolumen. Die Aktivierungsparameter lassen Schlüsse auf den Reaktionsmechanismus zu.

Jacobus Henricus Van‘t Hoff hat 1884 die Regel aufgestellt, dass sich bei Erhöhung der Temperatur um 10°C die Reaktionsgeschwindigkeit verdoppelt, ein Thema, für das sich Arrhenius sehr interessierte. Arrhenius verwendete für seine Ableitung die kinetische Ableitung des MWG, 1864, von Guldberg und Waage. Idee: Es gibt für die Hinreaktion und die Rückreaktion einen GEMEINSAMEN Zwischenzustand erhöhter Energie.

• Aktivierungsenergie Ea = Energie des aktivierten Zustands minus mittlere Energie der reagierenden Moleküle. • Ea ist daher immer >0

H 2 + I 2 = 2 HI Max Bodenstein (1871 -1942) Begründer chemischen Kinetik, Entdecker der Kettenreaktion Bodenstein hielt diese Reaktion zunächst für eine bimolekulare Elementarreaktion (Geschwindigkeitsgesetz 2. Ordnung )

H 2 + I 2 = 2 HI • Diese Reaktion wurde bereits 1894 von Max BODENSTEIN eingehend untersucht, er hielt sie zunächst für eine Elementarreaktion • doch handelt es sich nicht um eine bimolekulare Elementarreaktion, der Mechanismus ist in Wirklichkeit komplizierter.
 Achtung die folgenden bilder
Achtung die folgenden bilder Anorganische stoffen
Anorganische stoffen Sprinkaan en die mier
Sprinkaan en die mier De morgansche regel
De morgansche regel Risikotragfähigkeit
Risikotragfähigkeit Rechtsobjekt
Rechtsobjekt Hazardfehler
Hazardfehler Vorlesung finanzmathematik
Vorlesung finanzmathematik Refinanzierungsrisiko
Refinanzierungsrisiko Technische zeichnung
Technische zeichnung Vorlesung
Vorlesung Repurchase agreement (repo) und wertpapierleihe
Repurchase agreement (repo) und wertpapierleihe Jys die stem in die stilte wat agterbly
Jys die stem in die stilte wat agterbly Je höher die berge desto schöner die gams
Je höher die berge desto schöner die gams Pad van waarheid tot die lewe
Pad van waarheid tot die lewe Pad van waarheid tot die lewe
Pad van waarheid tot die lewe Rosen die ich an dich verschenke
Rosen die ich an dich verschenke Die hippies die
Die hippies die Korttermyn doelwitte voorbeelde
Korttermyn doelwitte voorbeelde Pad van waarheid en lewe
Pad van waarheid en lewe Lydende en bedrywende vorm graad 4
Lydende en bedrywende vorm graad 4 De druppel die de emmer doet overlopen
De druppel die de emmer doet overlopen Die einde van die koue oorlog 1989
Die einde van die koue oorlog 1989 Onderskikkende voegwoorde
Onderskikkende voegwoorde Die europäer verteilen die welt
Die europäer verteilen die welt Die kinder verbringen die ferien
Die kinder verbringen die ferien