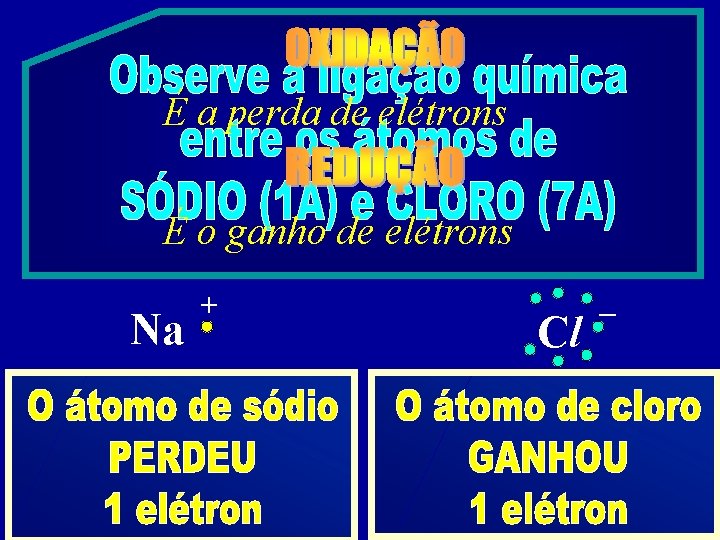
a perda de eltrons o ganho de eltrons
























- Slides: 35


É a perda de elétrons É o ganho de elétrons Na + Cl –

É o número que mede Nox = + 1 Nox = – 1 a carga real ou aparente de uma espécie química Na + Cl –

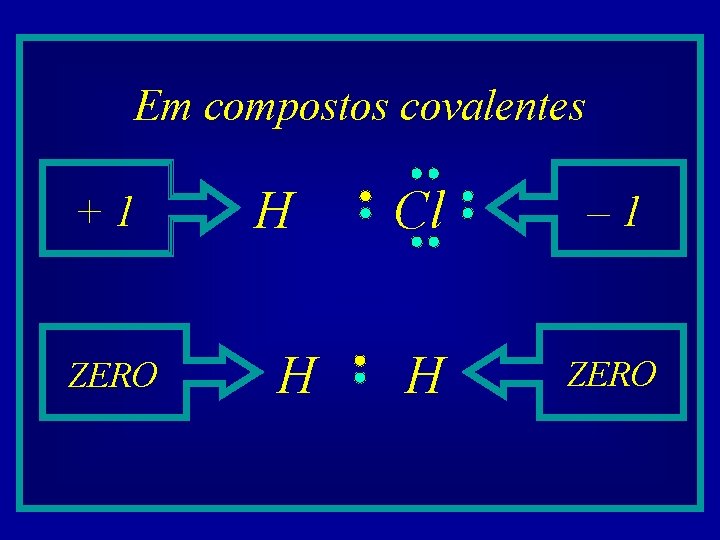
Em compostos covalentes +1 ZERO H H Cl – 1 H ZERO

É a perda de elétrons ou aumento do Nox É o ganho de elétrons ou diminuição do Nox

1ª REGRA Todo átomo em uma substância simples possui Nox igual a ZERO He H P 42 Nox = 0

2ª REGRA Alguns átomos em uma substância composta possui Nox CONSTANTE

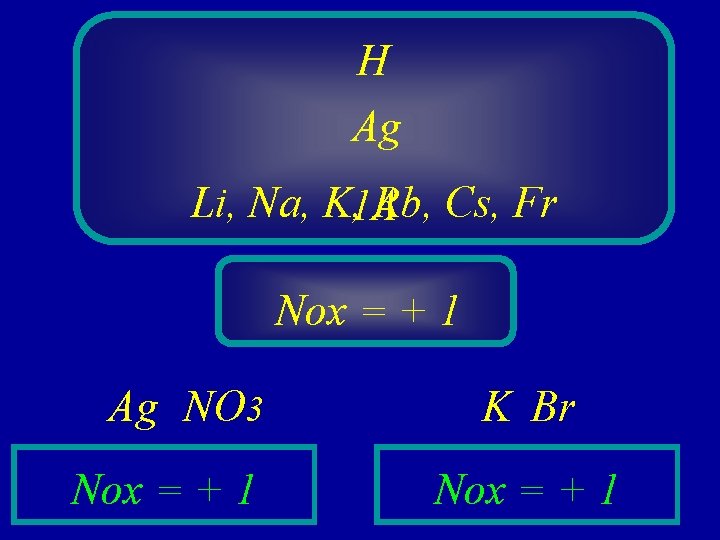
H Ag Li, Na, K, 1 A Rb, Cs, Fr Nox = + 1 Ag NO 3 Nox = + 1 K Br Nox = + 1

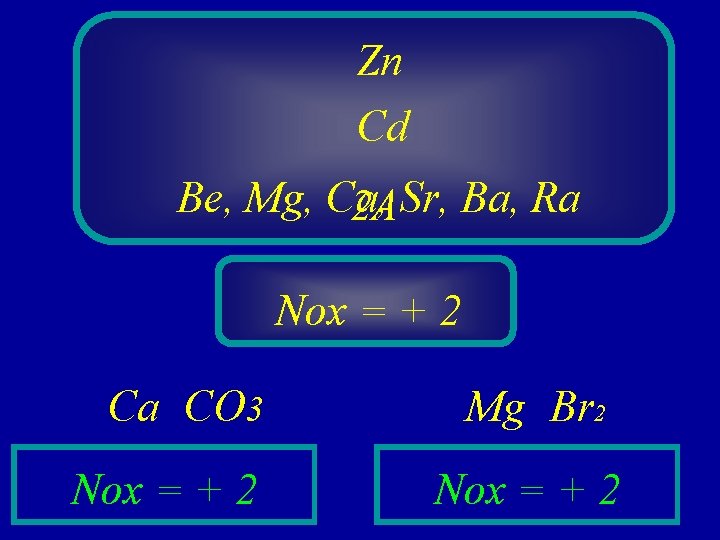
Zn Cd Be, Mg, Ca, 2 ASr, Ba, Ra Nox = + 2 Ca CO 3 Nox = + 2 Mg Br 2 Nox = + 2

Al Nox = + 3 Al 2 O 3 Al Br 3 Nox = + 3

calcogênios (O, S, Se, Te, Po) quando for o mais eletronegativo (no final da fórmula) Nox = – 2 Al 2 O 3 Nox = – 2 H 2 S Nox = – 2

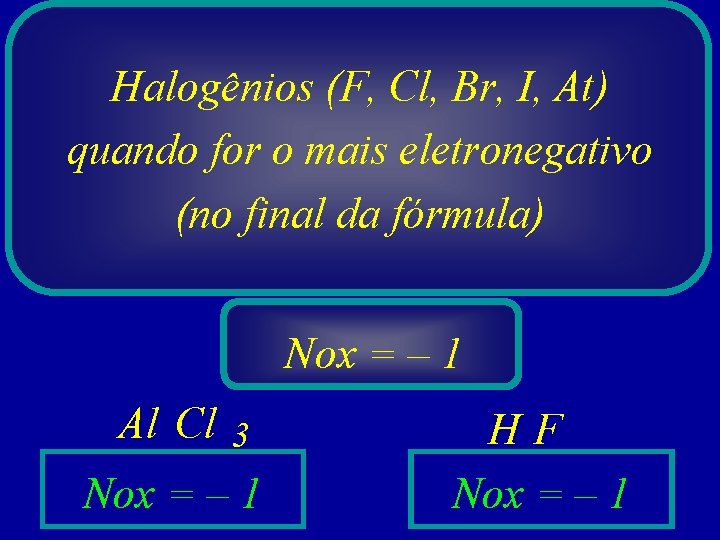
Halogênios (F, Cl, Br, I, At) quando for o mais eletronegativo (no final da fórmula) Nox = – 1 Al Cl 3 Nox = – 1 HF Nox = – 1

3ª REGRA A soma algébrica do Nox de todos os átomos em uma substância composta É igual a ZERO


Ba (+2) As O 2 2 7 x (– 2) 2. (+2) + 2. x + 7. (– 2) = 0 4 + 2. x – 14 = 0 10 = +5 2. x = 10 14 – 4 x = 2



4ª REGRA A soma algébrica do Nox de todos os átomos em um íon é igual à CARGA DO ÍON




01) (Vunesp) No mineral perovskita, de Ca. Ti. O 3, o número de oxidação do titânio é: a) + 4. b) + 2. c) + 1. d) – 1. e) – 2. +2 x – 2 Ca Ti O 3 2+x– 6=0 x=6– 2 x=+4

02) Nas espécies químicas Br. O 3 1– , Cl 2 e Hl, os halogênios têm números de oxidação, respectivamente, iguais a: a) – 5, zero e – 1. b) – 5, – 5 e – 1. c) – 1, – 5 e + 1. d) zero, zero e + 1. e) + 5, zero e – 1. x Br – 2 O 3 1– x– 6=– 1 x=6– 1 x=+5 Cl 2 HI Nox = zero Nox = – 1

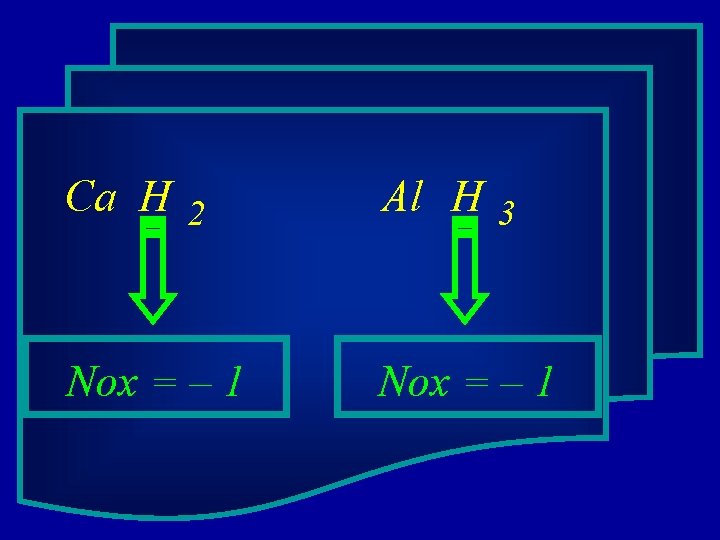
O hidrogênio nos hidretos metálicos tem Nox = - 1

Ca H 2 Al H 3 Nox = – 1

01) Nas espécies químicas Mg. H 2 e H 3 PO 4 o número de oxidação do hidrogênio é, respectivamente: a) + 1 e + 3. b) – 2 e + 3. c) – 1 e + 1. Nox = – 1 Nox = + 1 d) – 1 e – 1. e) – 2 e – 3. Mg. H 2 H 3 PO 4

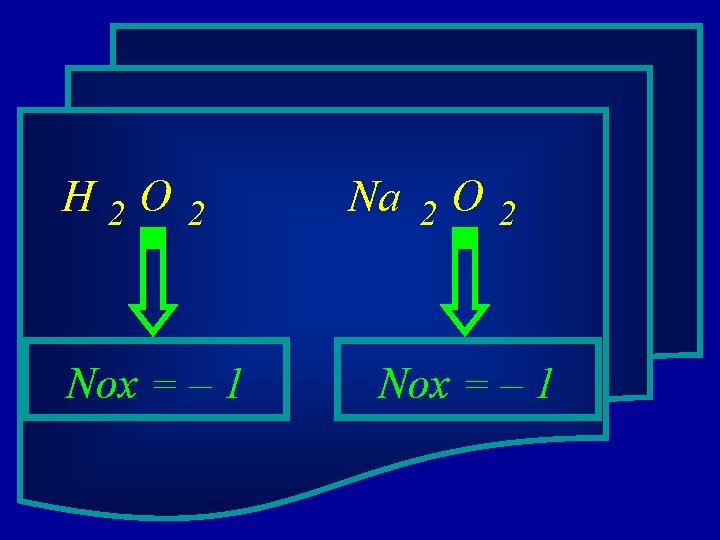
O oxigênio nos peróxidos tem Nox = - 1

H 2 O 2 Nox = – 1 Na 2 O 2 Nox = – 1

01) Nos compostos Ca. O e Na 2 O 2 o oxigênio tem número de oxidação, respectivamente, igual a: a) – 2 e – 2. Ca. O b) – 2 e – 1. Na 2 O 2 c) – 1 e – 1. d) – 2 e – 4. e) – 2 e + 1. Nox = – 2 Nox = – 1

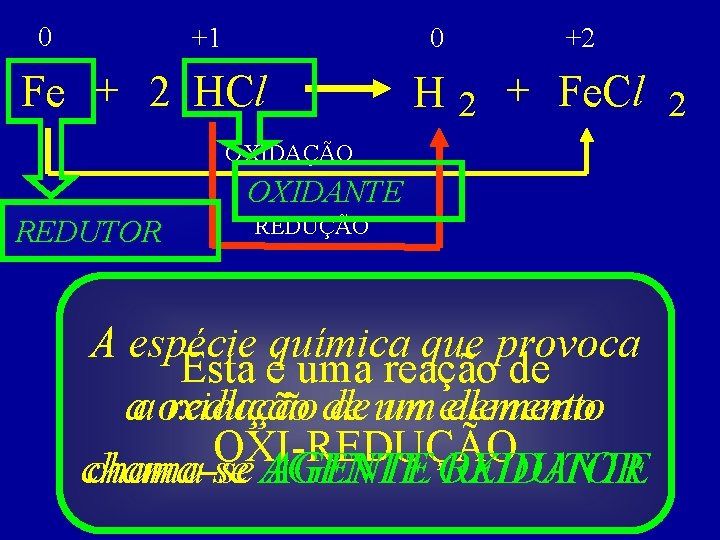
As reações que apresentam os fenômenos de OXIDAÇÃO e REDUÇÃO são denominadas de reações de óxido-redução (oxiredução ou redox).

0 +1 0 Fe + 2 HCl +2 H 2 + Fe. Cl 2 OXIDAÇÃO OXIDANTE REDUTOR REDUÇÃO A espécie química que provoca Esta é uma reação de aa oxidação redução de de um um elemento OXI-REDUÇÃO chama-se AGENTE OXIDANTE REDUTOR

01) Na equação representativa de uma reação de oxi-redução: 2+ Ni Ni + Cu 2+ 2+ + Cu a) O íon Cu é o oxidante porque ele é oxidado. 2+ b) O íon Cu é o redutor porque ele é reduzido. c) O Ni é redutor porque ele é oxidado. d) O Ni é o oxidante porque ele é oxidado e) O Ni é o oxidante e o íon Cu é o 2+ redutor.

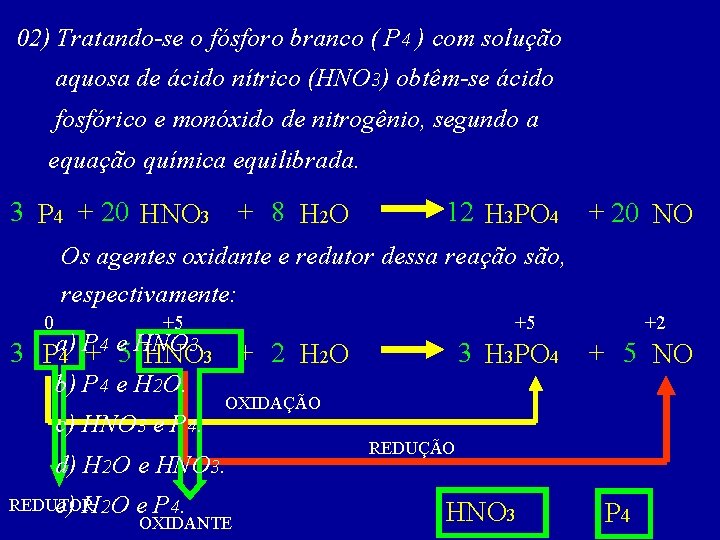
02) Tratando-se o fósforo branco ( P 4 ) com solução aquosa de ácido nítrico (HNO 3) obtêm-se ácido fosfórico e monóxido de nitrogênio, segundo a equação química equilibrada. 3 P 4 + 20 HNO 3 + 8 H 2 O 12 H 3 PO 4 + 20 NO Os agentes oxidante e redutor dessa reação são, respectivamente: 0 +5 +5 P 4 e HNO 3. 3 Pa) 4 + 5 HNO 3 + 2 H 2 O b) P 4 e H 2 O. c) HNO 3 e P 4. + 5 NO OXIDAÇÃO d) H 2 O e HNO 3. REDUTOR e) H 2 O 3 H 3 PO 4 +2 OXIDANTE REDUÇÃO HNO 3 P 4

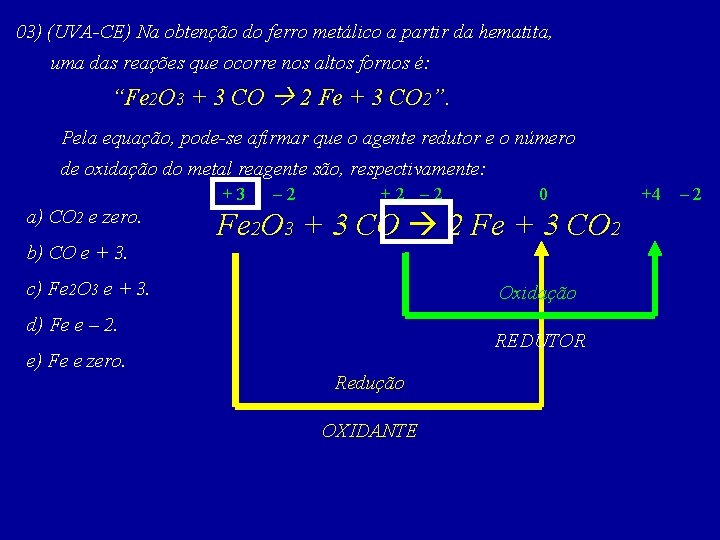
03) (UVA-CE) Na obtenção do ferro metálico a partir da hematita, uma das reações que ocorre nos altos fornos é: “Fe 2 O 3 + 3 CO 2 Fe + 3 CO 2”. Pela equação, pode-se afirmar que o agente redutor e o número de oxidação do metal reagente são, respectivamente: +3 a) CO 2 e zero. b) CO e + 3. – 2 +2 – 2 0 Fe 2 O 3 + 3 CO 2 Fe + 3 CO 2 c) Fe 2 O 3 e + 3. Oxidação d) Fe e – 2. REDUTOR e) Fe e zero. Redução OXIDANTE +4 – 2

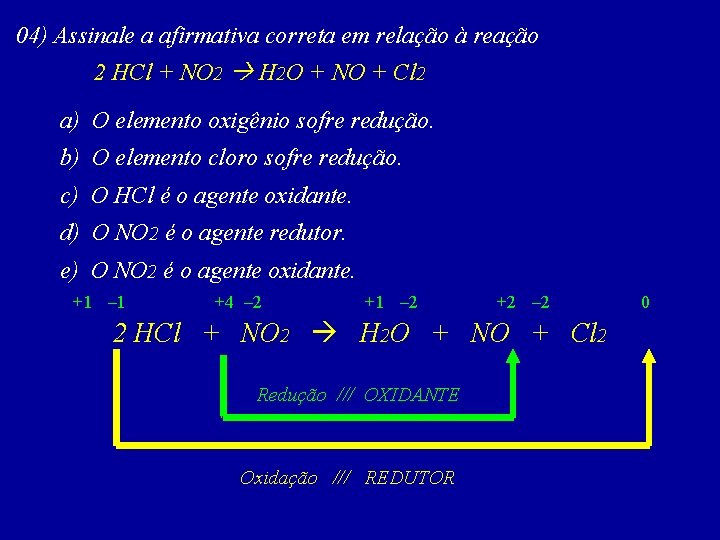
04) Assinale a afirmativa correta em relação à reação 2 HCl + NO 2 H 2 O + NO + Cl 2 a) O elemento oxigênio sofre redução. b) O elemento cloro sofre redução. c) O HCl é o agente oxidante. d) O NO 2 é o agente redutor. e) O NO 2 é o agente oxidante. +1 – 1 +4 – 2 +1 – 2 +2 – 2 2 HCl + NO 2 H 2 O + NO + Cl 2 Redução /// OXIDANTE Oxidação /// REDUTOR 0
 Eltrons
Eltrons Eltrons
Eltrons Perda no 4 tahun 2019
Perda no 4 tahun 2019 Dimensionamento agua fria
Dimensionamento agua fria Perda e suspensão da mediunidade
Perda e suspensão da mediunidade Equação de darcy
Equação de darcy Perda no. 8 tahun 2017 dki jakarta
Perda no. 8 tahun 2017 dki jakarta Tubo de pitot
Tubo de pitot Perda de carga distribuida
Perda de carga distribuida Perda de carga
Perda de carga Filtrao
Filtrao Te de passagem direta
Te de passagem direta Equação de darcy weisbach perda de carga
Equação de darcy weisbach perda de carga Equação de darcy
Equação de darcy Perda no 2 tahun 2008
Perda no 2 tahun 2008 Perda de carga localizada
Perda de carga localizada Equação de bernoulli para fluidos reais
Equação de bernoulli para fluidos reais






































