VETERNER SALIK RNLER DEERLENDRME TOPLANTISI 01 02 Nisan






















- Slides: 27

VETERİNER SAĞLIK ÜRÜNLERİ DEĞERLENDİRME TOPLANTISI 01 -02 Nisan 2017/Antalya

VETERİNER TIBBİ ÜRÜNLERDE YAPILACAK DEĞİŞİKLİK TİPLERİ VE GEREKLİLİKLERİ Dr. Erdim Ozan ÇAKIR Pendik VKE İlaç Kontrol Lab. Şefi Enstitü Müdür Yardımcısı

Veteriner Tıbbi Ürünlerde Yapılacak Değişiklik Tipleri ve Gereklilikleri Sunum Akışı Ø Veteriner Tıbbi Ürünlerde Yapılacak Değişiklik Tipleri Ø Veteriner Tıbbi Ürünlerde Yapılacak Değişiklikler (Varyasyon) kapsamları bakımından Ø Veteriner Tıbbi Ürünlerde Yapılacak Değişiklikleri tipleri bakımından, Ø Varyasyon dosya gereklikleri Ø Varyasyon Başvurularında sık yapılan hatalar Ø Ek-3 Formu Doldurulması Esnasında Karşılan Hata ve Eksiklikler

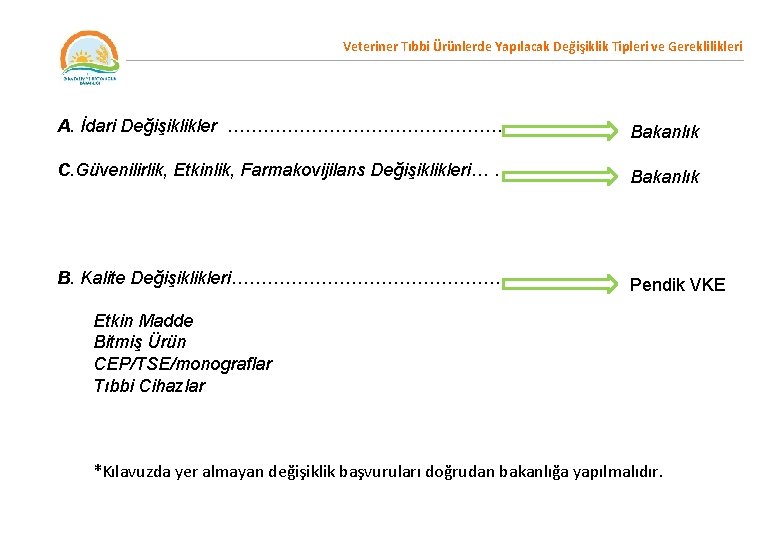
Veteriner Tıbbi Ürünlerde Yapılacak Değişiklik Tipleri ve Gereklilikleri Veteriner Tıbbi Ürünlerde Yapılacak Değişiklikler (Varyasyon) kapsamları bakımından, A. İdari Değişiklikler B. Kalite Değişiklikleri I. Etkin Madde II. Bitmiş Ürün III. CEP/TSE/monograflar IV. Tıbbi Cihazlar C. Güvenilirlik, Etkinlik, Farmakovijilans Değişiklikleri

Veteriner Tıbbi Ürünlerde Yapılacak Değişiklik Tipleri ve Gereklilikleri A. İdari Değişiklikler ………………………. . Bakanlık C. Güvenilirlik, Etkinlik, Farmakovijilans Değişiklikleri… ………. . Bakanlık B. Kalite Değişiklikleri………………………. Pendik VKE Etkin Madde Bitmiş Ürün CEP/TSE/monograflar Tıbbi Cihazlar *Kılavuzda yer almayan değişiklik başvuruları doğrudan bakanlığa yapılmalıdır.

Veteriner Tıbbi Ürünlerde Yapılacak Değişiklik Tipleri ve Gereklilikleri Veteriner Tıbbi Ürünlerde Yapılacak Değişiklikleri (Varyasyon) tipleri bakımından, Ø Tip IA küçük değişiklikler Ø Tip IB küçük değişiklikler Ø Tip II büyük değişiklikler

Veteriner Tıbbi Ürünlerde Yapılacak Değişiklik Tipleri ve Gereklilikleri Varyasyon Gereklilikleri Tip IA ve IB değişiklikler için uyulması gereken şartlar ve sağlanması gereken belgeler Avrupa Birliğinin 02. 08. 2013 tarihinde C 223 sayılı resmi gazetesinde değişiklik yapılarak yürürlüğe giren, akabinde bu değişikliğe paralel olarak güncellenen Veteriner Tıbbi Ürünlerde Yapılacak Değişikliklerle İlgili Kılavuzda net olarak belirtilmiştir* * Yayımlanma tarihi : Tamim no: 2013/23 tarih: 19. 12. 2013

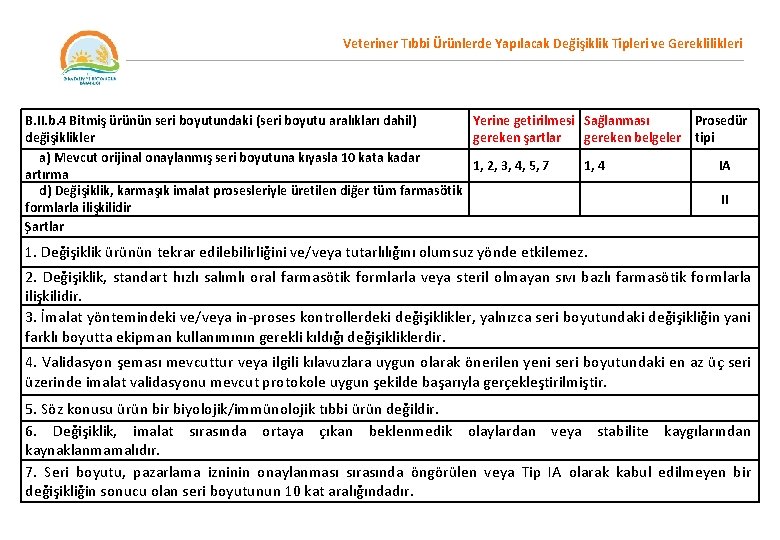
Veteriner Tıbbi Ürünlerde Yapılacak Değişiklik Tipleri ve Gereklilikleri B. II. b. 4 Bitmiş ürünün seri boyutundaki (seri boyutu aralıkları dahil) Yerine getirilmesi Sağlanması Prosedür değişiklikler gereken şartlar gereken belgeler tipi a) Mevcut orijinal onaylanmış seri boyutuna kıyasla 10 kata kadar 1, 2, 3, 4, 5, 7 1, 4 IA artırma d) Değişiklik, karmaşık imalat prosesleriyle üretilen diğer tüm farmasötik II formlarla ilişkilidir Şartlar 1. Değişiklik ürünün tekrar edilebilirliğini ve/veya tutarlılığını olumsuz yönde etkilemez. 2. Değişiklik, standart hızlı salımlı oral farmasötik formlarla veya steril olmayan sıvı bazlı farmasötik formlarla ilişkilidir. 3. İmalat yöntemindeki ve/veya in-proses kontrollerdeki değişiklikler, yalnızca seri boyutundaki değişikliğin yani farklı boyutta ekipman kullanımının gerekli kıldığı değişikliklerdir. 4. Validasyon şeması mevcuttur veya ilgili kılavuzlara uygun olarak önerilen yeni seri boyutundaki en az üç seri üzerinde imalat validasyonu mevcut protokole uygun şekilde başarıyla gerçekleştirilmiştir. 5. Söz konusu ürün bir biyolojik/immünolojik tıbbi ürün değildir. 6. Değişiklik, imalat sırasında ortaya çıkan beklenmedik olaylardan veya stabilite kaygılarından kaynaklanmamalıdır. 7. Seri boyutu, pazarlama izninin onaylanması sırasında öngörülen veya Tip IA olarak kabul edilmeyen bir değişikliğin sonucu olan seri boyutunun 10 kat aralığındadır.

Veteriner Tıbbi Ürünlerde Yapılacak Değişiklik Tipleri ve Gereklilikleri Belgeler 1. Dosyanın ilgili bölümündeki (bölümlerindeki) değişiklik. 2. Hem mevcut onaylanmış boyutlarda hem de önerilen proses boyutlarında imal edilmiş minimum bir üretim serisine ait seri analizi verileri (karşılaştırmalı tablo formatında). Talep üzerine sonraki iki tam üretim serisine ait seri verileri başvuru sahibi tarafından sunulmalı ve verilerin spesifikasyon dışında çıkması durumunda rapor edilmelidir (önerilen eylemle birlikte). 3. Onaylanan serbest bırakma ve raf ömrü sonu spesifikasyonlarının kopyası. 4. Validasyon çalışmasında kullanılan serilerin seri numaraları (en az 3 seri), karşılık gelen seri boyutu ve imalat tarihi belirtilmelidir veya validasyon protokolü (planı) sunulmalıdır. 5. Validasyon sonuçları sağlanmalıdır. 6. ICH/VICH koşulları altında ilgili stabilite parametreleri için en az bir pilot veya endüstriyel ölçekli seri üzerinde yürütülen ve minimum üç aylık bir dönemi kapsayan stabilite çalışmalarının sonuçlarıyla birlikte bu çalışmaların tamamlanacağına ve onaylanan raf ömrünün sonunda değerler spesifikasyonların dışındaysa veya potansiyel olarak spesifikasyonların dışında olabilecek durumdaysa verilerin (önerilen eylemle birlikte) derhal yetkili makamlara sunulacağına dair güvence verilir. Biyolojik/immünolojik ürünler için: karşılaştırılabilirlik değerlendirmesinin gerekli olmadığına dair beyan.

Veteriner Tıbbi Ürünlerde Yapılacak Değişiklik Tipleri ve Gereklilikleri Tip II değişikliklerde, Tip II değişiklikler için kılavuzda özel belgeler tanımlanmamıştır. Tip II değişikliklerde sunulacak bilgi, belge ve destekleyici dokümanlar, değişikliğin niteliğine göre farklılık arz edebilir. Guideline on stability testing for applications for variations to a marketing authorisation 21 March 2014 EMA/CHMP/CVMP/QWP/441071/2011 - Rev. 2 Committee for Medicinal Products for Human Use (CHMP)/ Committee for Medicinal Products for Veterinary Use (CVMP) Bu kılavuz, pazarlama izni kabulünden sonra yapılan değişikliklerin stabilite test gerekliliklerini tanımlar.

Veteriner Tıbbi Ürünlerde Yapılacak Değişiklik Tipleri ve Gereklilikleri GENEL GEREKLİLİKLER Bitmiş ürünler veya etkin maddeler için stabilite verisi gerektiren değişiklikler söz konusu olduğunda, gerekli stabilite çalışmaları, taahhüt edilen pilot şarjda dahil, her zaman kabul edilmiş raf ömrü/re-test tarihine kadar devam etmeli ve stabilite ilgili depolamada yaşanan her türlü sorun anında Bakanlığa bildirilmelidir. (ör: Spesifikasyon dışı ya da spesifikasyon dışına çıkma potansiyeli).

Veteriner Tıbbi Ürünlerde Yapılacak Değişiklik Tipleri ve Gereklilikleri ÖZEL GEREKLİLİKLER Tip II değişiklikler de , değişikliğin vasfına göre , dosya hazırlama kılavuzunun ilgili bölümü/bölümlerinde istenen bilgi ve belgeler eklenmelidir. Örn; B. II. e. 1 Bitmiş ürün iç ambalajındaki değişiklikler a-Kalitatif ve kantitatif bileşimi 3 - Steril Tıbbi ürünler ve biyolojik /immunolojik tıbbi ürünler (Tip II)

Veteriner Tıbbi Ürünlerde Yapılacak Değişiklik Tipleri ve Gereklilikleri Ø 2 ticari seri boyutunda PV protokolü ve bu serilere ait stabilite verileri (6 aylık hızlandırılmış stabilite verileri) ØRaf ömrü stabilite taahhütü ØDosya hazırlama kılavuzunun Bölüm 2 de başlangıç malzemeleri bölümünde istenen belgeler ØDosyanın ilgili yerlerindeki değişiklikler (Etiket ve prospektüs bilgileri vb)

Veteriner Tıbbi Ürünlerde Yapılacak Değişiklik Tipleri ve Gereklilikleri Sıklıkla yapılan Tip II varyasyonlar B. II. b. 4. Bitmiş ürünün seri boyutundaki (seri boyutu aralıkları dahil) değişiklikler: d) Değişiklik, karmaşık imalat prosesleriyle üretilen diğer tüm farmasötik formlarla ilişkilidir. B. II. a. 3 Bitmiş ürünün bileşimindeki (yardımcı maddeler) değişiklikler b) Diğer yardımcı maddeler 2. Tıbbi ürünün güvenilirliğini, kalitesi veya etkinliği üzerinde ciddi etki yaratabilecek bir veya birden çok yardımcı maddedeki kalitatif veya kantitatif değişiklikler B. II. d. 1 Bitmiş ürünün spesifikasyon parametrelerindeki ve/ veya parametrelerin limitlerindeki değişiklikler e) Onaylanan spesifikasyon limitleri aralığı dışındaki değişiklikler

Veteriner Tıbbi Ürünlerde Yapılacak Değişiklik Tipleri ve Gereklilikleri B. II. e. 1 Bitmiş ürünün iç ambalajındaki değişiklikler # a) Kalitatif ve kantitatif bileşimi 3. Steril tıbbi ürünler ve biyolojik/ immunolojik tıbbi ürünler B. II. e. 5 Bitmiş ürün ambalaj boyutundaki değişiklikler# c) Steril çok dozlu (veya tek dozlu, kısmi kullanıma yönelik) parenteral tıbbi ürünlerin ve biyolojik/immünolojik çok dozlu parenteral tıbbi ürünlerin dolum ağırlığı/dolum hacmindeki değişiklikler

Varyasyon Başvurularında Sıklıkla Yapılan Hatalar

Varyasyon Başvurularında Sıklıkla Yapılan Hatalar BAŞVURU DOSYASINDAKİ YAPISAL HATALAR • Dilekçe ve EK-3 belgesinin fiziksel kopyası bulunmaması • Dosyadaki diğer belgelerin çıktılarının tümü ile gönderilmesi • Pazarlama İzin Belgesi değişliği gerektiren varyasyonlarda Pazarlama İzin Belgesinin sunulmaması* • Belgeleri içeren CD ‘nin tek olarak gönderilmesi Sonuç olarak; Varyasyon dosyaları 2 dosya ve 2 cd olarak gönderilmelidir.

Varyasyon Başvurularında Sıklıkla Yapılan Hatalar Ek-3 Formu Doldurulması Esnasında Karşılan Hata ve Eksiklikler 2 - DEĞİŞİKLİĞİN (DEĞİŞİKLİKLERİN) TİPİ (TİPLERİ) a) Başvurunun kapsamına giren değişiklik(ler); Formun bu kısmında talep edilen değişikliğin kılavuzdaki numarasının ve tipinin belirtilmemesi ya da yanlış belirtilmesi b) Değişikliğin tam amacı, sebebi, gruplandırmanın gerekçesi, varsa öngörülmeyen değişikliklerin sınıflandırılması Açıklamanın çok kısa ve dar kapsamlı yapılması c) Değişikliğe (değişikliklere) ilişkin mevcut ve önerilen durum karşılaştırması Önerilen durumun kapalı ifade edilmesi

Varyasyon Başvurularında Sıklıkla Yapılan Hatalar • Dosyada sunulması gerekli belgelerin ilgili madde sırasında değil de karışık olarak sunulması • Üretim yeri değişikliği ile birlikte yapılan değişikliklerin belirtilmemesi Ø Şarj boyu değişiklikleri Ø Ambalaj boyutlarının silinmesi Ø Yardımcı maddeler açısından bitmiş ürünün kantitatif bileşimindeki tüm küçük ayarlamalar Ø Spesifikasyon ekleme (spesifikasyona ilgili test yöntemi ile birlikte yeni bir spesifikasyon parametresinin eklenmesi)

Varyasyon Başvuruları Varyasyonlarla ilgili sorular • Güncelleme öncesi mutlaka yapılması gereken varyasyonlar nelerdir? Pazarlama izin dosyası güncellenmesi öncesinde tüm varyasyon tamamlanmış olması gerekir. • Tüm varyasyon tiplerinde bakanlığa bildirimde bulunmak gerekli mi? Evet • Tüm varyasyon tiplerinde dosyaların incelenmesi ne kadar sürüyor? Dosya yoğunluğuna bağlı olarak 1 ila 4 hafta

Varyasyon Başvuruları Varyasyonlarla ilgili sorular • Aynı üründe testlere yönelik 2 tane tip 1 a bir tane de tip II değişiklik yapacağım. Ayrı ayrı ücretini mi yatırmam gerekir? Tek gruplandırılmışa sokabilir miyim? Örn bu ürün steril enjeksiyonluk ürün ve ruhsatta sadece tip 2 20 - 50 ml flakon ambalajları var. 100 ml tip 2 flakonda ekleyeceğim. Yani Tip II varyasyon yapmam gerekiyor. Ben tamamını gruplandırılmışa sokup tip II varyasyon ücreti yatırarak çözebiliyor muyum? • Hayır, varyasyon kılavuzu varyasyon ücretleri ilgili madde bazlıdır. örneğin B. II. d. 1 Bir bitmiş ürünün spesifikasyon parametrelerindeki ve/veya parametrelerin limitlerindeki değişikler c) Spesifikasyona ilgili test yöntemiyle birlikte yeni bir spesifikasyon parametresinin eklenmesi tip IA Bu madde altında tek Tip IA ücreti ile birçok spesifasyon parametresi değişebilir.

Varyasyon Başvuruları Varyasyonlarla ilgili sorular • Ambalajı ruhsatta 20 ve 50 ml tip 2 cam flakon olarak verilen bir steril enjeksiyonluk ürün için 100 ml aynı spesifikasyonda flakon ekleyeceğim. Yani Daha büyük ambalaj hacmi olan flakon eklenecek. Ambalaj materyali EP’de tanımlanmış tip 2 flakon. Primer ambalajın boyutları dışında spesifikasyonları değişmeyecek. • B. II. e. 1’içine mi, B. II. e. 4 içine yoksa B. II. e. 5 mi girmeli.

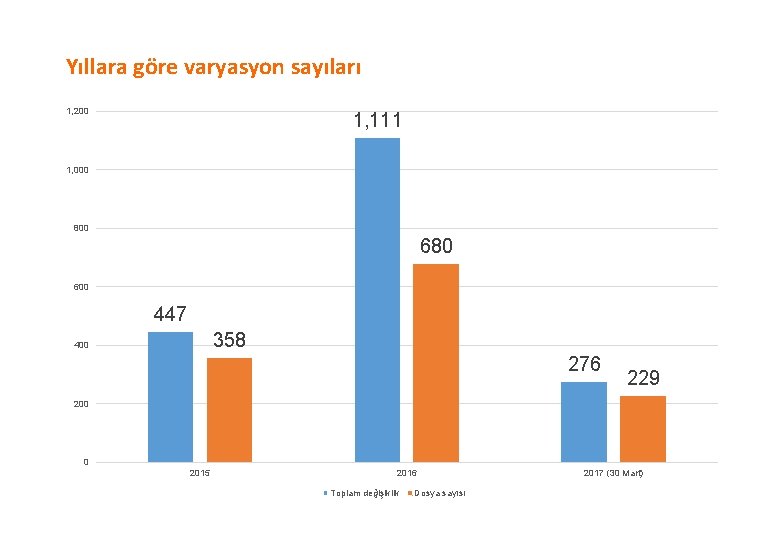
Yıllara göre varyasyon sayıları 1, 200 1, 111 1, 000 800 680 600 447 358 400 276 229 200 0 2015 2016 Toplam değişiklik Dosya sayısı 2017 (30 Mart)

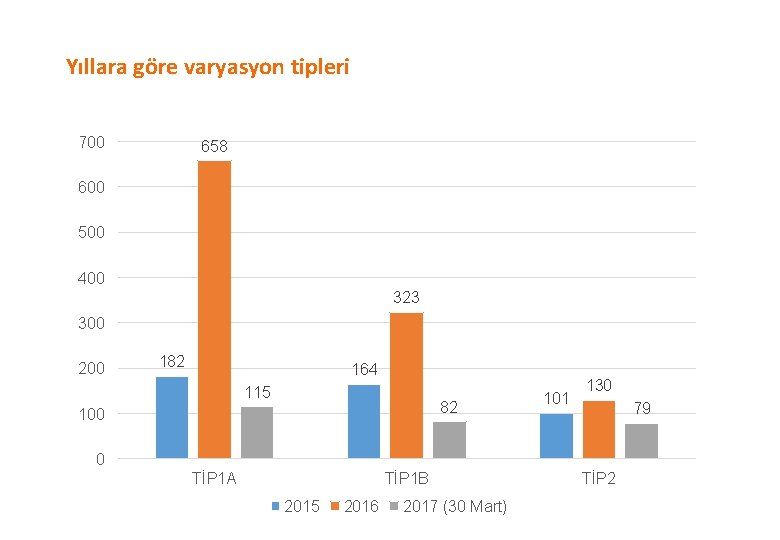
Yıllara göre varyasyon tipleri 700 658 600 500 400 323 300 200 182 164 115 82 100 101 130 79 0 TİP 1 A TİP 1 B 2015 2016 2017 (30 Mart) TİP 2

Varyasyon Başvurularında Sıklıkla Yapılan Hatalar http: //www. tarim. gov. tr/GKGM/Belgeler/Veteriner%20 Hizmetleri/varyasyon_kilavuz. zip http: //www. ema. europa. eu/docs/en_GB/document_library/Scientific_guideline/2014/ 04/WC 500164972. pdf

Varyasyon Başvurularında Sıklıkla Yapılan Hatalar

TEŞEKKÜRLER www. gsb. gov. tr
 Rnler
Rnler Bep toplantı örneği
Bep toplantı örneği Eğitsel performans örneği lise
Eğitsel performans örneği lise Veterner
Veterner Veterner
Veterner Nasyonalismo kahulugan
Nasyonalismo kahulugan Temple isle
Temple isle Salık ver
Salık ver Salik sa paglaki ng populasyon
Salik sa paglaki ng populasyon Sağlık kurumlarında karar verme yöntemleri
Sağlık kurumlarında karar verme yöntemleri Pagkakampihan ng mga bansa
Pagkakampihan ng mga bansa Patuxent valley middle school staff
Patuxent valley middle school staff Salik bakanli numarasi
Salik bakanli numarasi Salik verme
Salik verme Mga salik sa pag unlad ng nasyonalismo sa myanmar
Mga salik sa pag unlad ng nasyonalismo sa myanmar Salik ádám
Salik ádám Salık ver
Salık ver Michael nisan
Michael nisan Abib nisan
Abib nisan Nisan langberg
Nisan langberg 20 nisan 571
20 nisan 571 Kutl amare
Kutl amare Bentuk karya sastra yang menggunakan kata-kata yang indah
Bentuk karya sastra yang menggunakan kata-kata yang indah Faktor pendorong terjadinya urbanisasi adalah
Faktor pendorong terjadinya urbanisasi adalah Kurisinte pukazha
Kurisinte pukazha














































