Universidad Centroccidental Lisandro Alvarado Decanato de Agronoma Programa














- Slides: 24

Universidad Centroccidental “Lisandro Alvarado” Decanato de Agronomía Programa de Ingeniería Agroindustrial Unidad II: Principios del Análisis Gravimétrico Química Analítica Instrumental

Formación de Precipitados ¿ Que es un precipitado ? Es un compuesto o complejo sólido insoluble o muy poco soluble, formado por la fuerte atracción entre aniones y cationes en el seno de una solución, que una vez unidos se separan de las misma, formando así una solución heterogénea A+n B−m Am. Bn (s) m. A+n + n. B−m Am. Bn (s)

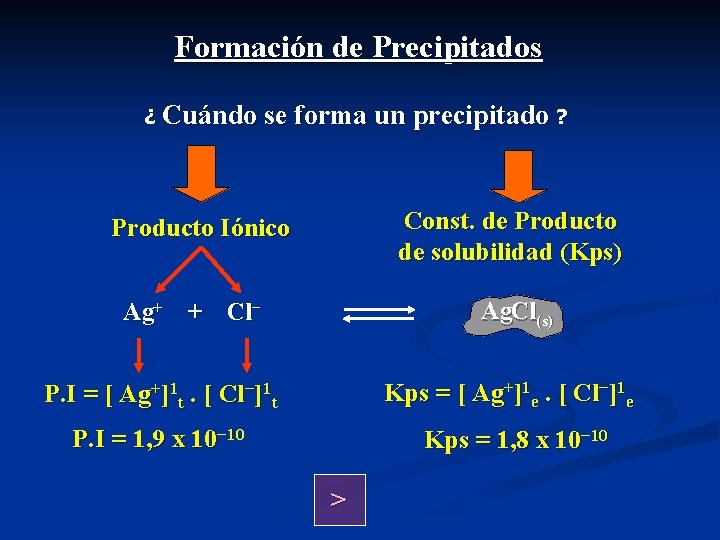
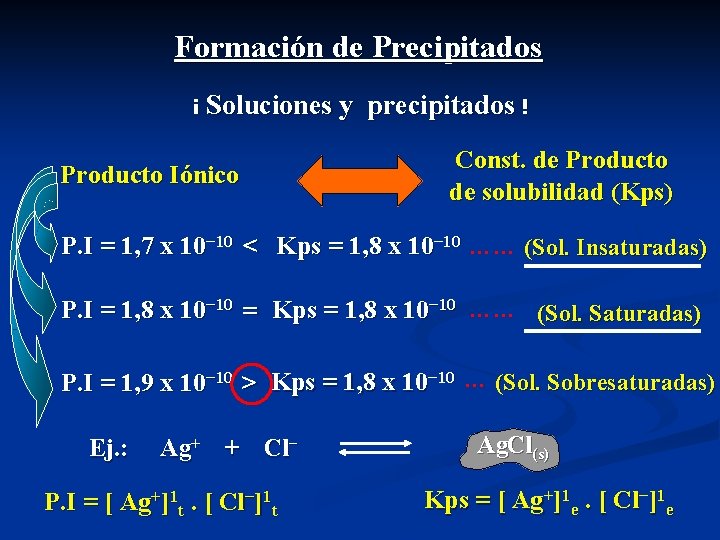
Formación de Precipitados ¿ Cuándo se forma un precipitado ? Producto Iónico Es el producto de las [ ]t de los iones que constituyen a el precipitado en un instante (t) fuera del equilibrio, elevadas éstas a sus respectivos coeficientes estequiométricos: Ag+ + Cl− Ag. Cl(s) P. I = [ Ag+]1 t. [ Cl−]1 t Const. de Producto de solubilidad (Kps) Es el producto de las [ ]e en el equilibrio de los iones que constituyen a el precipitado, elevadas éstas a sus respectivos coeficientes estequiométricos: Ag+ + Cl− Ag. Cl(s) Kps = [ Ag+]1 e. [ Cl−]1 e

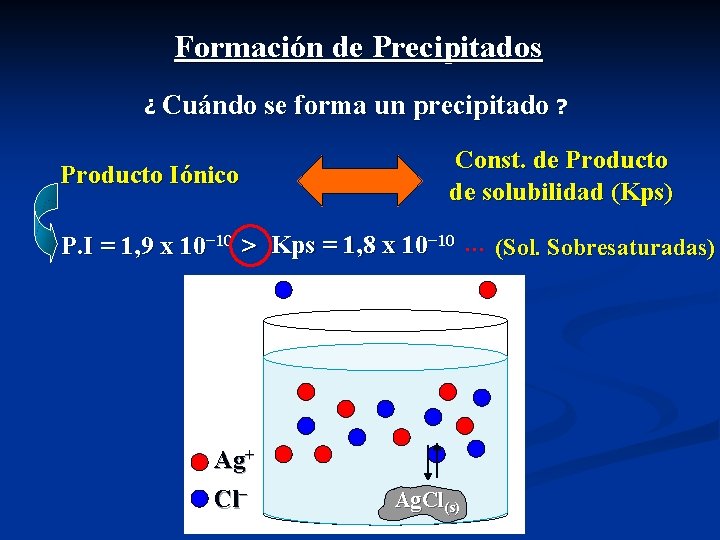
Formación de Precipitados ¿ Cuándo se forma un precipitado ? Const. de Producto de solubilidad (Kps) Producto Iónico Ag. Cl(s) Ag+ + Cl− P. I = [ Ag+]1 t. [ Cl−]1 t Kps = [ Ag+]1 e. [ Cl−]1 e P. I = 1, 9 x 10− 10 Kps = 1, 8 x 10− 10 >

Formación de Precipitados ¡ Soluciones y Producto Iónico precipitados ! Const. de Producto de solubilidad (Kps) P. I = 1, 7 x 10− 10 < Kps = 1, 8 x 10− 10 …… (Sol. Insaturadas) P. I = 1, 8 x 10− 10 = Kps = 1, 8 x 10− 10 …… (Sol. Saturadas) P. I = 1, 9 x 10− 10 > Kps = 1, 8 x 10− 10 … (Sol. Sobresaturadas) Ej. : Ag+ + Cl− P. I = [ Ag+]1 t. [ Cl−]1 t Ag. Cl(s) Kps = [ Ag+]1 e. [ Cl−]1 e

Formación de Precipitados ¿ Cuándo se forma un precipitado ? Producto Iónico Const. de Producto de solubilidad (Kps) P. I = 1, 9 x 10− 10 > Kps = 1, 8 x 10− 10 … (Sol. Sobresaturadas) Ag+ Cl− Ag. Cl(s)

Formación de Precipitados ¿ Cómo se forma un precipitado ? Nucleación Procesos Fundamentales Consiste en la unión de pocos iones, átomos o moléculas para formar u sólido estable llamado núcleo. Algunas veces esto ocurre sobre la superficie de contaminantes sólidos. n. A+ + n. B− (AB)n Crecimiento de Partículas Competencia Crecerán los núcleos ya Se formaran nuevos existentes, y obtendremos núcleos y se obtendrá una “suspensión cristalina” “suspensión coloidal” que precipitará A+ + B− + (AB)n+1

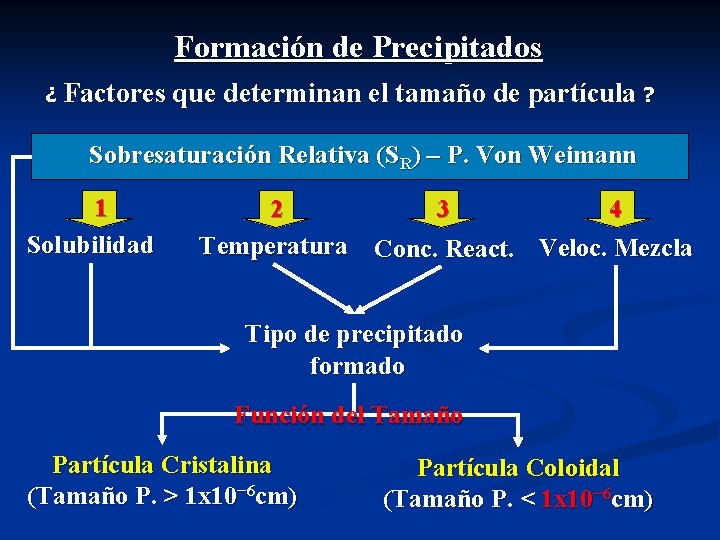
Formación de Precipitados ¿ Factores que determinan el tamaño de partícula ? Nucleación Procesos Fundamentales Crecimiento de Partículas Propiedad físico-química Sobresaturación Relativa (SR) Q, concentración de soluto en un momento dado. SR = Q − S S SR es grande S, solubilidad del soluto en el equilibrio. Q − S, sobresaturación de la sol. en el momento en que ocurre la precipitación. SR es pequeña

Formación de Precipitados ¿ Factores que determinan el tamaño de partícula ? Sobresaturación Relativa (SR) – P. Von Weimann 1 Solubilidad 2 4 3 Temperatura Conc. React. Veloc. Mezcla Tipo de precipitado formado Función del Tamaño Partícula Cristalina (Tamaño P. > 1 x 10− 6 cm) Partícula Coloidal (Tamaño P. < 1 x 10− 6 cm)

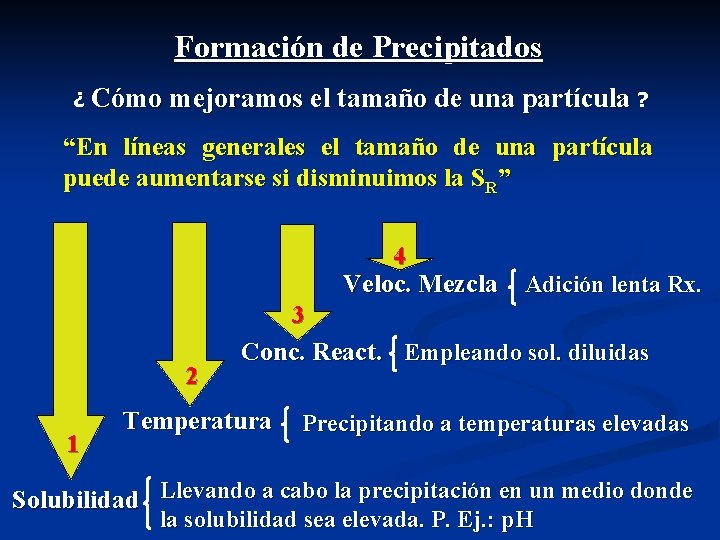
Formación de Precipitados ¿ Cómo mejoramos el tamaño de una partícula ? “En líneas generales el tamaño de una partícula puede aumentarse si disminuimos la SR” 4 Veloc. Mezcla Adición lenta Rx. 2 1 3 Conc. React. Empleando sol. diluidas Temperatura Precipitando a temperaturas elevadas Solubilidad Llevando a cabo la precipitación en un medio donde la solubilidad sea elevada. P. Ej. : p. H

Características de los precipitados Precipitados Cristalinos Los precipitados cristalinos están constituidos por partículas que poseen diametros superiores a 1 x 10− 6 cm. , y se forman por lo general a partir de compuestos con elevada solubilidad (elevado valor de Kps). Estas partículas cristalinas se caracterizan por tener un área de superficie específica pequeña (menor que las partículas coloidales). Los precipitados cristalinos se filtran y purifican más fácilmente que los precipitados coloidales.

Características de los precipitados Precipitados Coloidales Los precipitados coloidales están constituidos por partículas que poseen diametros inferiores a 1 x 10− 6 cm. , y se forman por lo general a partir de compuestos con baja solubilidad (bajo valor de Kps). Estas partículas coloidales “coaguladas” se caracterizan por tener un área de superficie específica muy grande (mayor que las partículas cristalinas). Poseen una densidad menor que los sólidos cristalinos, son de apariencia amorfa y de naturaleza porosa. Los precipitados coloidales presentan gran dificultad para su filtración y purifican.

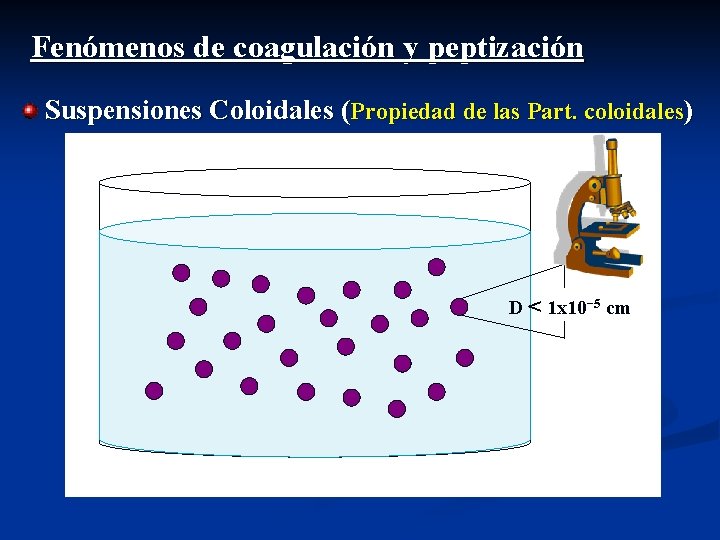
Fenómenos de coagulación y peptización Suspensiones Coloidales (Propiedad de las Part. coloidales) D < 1 x 10− 5 cm

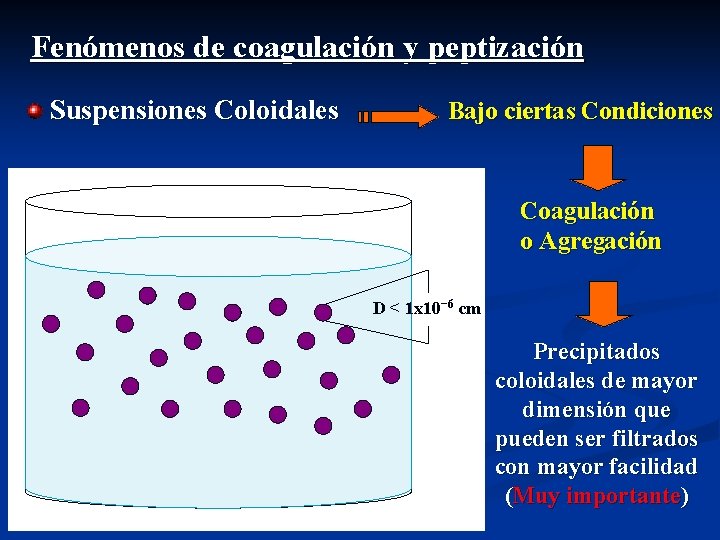
Fenómenos de coagulación y peptización Suspensiones Coloidales Bajo ciertas Condiciones Coagulación o Agregación D < 1 x 10− 6 cm Precipitados coloidales de mayor dimensión que pueden ser filtrados con mayor facilidad (Muy importante)

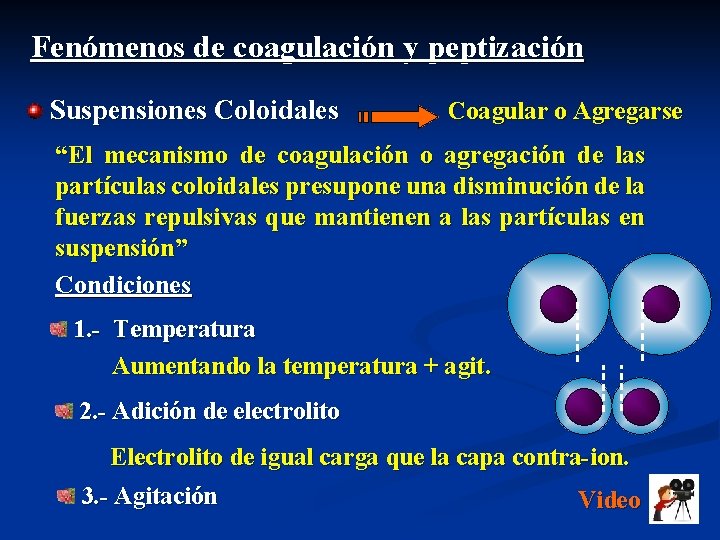
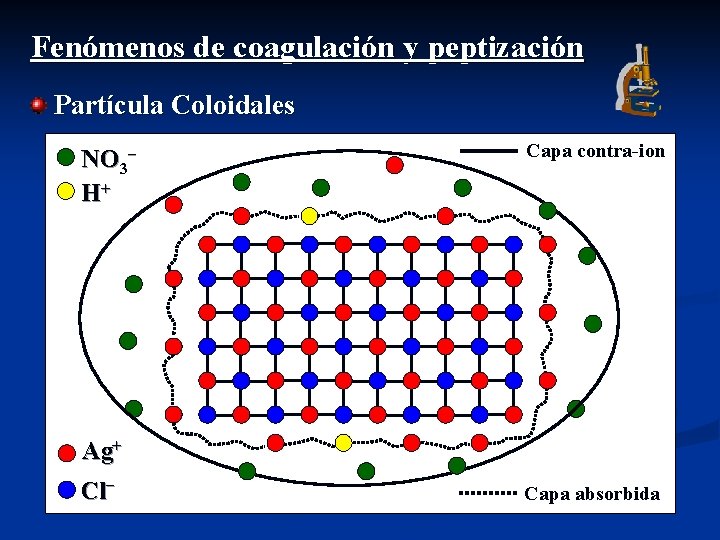
Fenómenos de coagulación y peptización Suspensiones Coloidales Coagular o Agregarse “El mecanismo de coagulación o agregación de las partículas coloidales presupone una disminución de la fuerzas repulsivas que mantienen a las partículas en suspensión” Condiciones 1. - Temperatura Aumentando la temperatura + agit. 2. - Adición de electrolito Electrolito de igual carga que la capa contra-ion. 3. - Agitación Video

Propiedades y características Suspensiones Coloidales (Propiedad de las Sol. coloidales) 1. - Son soluciones heterogéneas constituidas por un sólido disperso en forma de agregado iónico o molecular. 2. - Las partículas coloidales no disueltas no cambian las propiedades del líquido. 3. - Las soluciones coloidales presentan efecto Tyndall.

Fenómenos de Peptización Precipitados Coloidales Coagular o Agregarse Peptizar “La peptización es el proceso a través del cual las partículas coloidales coaguladas o agregadas, vuelven a su estado de dispersión” Condiciones 1. - Lavado con H 2 O para provocarla (diluye y arrastra electrolito) 2. - Lavado con electrolito para evitarla

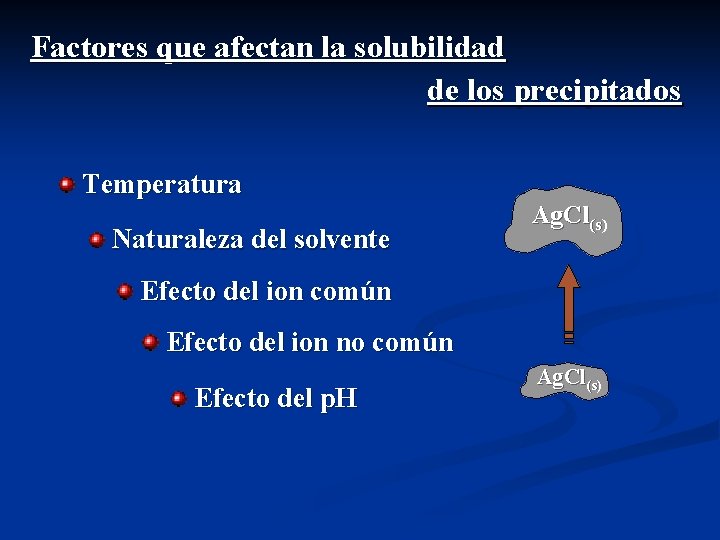
Factores que afectan la solubilidad de los precipitados Temperatura Naturaleza del solvente Ag. Cl(s) Efecto del ion común Efecto del ion no común Efecto del p. H Ag. Cl(s)

Factores que afectan la solubilidad de los precipitados Temperatura El grado de solubilidad de un precipitado viene determinado por la magnitud de su Kps. ΔH < o > 0 Naturaleza del solvente La solubilidad del precipitado dependerá de la polaridad del solvente empleado y en algunos casos de una posible capa protectora del solvente.

Factores que afectan la solubilidad de los precipitados Efecto del ion común Este efecto puede explicarse a través del principio de Le chatelier, por ejemplo: Ba+2 + 2 IO 3− Ba(IO 3)2 (s) Kps = 1, 57 x 10− 9 = [ Ba+2]e. [ IO 3−]2 e Efecto del ion no común o efecto salino Este efecto guarda relación con la fuerza iónica de la solución (μ = ½ (C 1 Z 12 + C 2 Z 22 + …+Cn. Zn 2)) y la actividad de los iones en solución. a 1 = [C 1]. f 1

Factores que afectan la solubilidad de los precipitados Efecto del p. H Este parámetro afecta a todos aquellos precipitados cuyos especies en equilibrio tienden a reaccionar con los H+ u OH− presentes en el medio donde se lleva a cabo la precipitación. 2 Cr. O 4= + 2 H+ 2 Ba. Cr. O 4(s) + 2 H+ Cr 2 O 7= + H 2 O 2 Ba+2 + Cr 2 O 7= + H 2 O Kps = [ Ba+2]e. [ Cr. O 4=]e

¡Gracias!

Fenómenos de coagulación y peptización Partícula Coloidales NO 3− H+ Capa contra-ion Ag+ Cl− Capa absorbida

Efecto Tyndall Video
 Una barca nel bosco commento
Una barca nel bosco commento Lisandro zambenedetti granville
Lisandro zambenedetti granville Alvarado esteban
Alvarado esteban Jorge galeazzi alvarado
Jorge galeazzi alvarado Frases de velasco alvarado
Frases de velasco alvarado Don pedro de alvarado
Don pedro de alvarado Juan velasco alvarado
Juan velasco alvarado Pasacle
Pasacle Alvarado apendicite
Alvarado apendicite Alvarado skoru
Alvarado skoru Pseudorene
Pseudorene Appendicitis score
Appendicitis score Sistema excretor
Sistema excretor Alvarado bebida
Alvarado bebida Maestro luis alvarado cieza
Maestro luis alvarado cieza Gabriela torres alvarado
Gabriela torres alvarado Alvarado elementary south
Alvarado elementary south Mario urteaga alvarado cajamarca
Mario urteaga alvarado cajamarca Trauma hepatico clasificacion
Trauma hepatico clasificacion Myriam alvarado castillo
Myriam alvarado castillo Pascale alvarado
Pascale alvarado Miranda rea
Miranda rea Universidad del este santa isabel
Universidad del este santa isabel Artes plasticas universidad nacional
Artes plasticas universidad nacional Universidad mariano galvez villa nueva
Universidad mariano galvez villa nueva