TRNG THCS THPT M HA HNG Chng 3


















- Slides: 30

TRƯỜNG THCS & THPT MỸ HÒA HƯNG Chương 3 BÀI LIÊN KẾT HÓA HỌC 13

KIÊ M TRA BA I CU Câu 1: Liên kê t ion la gi ? Mô tả sự hình thành liên kết ion của phân tử KCl từ các nguyên tử K và Cl. Biết K có Z = 19 và Cl có Z = 17.

ĐÁP ÁN • - Liên kết ion là liên kết được hình thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu. • Sự hình thành liên kết ion của phân tử KCl

LIÊN KẾT CỘNG HÓA TRỊ Bài 13: I II Sự hình thành liên kết cộng hóa trị Độ âm điện và liên kết hóa học

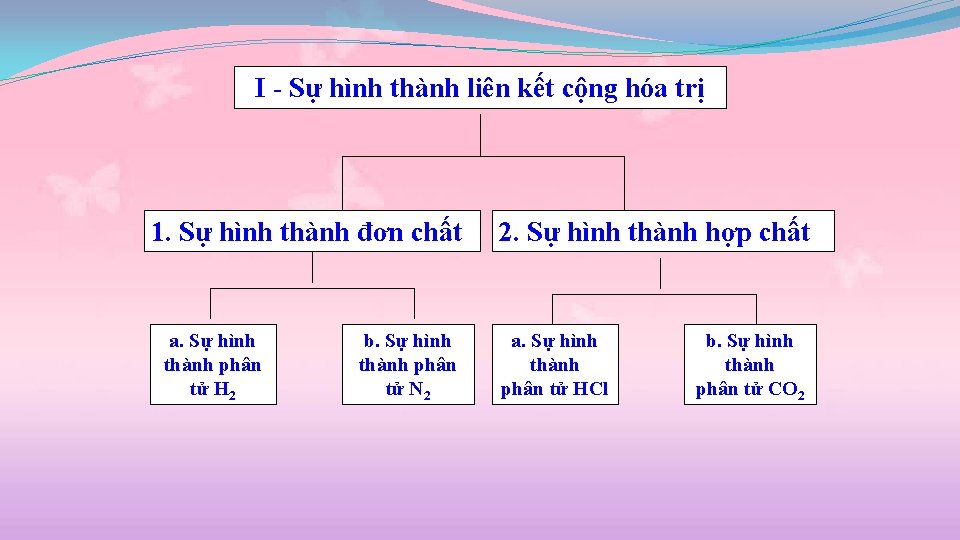
I - Sự hình thành liên kết cộng hóa trị 1. Sự hình thành đơn chất a. Sự hình thành phân tử H 2 b. Sự hình thành phân tử N 2 2. Sự hình thành hợp chất a. Sự hình thành phân tử HCl b. Sự hình thành phân tử CO 2

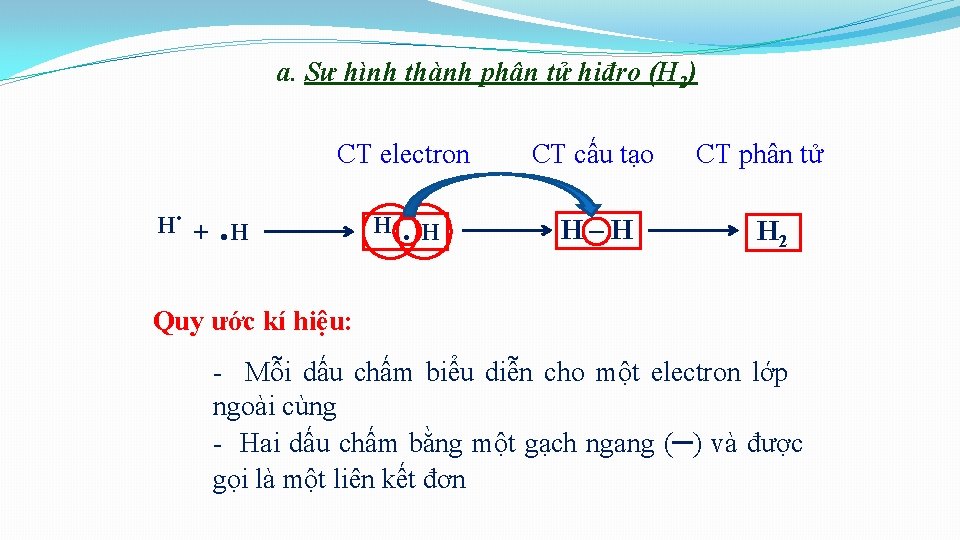
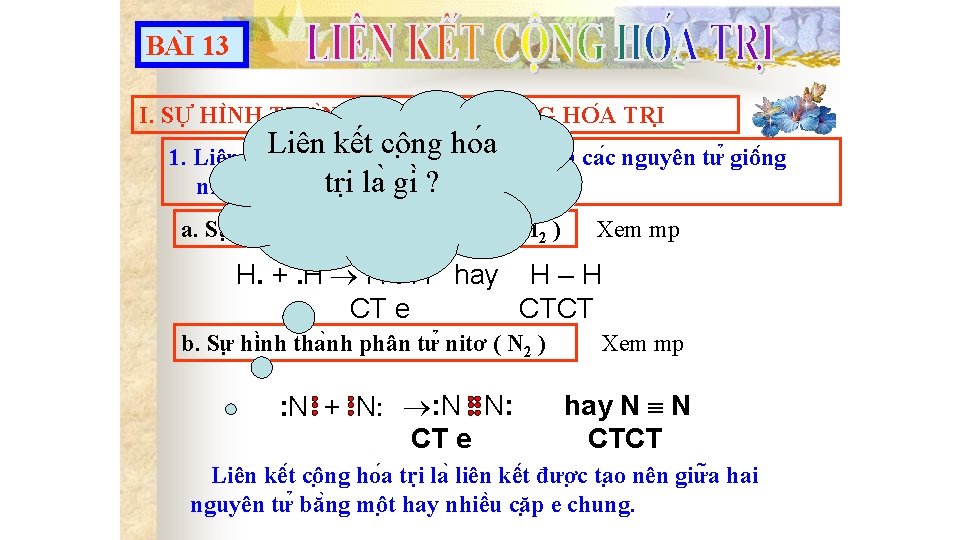
I. SỰ HÌNH THÀNH LIÊN KẾT CỘNG HÓA TRỊ 1. Liên kết cộng hoá trị hình thành giữa các nguyên tử giống nhau. Sự hình thành đơn chất: a) Sự hình thành phân tử Hidro ( H 2) • Cấu hình electron: Ø H ( Z=1): H 1 s 1 H

a. Sự hình thành phân tử hiđro (H 2) . H CT electron CT cấu tạo . H. H H–H +. H CT phân tử H 2 Quy ước kí hiệu: - Mỗi dấu chấm biểu diễn cho một electron lớp ngoài cùng - Hai dấu chấm bằng một gạch ngang (–) và được gọi là một liên kết đơn

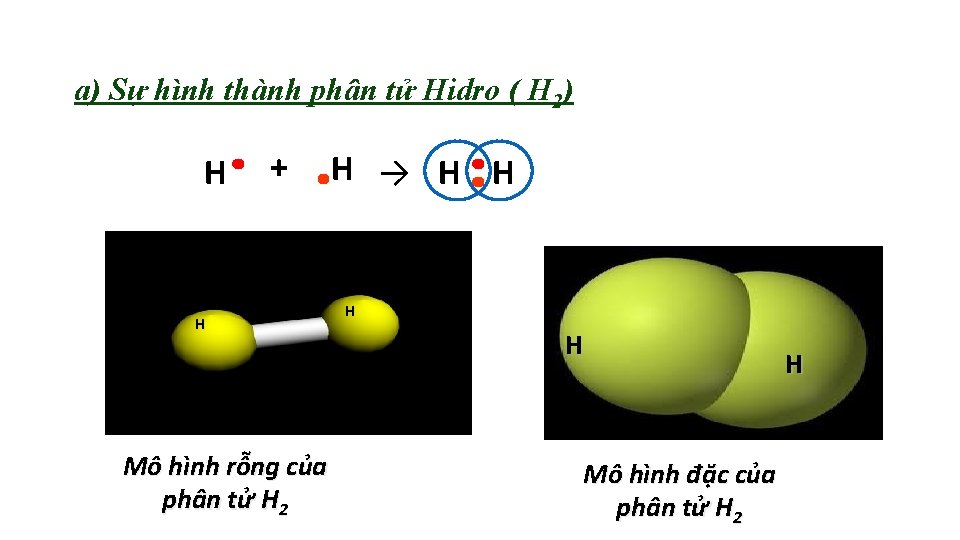
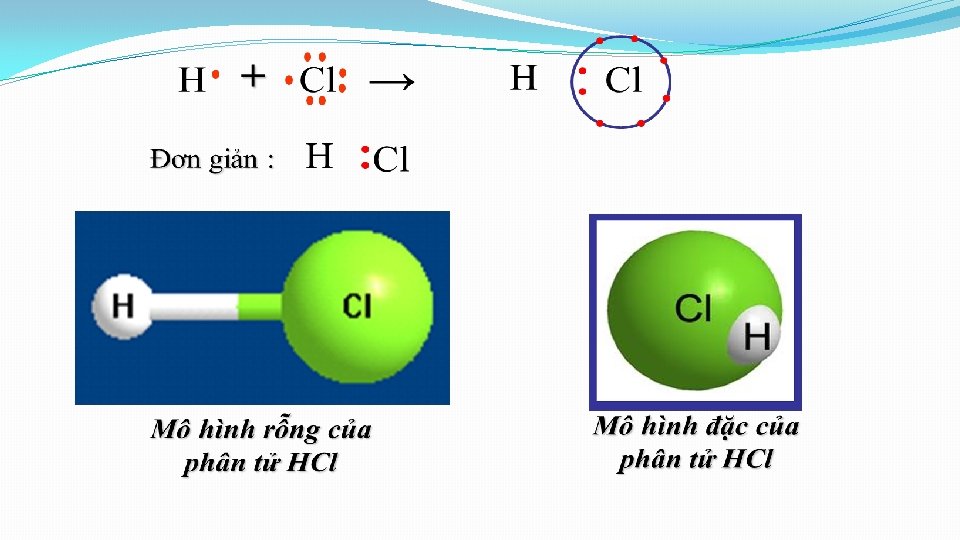
a) Sự hình thành phân tử Hidro ( H 2) H + H Mô hình rỗng của phân tử H 2 H → H H Mô hình đặc của phân tử H 2 H

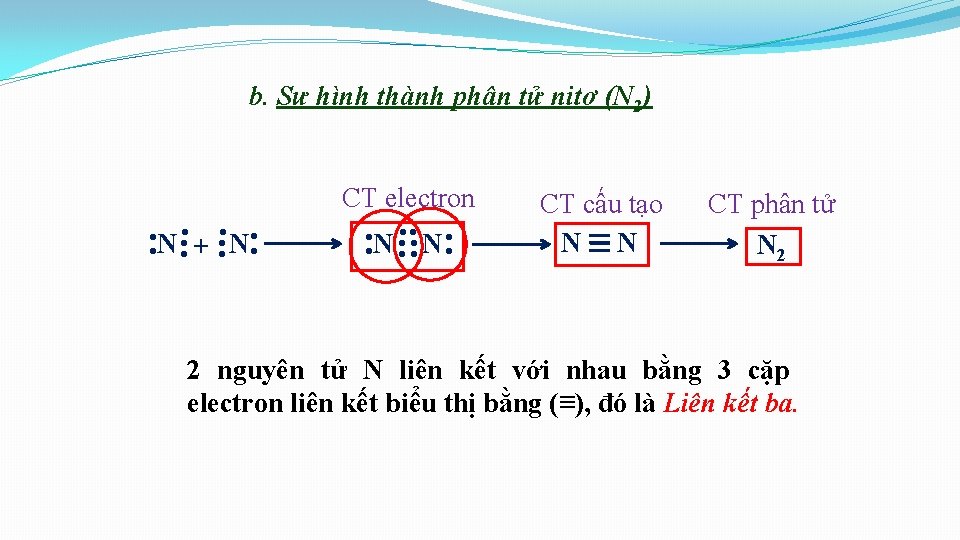
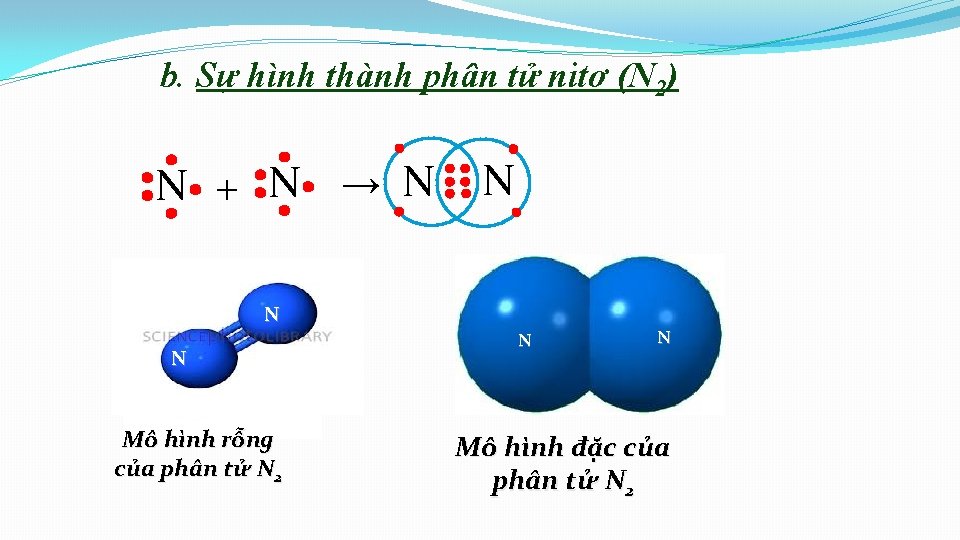
1. Liên kết cộng hoá trị hình thành giữa các nguyên tử giống nhau. Sự hình thành đơn chất. b. Sự hình thành phân tử nitơ (N 2) • Cấu hình electron: Ø N ( Z=7): N 1 s 2 2 p 3 N

b. Sự hình thành phân tử nitơ (N 2) . . N. . . +. . . N. . CT electron . . N. . CT cấu tạo N N CT phân tử N 2 2 nguyên tử N liên kết với nhau bằng 3 cặp electron liên kết biểu thị bằng (≡), đó là Liên kết ba.

b. Sự hình thành phân tử nitơ (N 2) N + N → N N N Mô hình rỗng của phân tử N 2 N N Mô hình đặc của phân tử N 2

BA I 13 I. SƯ HI NH THA NH LIÊN KÊ T CÔ NG HO A TRI cô nhi gnhho anh giư a ca c nguyên tư giô ng 1. Liên kê Liên t cô ng kê ho at tri tha la ngi ? châ t. nhau. Sư hi ntri h tha h đơn a. Sư hi nh tha nh phân tư hiđro ( H 2 ) Xem mp H. +. H H : H hay H – H CT e CTCT b. Sư hi nh tha nh phân tư nitơ ( N 2 ) : N + N: : N N: CT e Xem mp hay N N CTCT Liên kê t cô ng ho a tri la liên kê t đươ c ta o nên giư a hai nguyên tư bă ng mô t hay nhiê u că p e chung.

BA I 13 I. SƯ HI NH THA NH LIÊN KÊ T CÔ NG HO A TRI 1. Liên kê t cô ng ho a tri hi nh tha nh giư a ca c nguyên tư giô ng nhau. Sư hi nh tha nh đơn châ t. Liên kê t cô ng ho a tri la liên kê t đươ c ta o nên giư a hai nguyên tư bă ng mô t hay nhiê u că p e chung. Sô e go p chung = 8 – Sô e ngoa i cu ng ( trư H 2 ) Liên kê t trong phân tư H 2 , N 2 la liên kê t cô ng ho a tri không cư c, vi ca c că p e chung không bi lê ch vê phi a nguyên tư na o.

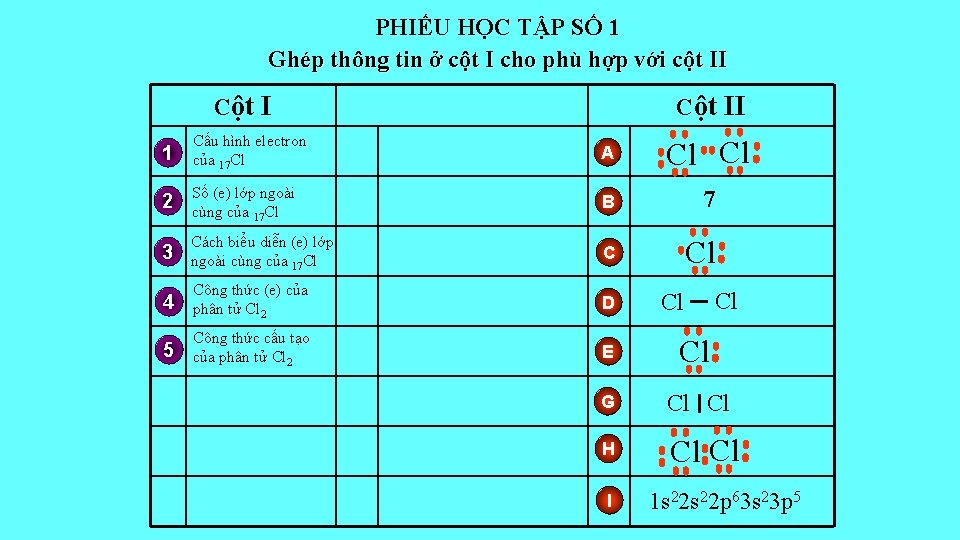
PHIẾU HỌC TẬP SỐ 1 Ghép thông tin ở cột I cho phù hợp với cột II Cột II 1 Cấu hình electron của 17 Cl A Cl Cl 2 Số (e) lớp ngoài cùng của 17 Cl B 7 3 Cách biểu diễn (e) lớp ngoài cùng của 17 Cl C Cl 4 Công thức (e) của phân tử Cl 2 D 5 Công thức cấu tạo của phân tử Cl 2 E Cl G Cl Cl H Cl Cl I Cl Cl 1 s 22 p 63 s 23 p 5

Kết luận: Ø Khái niệm về liên kết cộng hoá trị: Là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung. Ø Liên kết cộng hoá trị không cực: Là liên kết cộng hoá trị trong đó đôi electron dùng chung không bị lệch về phía nguyên tử nào.

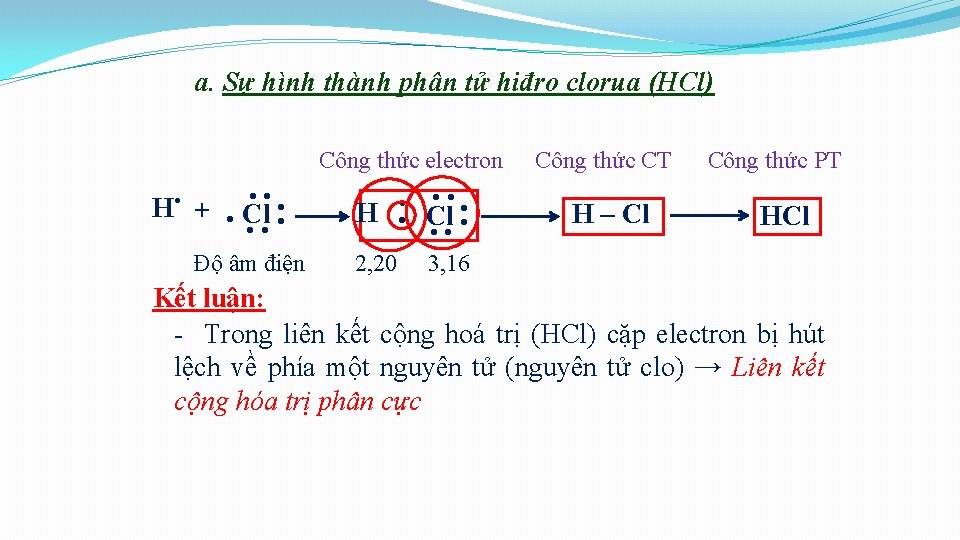
2. Liên kết giữa các nguyên tử khác nhau. Sự hình thành hợp chất. a. Sự hình thành phân tử hiđro clorua (HCl) • Cấu hình electron: v H ( Z=1): 1 s 1 v Cl ( Z=17): H 1 s 22 p 63 s 23 p 5 Cl

a. Sự hình thành phân tử hiđro clorua (HCl) Công thức electron . Cl. . Độ âm điện H 2, 20 . . . Cl. . . + . . . H Công thức CT H – Cl Công thức PT HCl 3, 16 Kết luận: - Trong liên kết cộng hoá trị (HCl) cặp electron bị hút lệch về phía một nguyên tử (nguyên tử clo) → Liên kết cộng hóa trị phân cực


Kết luận: Ø Liên kết cộng hoá trị có cực ( phân cực): Là liên kết cộng hoá trị trong đó cặp electron chung bị lệch về phía nguyên tử có độ âm điện lớn hơn.

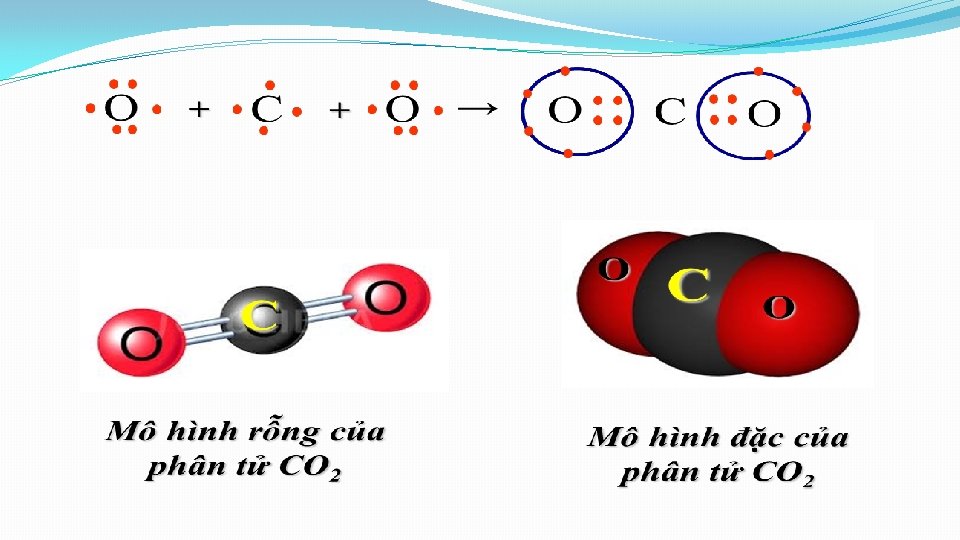
2. Liên kết giữa các nguyên tử khác nhau. Sự hình thành hợp chất. b. Sự hình thành phân tử cacbon đioxit (CO 2) (có cấu tạo thẳng) • Cấu hình electron: v C ( Z= 6): 1 s 22 p 2 v O ( Z=8): 1 s 22 p 4 • Sự hình thành phân tử khí cacbon đioxit (CO 2) O C O

. . . C + O. . Độ âm điện: Kết luận: . . . O + . . b. Sự hình thành phân tử cacbon đioxit (CO 2) (có cấu tạo thẳng) CT cấu tạo CT ph. tử CT electron O : : C : : O O=C=O CO 2 3, 44 2, 55 3, 44 - Trong phân tử CO 2 các cặp electron bị hút lệch về phía O vì oxi có độ âm điện lớn hơn C → Liên kết C=O bị phân cực về phía O - Trong phân tử CO 2 có cấu tạo thẳng nên liên kết đôi phân cực (C=O) triệt tiêu nhau → Phân tử CO 2 không phân cực


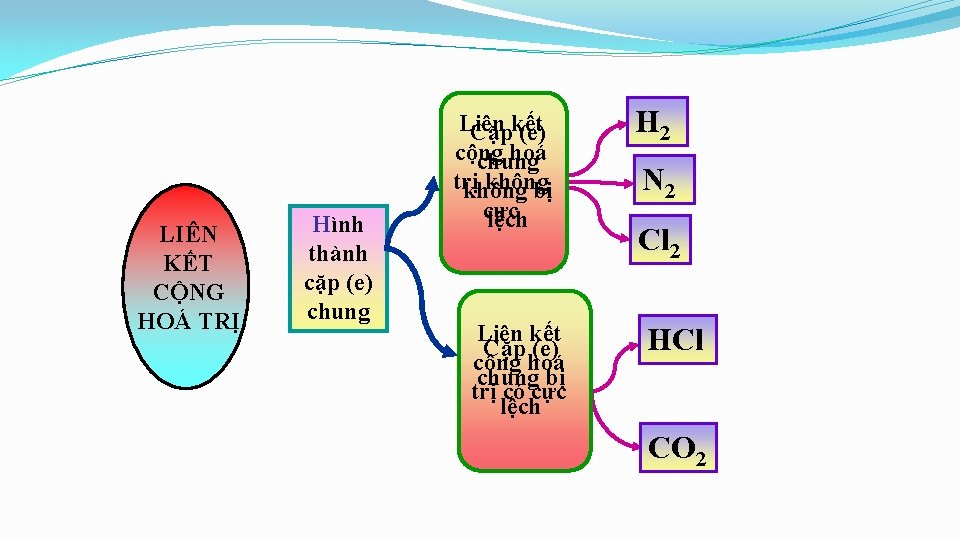
LIÊN KẾT CỘNG HOÁ TRỊ Hình thành cặp (e) chung Liên Cặpkết (e) cộng hoá chung trị không bị cực lệch Liên kết Cặp (e) cộng hoá chung bị trị có cực lệch H 2 N 2 Cl 2 HCl CO 2

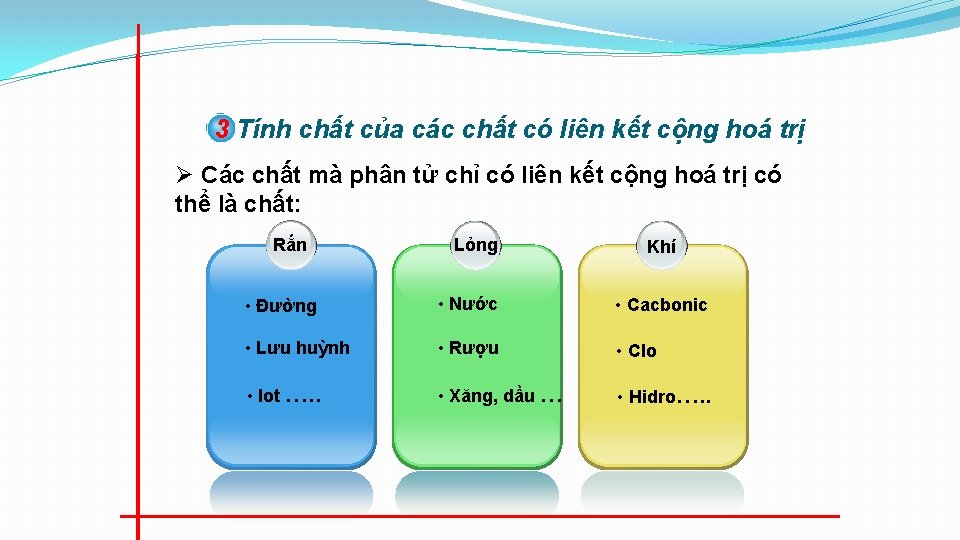
3 Tính chất của các chất có liên kết cộng hoá trị Ø Các chất mà phân tử chỉ có liên kết cộng hoá trị có thể là chất: Rắn Lỏng Khí • Đường • Nước • Cacbonic • Lưu huỳnh • Rượu • Clo • Iot …. . • Xăng, dầu … • Hidro…. .

Ø Các chất có cực tan nhiều trong dung môi có cực như nước Ví dụ: HCl, ancol… Ø Phần lớn các chất không cực tan trong dung môi không cực như benzen, cacbon tetraclorua…. Ví dụ: lưu huỳnh, iot, các chất hữu cơ không cực… Ø Nói chung, các chất chỉ có liên kết cộng hoá trị không cực không dẫn điện ở mọi trạng thái.

CỦNG CỐ 1 Kiểu liên kết nào được tạo thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung? a Liên kết ion b Liên kết kim loại c Liên kết cộng hoá trị d Liên kết hidro

CỦNG CỐ 2 Phân tử nào sau đây được tạo thành từ liên kết cộng hoá trị không cực: a NH 3 b HCl c O 2 d H 2 O

CỦNG CỐ 3 Hãy viết công thức electron và công thức cấu tạo của các phân tử sau: Br 2, H 2 O, CH 4, PH 3. Giải: H 2 O . H. O. . H. . Br. . Br 2 Công thức electron . . Công thức PT Công thức CT H–O–H Br – Br

HƯỚNG DẪN HỌC BÀI CŨ Về nhà : Làm bài tập 4, 6 SGK trang 64 Xem trước : Mục 3. Tính chất của các chất có liên kết cộng hoá trị. Phần II. ĐỘ M ĐIỆN VÀ LIÊN KẾT HÓA HỌC
