TEMA 2 ESTRUCTURA DE LA MATERIA Y SISTEMA















- Slides: 23

TEMA 2 ESTRUCTURA DE LA MATERIA Y SISTEMA PERIÓDICO (2ª parte) Fernando Granell Sánchez

Contenidos 1. - Repaso histórico de la ordenación de elementos. 1. 1. - Primeras clasificaciones de los elementos químicos 1. 2. - Tablas periódicas de Mendeleiev y Meyer 2. - Sistema Periódico actual. 2. 1. - Grupos y periodos. Su relación con la configuración electrónica. 2. 2. - Familias que integran el Sistema Periódico. 3. - Propiedades periódicas principales. 3. 1. - Radio atómico e iónico. 3. 2. - Energía de ionización. 3. 3. - Afinidad electrónica. 3. 4. - Electronegatividad. 3. 5. - Carácter metálico y no metálico.

1. - Repaso histórico de la ordenación de elementos. La primera clasificación de los elementos la plantea Antoine Lavoisier distinguiendo metales, no metales y metaloides. Cuando se midieron las masas atómicas se observaron que ciertas propiedades variaban periódicamente en relación a su masa. Triadas de Döbereiner (1829): La masa del elemento intermedio es la media aritmética de la masa de los otros dos. Cl, Br y I; Li, Na y K; Ca, Sr y Ba; S, Se y Te.

Anillo de Chancourtois (1862). Construyó una hélice de papel, en la que los elementos conocidos estaban ordenados por pesos atómicos, arrollada sobre un cilindro vertical. Los elementos similares estaban prácticamente sobre la misma generatriz, lo que indicaba una cierta periodicidad Octavas de Newlands (1864) Ordenó los elementos en orden creciente de sus pesos atómicos (prescindiendo del hidrógeno); el octavo elemento a partir de cualquier otro tenía unas propiedades muy similares al primero. 1 2 3 4 5 6 7 Li 6, 9 Be 9, 0 B 10, 8 C 12, 0 N 14, 0 O 16, 0 F 19, 0 Na 23, 0 Mg 24, 3 Al 27, 0 Si 28, 1 P 31, 0 S 32, 1 Cl 35, 5 K 39, 0 Ca 40, 0

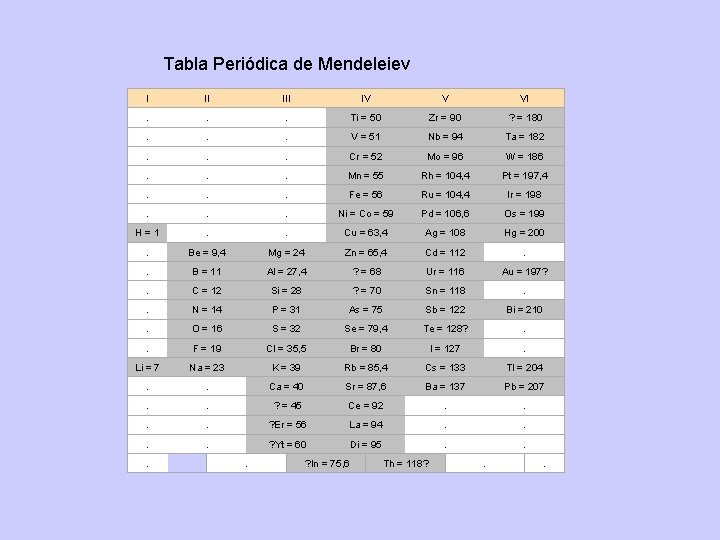
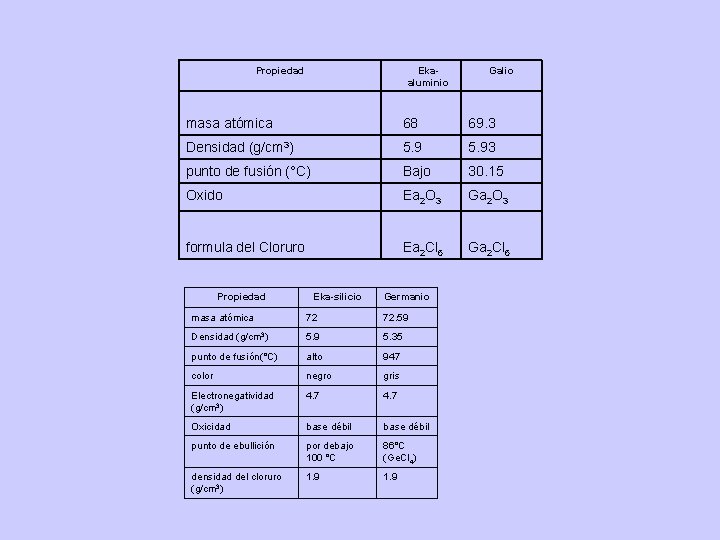
Tabla Periódica de Meyer (1870) Buscó determinar los volúmenes atómicos de los elementos. Para obtenerlos, pesó cantidades en gramos numéricamente iguales al peso atómico de cada elemento. Después midió el volumen que ocupaban estos pesos a la misma temperatura y presión. Al representar gráficamente los valores que obtuvo, en función de los pesos atómicos, observó que se presentaban una serie de ondas con ascenso en el peso atómico que correspondían a un incremento en sus propiedades físicas. Tabla Periódica de Mendeleiev (1869) Basándose en la hipótesis de que las propiedades de los elementos son función periódica de sus pesos atómicos publicó una tabla periódica en la que situó todos los elementos conocidos en aquella época, ordenando los elementos de forma tal que los elementos pertenecientes a una misma familia aparecen en la misma línea horizontal. Debido a la universalidad de la ley, él predijo la existencia de los elementos con las características indicadas por el espacio que ocupan en la tabla. Empleó la palabra sánscrita eka, llamándolos eka-boro, eka- aluminio y eka-silicio. Años más tarde fueron descubiertos dichos elementos, encontrándose que eran Escandio, Galio y Germanio.

Tabla Periódica de Mendeleiev I II IV V VI . . . Ti = 50 Zr = 90 ? = 180 . . . V = 51 Nb = 94 Ta = 182 . . . Cr = 52 Mo = 96 W = 186 . . . Mn = 55 Rh = 104, 4 Pt = 197, 4 . . . Fe = 56 Ru = 104, 4 Ir = 198 . . . Ni = Co = 59 Pd = 106, 6 Os = 199 H = 1 . . Cu = 63, 4 Ag = 108 Hg = 200 . Be = 9, 4 Mg = 24 Zn = 65, 4 Cd = 112 . . B = 11 Al = 27, 4 ? = 68 Ur = 116 Au = 197? . C = 12 Si = 28 ? = 70 Sn = 118 . . N = 14 P = 31 As = 75 Sb = 122 Bi = 210 . O = 16 S = 32 Se = 79, 4 Te = 128? . . F = 19 Cl = 35, 5 Br = 80 I = 127 . Li = 7 Na = 23 K = 39 Rb = 85, 4 Cs = 133 Tl = 204 . . Ca = 40 Sr = 87, 6 Ba = 137 Pb = 207 . . ? = 45 Ce = 92 . . ? Er = 56 La = 94 . . ? Yt = 60 Di = 95 . . ? In = 75, 6 Th = 118? . .

Propiedad Ekaaluminio Galio masa atómica 68 69. 3 Densidad (g/cm 3) 5. 93 punto de fusión (°C) Bajo 30. 15 Oxido Ea 2 O 3 Ga 2 O 3 formula del Cloruro Ea 2 Cl 6 Ga 2 Cl 6 Propiedad Eka-silicio Germanio masa atómica 72 72. 59 Densidad (g/cm 3) 5. 9 5. 35 punto de fusión(°C) alto 947 color negro gris Electronegatividad (g/cm 3) 4. 7 Oxicidad base débil punto de ebullición por debajo 100 °C 86°C (Ge. Cl 4) densidad del cloruro (g/cm 3) 1. 9

Las predicciones realizadas por Mendeleiev y el hecho de haber publicado su Tabla Periódica un año antes que la de Meyer le sitúan como el padre del Sistema Periódico. Sin embargo, su ley no era del todo exacta y de hecho tuvo que alterar el orden de alguno de los elementos (Te-I, Co-Ni) para que coincidiesen los elementos que tenían propiedades parecidas. En 1913, Moseley (discípulo de Rutherford) mediante la difracción de rayos X en cristales consiguió una relación sistemática entre la longitud de onda de dichas radiaciones con el número atómico (ley de Moseley). A partir de esta ley y colocando los elementos en orden creciente de su número atómico todos quedaban situados en el lugar adecuado, sin necesidad de tener que alterar el orden, como tuvo que hacer Mendeleiev. El Sistema Periódico actual está basado en dicha ley.

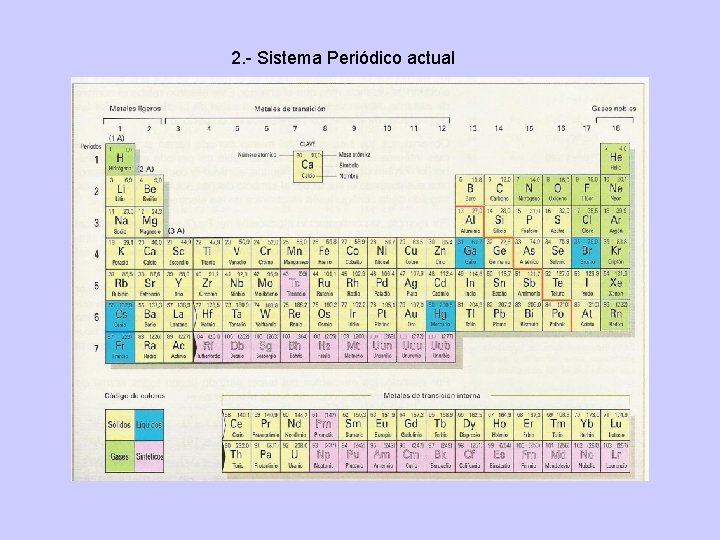
2. - Sistema Periódico actual

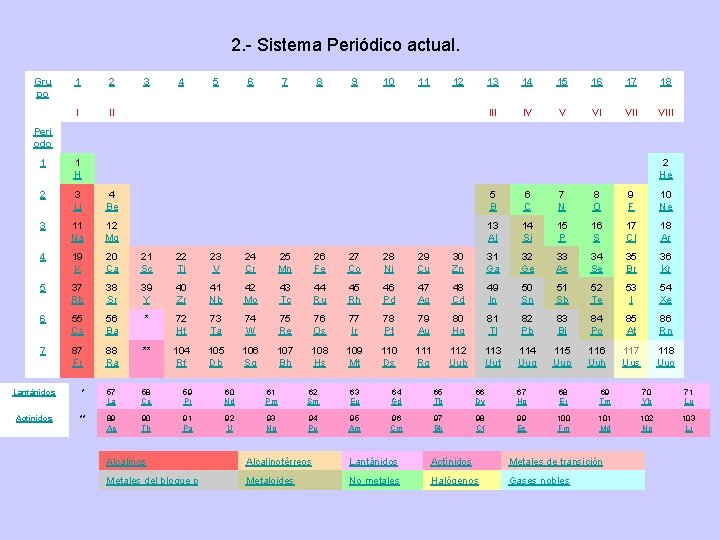
2. - Sistema Periódico actual. Gru po 1 2 I II 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 III IV V VI VIII Peri odo 1 1 H 2 He 2 3 Li 4 Be 5 B 6 C 7 N 8 O 9 F 10 Ne 3 11 Na 12 Mg 13 Al 14 Si 15 P 16 S 17 Cl 18 Ar 4 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 29 Cu 30 Zn 31 Ga 32 Ge 33 As 34 Se 35 Br 36 Kr 5 37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42 Mo 43 Tc 44 Ru 45 Rh 46 Pd 47 Ag 48 Cd 49 In 50 Sn 51 Sb 52 Te 53 I 54 Xe 6 55 Cs 56 Ba * 72 Hf 73 Ta 74 W 75 Re 76 Os 77 Ir 78 Pt 79 Au 80 Hg 81 Tl 82 Pb 83 Bi 84 Po 85 At 86 Rn 7 87 Fr 88 Ra ** 104 Rf 105 Db 106 Sg 107 Bh 108 Hs 109 Mt 110 Ds 111 Rg 112 Uub 113 Uut 114 Uuq 115 Uup 116 Uuh 117 Uus 118 Uuo Lantánidos * 57 La 58 Ce 59 Pr 60 Nd 61 Pm 62 Sm 63 Eu 64 Gd 65 Tb 66 Dy 67 Ho 68 Er 69 Tm 70 Yb 71 Lu Actínidos ** 89 Ac 90 Th 91 Pa 92 U 93 Np 94 Pu 95 Am 96 Cm 97 Bk 98 Cf 99 Es 100 Fm 101 Md 102 No 103 Lr Alcalinos Alcalinotérreos Lantánidos Actínidos Metales de transición Metales del bloque p Metaloides No metales Halógenos Gases nobles

La Tabla Periódica que se utiliza hoy en día se estructura según la configuración electrónica de los elementos. No siempre se cumple el orden de llenado según el diagrama de Moeller, ya que produce una mayor estabilidad a los elementos el hecho de tener los orbitales llenos o semillenos. Los Períodos, o filas, se designan con los números del 1 al 7 y en cada uno de ellos el nivel energético de los electrones de valencia de los elementos que lo forman es el mismo, ya que cada elemento contiene un electrón de valencia más que el elemento anterior. Este electrón se denomina electrón diferenciador y es el responsable de la diferencia de propiedades de dos elementos correlativos. Los Grupos, o familias, se designan con los números 1 al 18. Los elementos de cada grupo tienen propiedades químicas parecidas debido a su coincidencia en la configuración electrónica de los electrones de valencia.

Los grupos 1, 2 y del 13 al 18 están constituidos por los elementos representativos, que reciben los siguientes nombre: Grupo Nombre del Grupo Electrones de valencia 1 Alcalinos ns 1 2 Alcalinotérreos ns 2 13 Térreos ns 2 np 1 14 Carbonoideos ns 2 np 2 15 Nitrogenoideos ns 2 np 3 16 Anfígenos ns 2 np 4 17 Halógenos ns 2 np 5 18 Gases Nobles ns 2 np 6 Los grupos 3 a 12 están constituidos por los elementos de transición, cuyos electrones de valencia coinciden con ns 2(n-1)d 1 -10. Entre los metales de transición y fuera de la tabla periódica se encuentran los elementos de transición interna, cuyos electrones de valencia, de forma genérica y con muchas excepciones son: Lantánidos: 6 s 2 5 d 1 4 f 1 -14 Actínidos: 7 s 2 6 d 1 5 f 1 -14


Si bien el Sistema Periódico anterior es el más utilizado, existen otras propuestas para la distribución de los elementos químicos. Son los siguientes (los puedes consultar en el enlace que hay debajo): 1951. Forma en espiral, 1960. Forma en espiral, profesor Theodor Benfey 1969. Tabla periódica de los elementos extendida Glenn T. Seaborg 1995. Forma en espiral-fractal, Melinda E Green 2004 - Forma en espiral sobre dibujo de galaxia, Philip J. Stewart http: //es. wikipedia. org/wiki/Clasificacion_periodica#Otr as_formas_de_representar_la_tabla_peri. C 3. B 3 dica Por último, en la Universidad de Salamanca, hace muchos años, los estudiantes hicimos (o copiamos) un “Sistema Peryódico”


3. - Propiedades periódicas principales. Son aquellas que varían con regularidad a lo largo de los grupos y periodos. La razón de su regularidad reside en la configuración electrónica y en el número atómico del elemento. La carga nuclear efectiva sobre el electrón más externo facilita el estudio de esta variación. La carga nuclear efectiva se define como la carga que debiera tener el núcleo para que, en ausencia de otros electrones, la atracción del núcleo sobre el electrón considerado fuera la misma que la atracción neta que experimenta el electrón en el átomo real. Su valor es el resultado de restar a la carga nuclear el apantallamiento del resto de electrones del átomo. Este apantallamiento es diferente si se trata de electrones de capas interna (cada uno toma un valor unidad) que si se encuentra en la capa de valencia (en este caso toma un valor menor que la unidad). Las propiedades periódicas más importante son: Radio atómico e iónico, volumen atómico, Potencial de ionización, Afinidad electrónica, Electronegatividad, Carácter metálico y no metálico. En el siguiente enlace puedes consultar los datos: http: //www. educaplus. org/properiodicas/radatomico. html

Radio atómico e iónico. Radio Atómico. El átomo no tiene límites definidos. Se toma como la mitad de la distancia entre dos núcleos iguales. El valor es aproximado ya que la distancia depende del tipo de enlace. Aumento del radio a lo largo de un grupo y un período.

Radio Iónico. Los cationes tienen un radio menor que el atómico. Los aniones tienen un radio mayor que el atómico. Este hecho se puede explicar a partir de la carga nuclear efectiva sobre el electrón más externo.

Volumen atómico Se toma por convenio como el cociente entre la masa atómica y la densidad. Meyer se basó en este estudio para establecer su Sistema Periódico, midiendo el volumen molar, es decir el volumen que ocupa un mol de un elemento y dividiéndolo por su densidad. Varía según el tipo de empaquetamiento. Por ejemplo, la densidad en el C (diamante) es distinta que en el C (grafito). El valor del volumen molar está relacionado con el volumen del átomo pero no se corresponde exactamente con éste ya que, entre otros factores, la densidad del elemento está determinada por su estructura cristalina (incluyendo los huecos entre átomos).

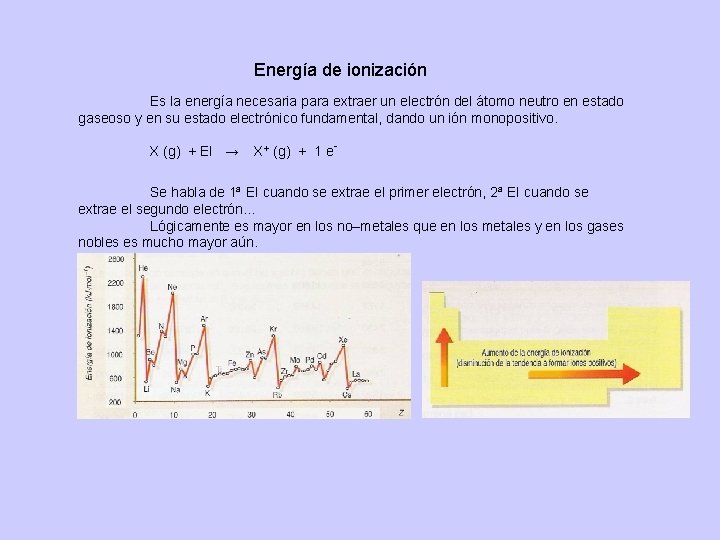
Energía de ionización Es la energía necesaria para extraer un electrón del átomo neutro en estado gaseoso y en su estado electrónico fundamental, dando un ión monopositivo. X (g) + EI → X+ (g) + 1 e. Se habla de 1ª EI cuando se extrae el primer electrón, 2ª EI cuando se extrae el segundo electrón. . . Lógicamente es mayor en los no–metales que en los metales y en los gases nobles es mucho mayor aún.

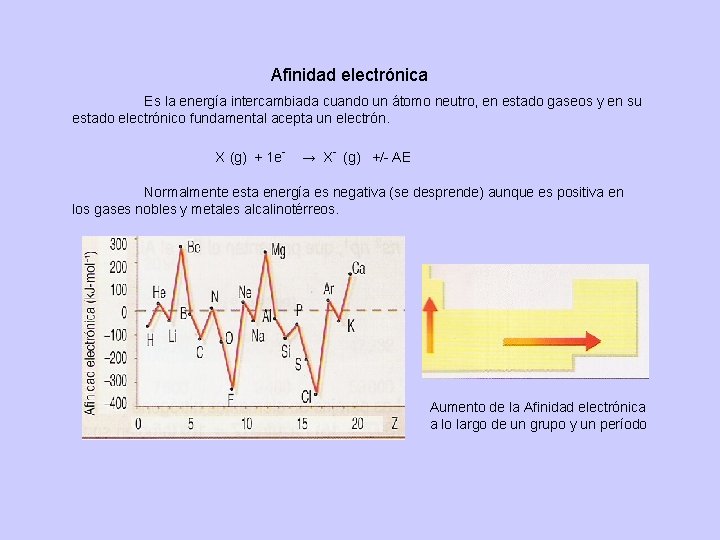
Afinidad electrónica Es la energía intercambiada cuando un átomo neutro, en estado gaseos y en su estado electrónico fundamental acepta un electrón. X (g) + 1 e- → X- (g) +/- AE Normalmente esta energía es negativa (se desprende) aunque es positiva en los gases nobles y metales alcalinotérreos. Aumento de la Afinidad electrónica a lo largo de un grupo y un período

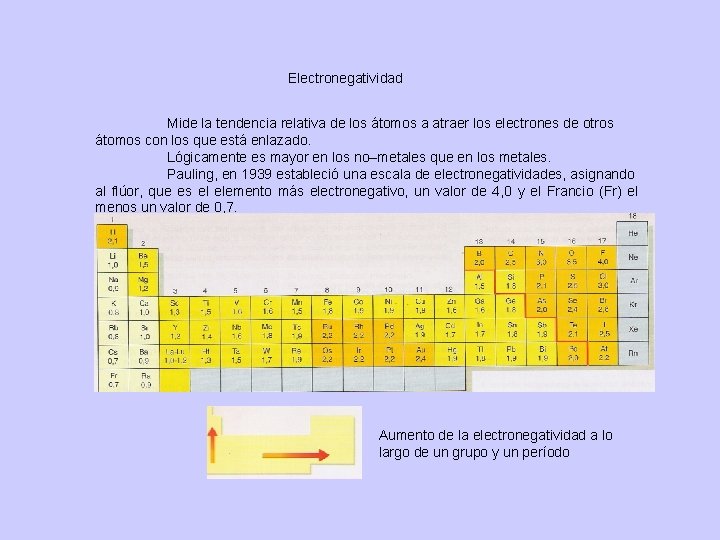
Electronegatividad Mide la tendencia relativa de los átomos a atraer los electrones de otros átomos con los que está enlazado. Lógicamente es mayor en los no–metales que en los metales. Pauling, en 1939 estableció una escala de electronegatividades, asignando al flúor, que es el elemento más electronegativo, un valor de 4, 0 y el Francio (Fr) el menos un valor de 0, 7. Aumento de la electronegatividad a lo largo de un grupo y un período

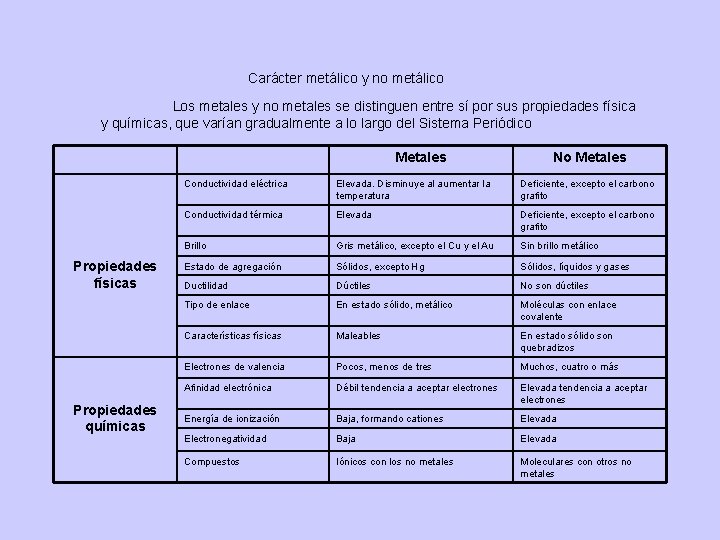
Carácter metálico y no metálico Los metales y no metales se distinguen entre sí por sus propiedades física y químicas, que varían gradualmente a lo largo del Sistema Periódico Metales Propiedades físicas Propiedades químicas No Metales Conductividad eléctrica Elevada. Disminuye al aumentar la temperatura Deficiente, excepto el carbono grafito Conductividad térmica Elevada Deficiente, excepto el carbono grafito Brillo Gris metálico, excepto el Cu y el Au Sin brillo metálico Estado de agregación Sólidos, excepto Hg Sólidos, líquidos y gases Ductilidad Dúctiles No son dúctiles Tipo de enlace En estado sólido, metálico Moléculas con enlace covalente Características físicas Maleables En estado sólido son quebradizos Electrones de valencia Pocos, menos de tres Muchos, cuatro o más Afinidad electrónica Débil tendencia a aceptar electrones Elevada tendencia a aceptar electrones Energía de ionización Baja, formando cationes Elevada Electronegatividad Baja Elevada Compuestos Iónicos con los no metales Moleculares con otros no metales
 Tema-tema teologi perjanjian lama
Tema-tema teologi perjanjian lama Subtema
Subtema Introducción a una entrevista ejemplo
Introducción a una entrevista ejemplo Naturalisme seniman
Naturalisme seniman Delimitacion del tema ejemplo
Delimitacion del tema ejemplo Estructura de la materia 2 bachillerato
Estructura de la materia 2 bachillerato Redes bravais
Redes bravais Estructura del sistema de salud
Estructura del sistema de salud Estructura del sistema financiero internacional
Estructura del sistema financiero internacional Sistema digestivo
Sistema digestivo Cual es la estructura del sistema de salud
Cual es la estructura del sistema de salud Sistema bancario mexicano estructura
Sistema bancario mexicano estructura El sistema educativo mexicano
El sistema educativo mexicano Arterias musculares ejemplos
Arterias musculares ejemplos Mapa conceptual del sistema financiero mexicano
Mapa conceptual del sistema financiero mexicano Sistema financiero de guatemala
Sistema financiero de guatemala Macroplanificación
Macroplanificación Estructura del sistema financiero en colombia
Estructura del sistema financiero en colombia Estructura sistema operativo
Estructura sistema operativo El aparato respiratorio con nombres
El aparato respiratorio con nombres L
L Retoalimentación
Retoalimentación Estructura del sistema financiero mexicano
Estructura del sistema financiero mexicano Antigenos virales
Antigenos virales