TEMA 4 ESTRUCTURA TRIDIMENSIONAL DE LAS PROTEINAS Estructura














- Slides: 31

TEMA 4 ESTRUCTURA TRIDIMENSIONAL DE LAS PROTEINAS

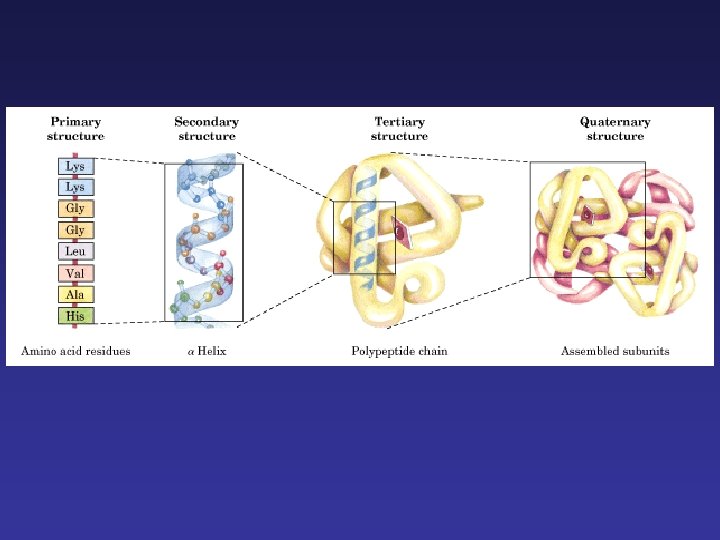
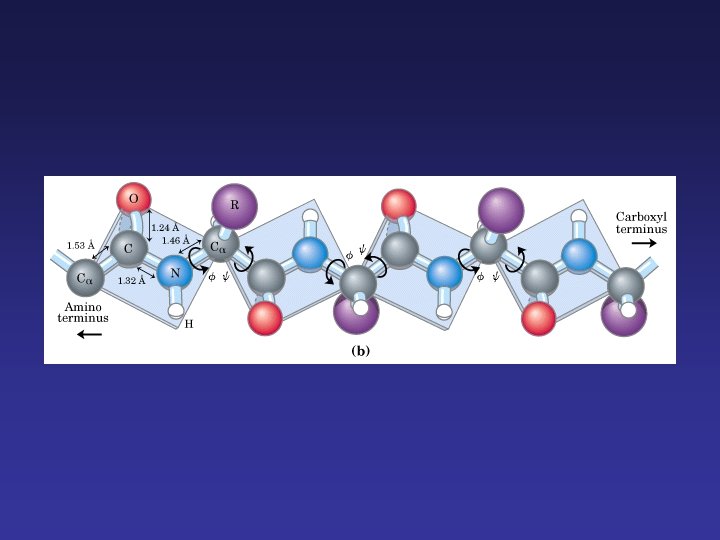
Estructura primaria: la secuencia lineal de los aminoácidos que la forman. La estructura primaria contiene toda la información necesaria para que la proteína sea única y siempre tenga tanto la misma estructura y función. Estructura secundaria: es el plegamiento que la cadena polipeptídica adopta gracias a la formación de puentes de hidrógeno entre los átomos que forman el enlace peptídico. Estructura terciaria: se trata de un nivel superior de complejidad determinado por la disposición espacial de las distintas estructuras secundarias de una cadena polipeptídica. Esta conformación se mantiene estable gracias a interacciones entre los distintos radicales (R) de los aminoácidos; estas interacciones pueden ser de varios tipos (no todos ellos contribuyen por igual al mantenimiento de la estructura terciaria): Estructura cuaternaria: este nivel estructural sólo lo presentan aquellas proteínas formadas por más de una cadena polipeptídica, ya que se trata de la unión mediante enlaces débiles (puentes de hidrógeno, electrostáticos o hidrófobos) y ocasionalmente puentes disulfuro.


Estructura primaria



HOMOLOGÍA Ortólogas: Están presentes en diferentes especies y tienen funciones similares o idénticas. Parálogas: Están presentes en una misma especie y difieren en su función. Son el resultado de duplicaciones génicas y una posterior divergencia de función.


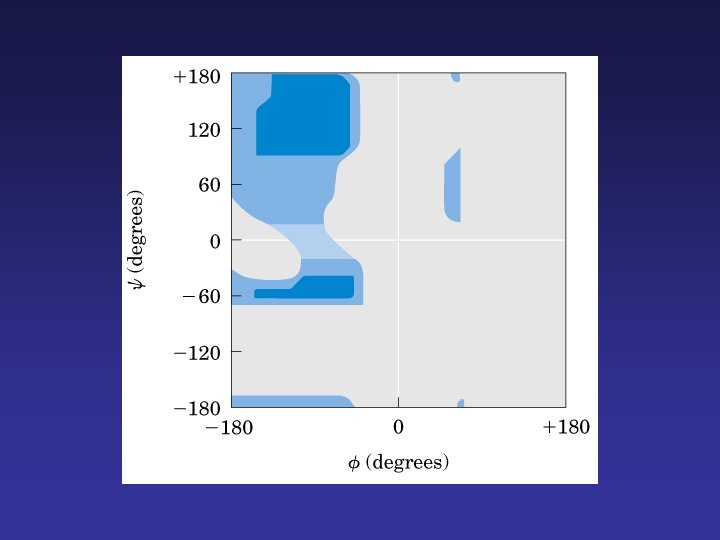
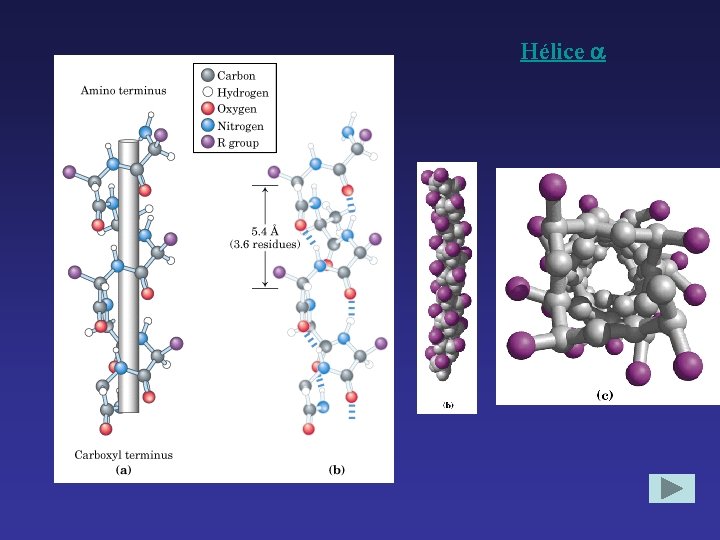
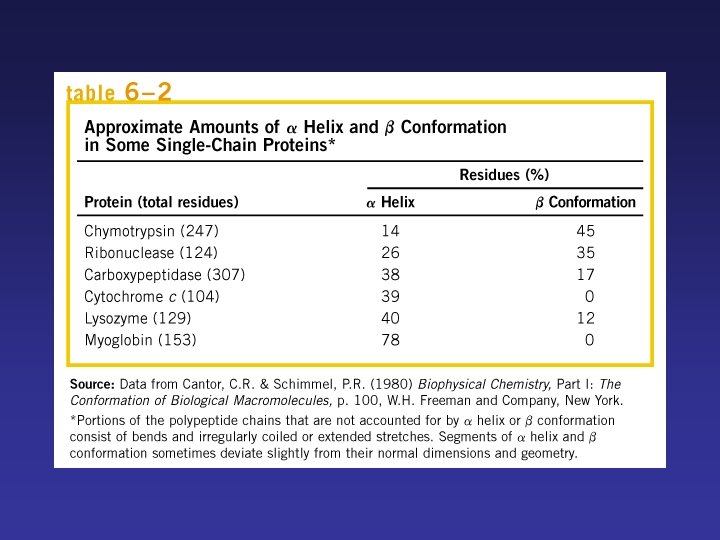
α-Hélice Cadena se enrolla alrededor de un eje imaginario. Rota hacia la derecha. Cadena laterales hacia afuera. Se caracteriza por puentes de hidrógeno internos. Cada vuelta del α-hélice se mantiene a vueltas adyacentes por 3 ó 4 puentes de hidrógeno.

Hélice

Afectan la estabilidad del α-hélice 1. repulsión o atracción electrostática 2. tamaño grupos R 3. interacciones entre grupos R con tres o cuatro residuos separados 4. presencia de Pro (rigidez y tamaño) y Gly ( flexibilidad, se enrolla diferente) 5. interacción entre terminales y dipolo eléctrico inherente a la cadena.


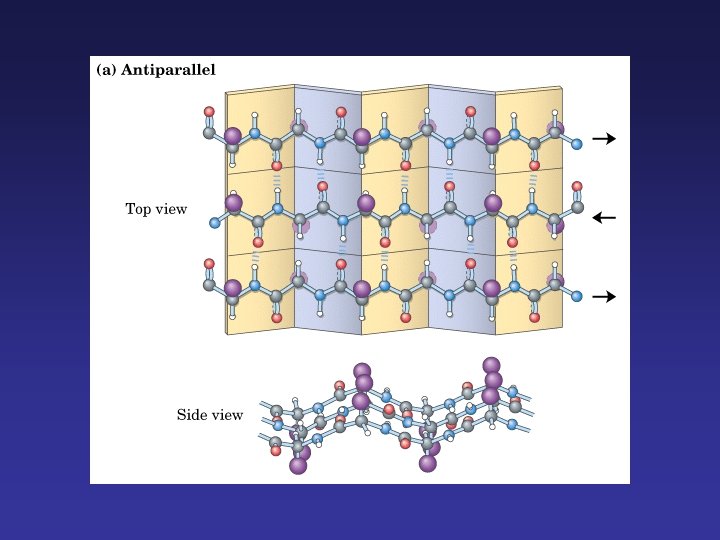
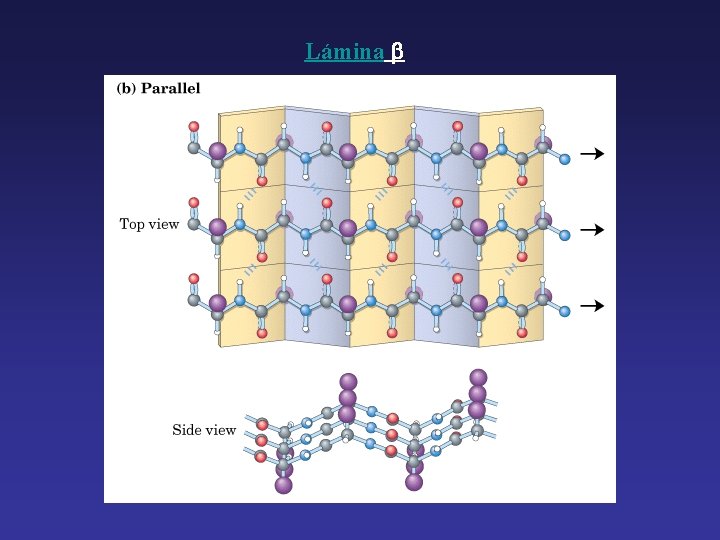
Lámina


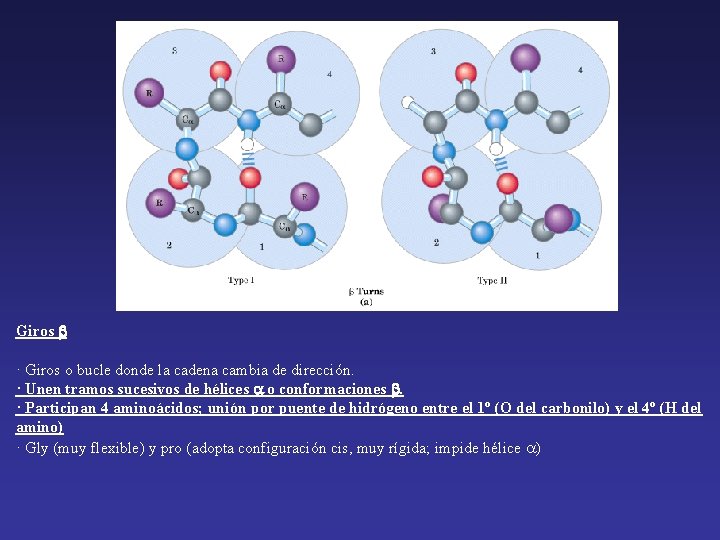
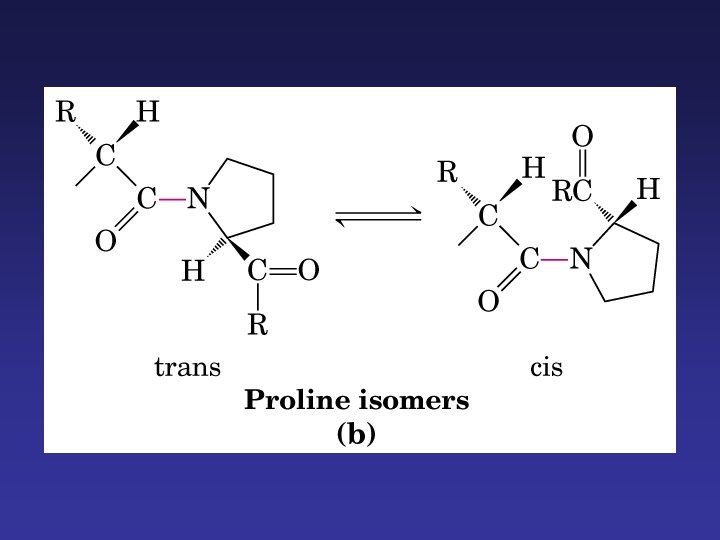
Giros · Giros o bucle donde la cadena cambia de dirección. · Unen tramos sucesivos de hélices o conformaciones . · Participan 4 aminoácidos; unión por puente de hidrógeno entre el 1º (O del carbonilo) y el 4º (H del amino) · Gly (muy flexible) y pro (adopta configuración cis, muy rígida; impide hélice )


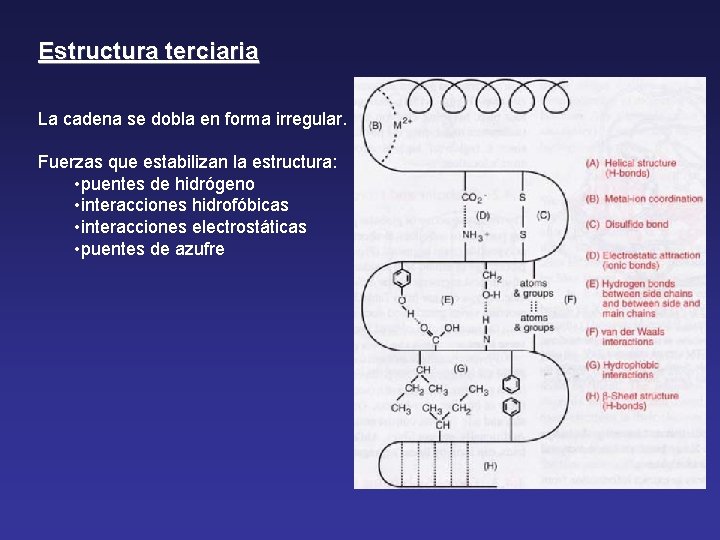
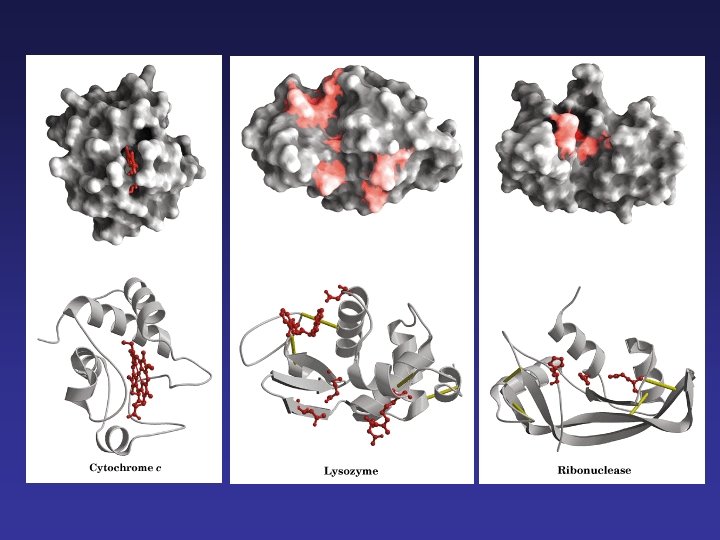
Estructura terciaria La cadena se dobla en forma irregular. Fuerzas que estabilizan la estructura: • puentes de hidrógeno • interacciones hidrofóbicas • interacciones electrostáticas • puentes de azufre

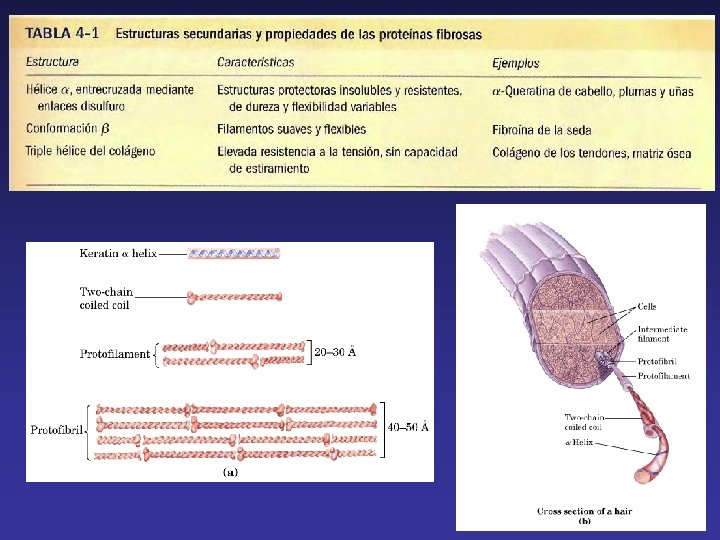
Las proteínas se pueden clasificar por su forma molecular y solubilidad. FIBROSAS UN TIPO DE ESTRUCTURA SECUNDARIA SOPORTE, FORMA Y PROTECCION EXTERNA INSOLUBLES EN AGUA GLOBULARES ESFERICAS O GLOBULARES VARIOS TIPOS DE ESTRUCTURA SECUNDARIA ENZIMAS Y PROTEINAS DE REGULACION SOLUBLES EN AGUA


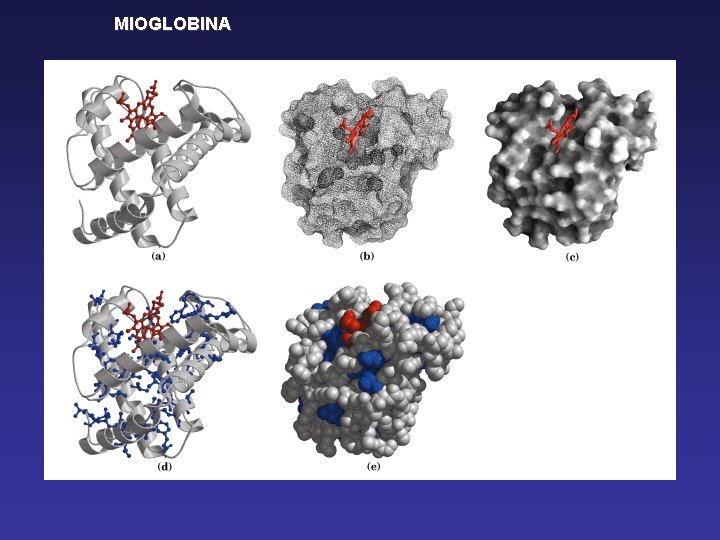
MIOGLOBINA




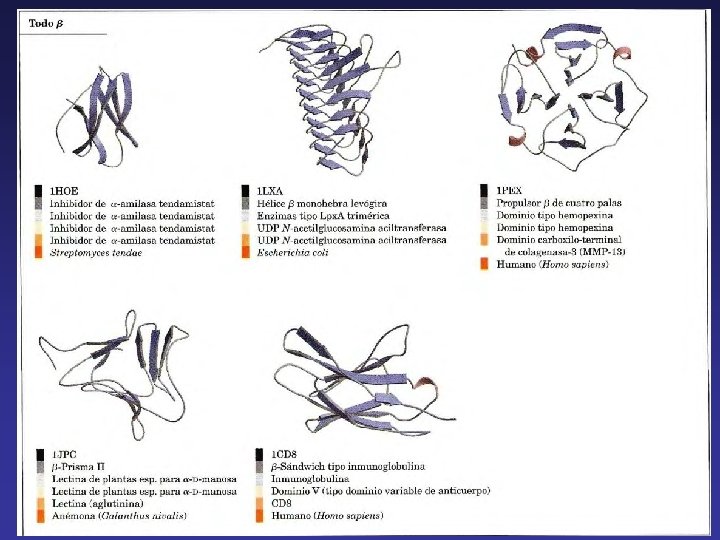
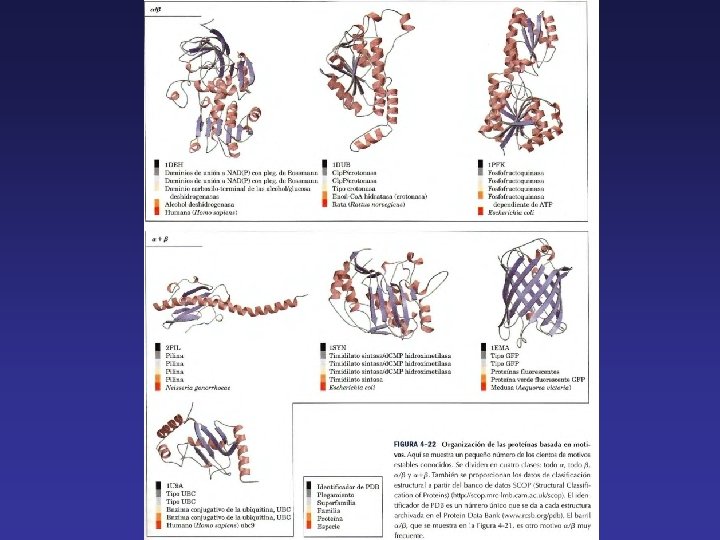
Las estructuras secundarias no se combinan al azar sino que, antes de alcanzar la estructura terciaria, siguen una serie de patrones que se repiten entre los distintos tipos de proteínas. Estos patrones reciben el nombre de motivos estructurales, plegamientos o bien estructuras supersecundarias. La estructura supersecundaría puede tener una determinada función o simplemente pertenecer a unidad funcional mayor denominada dominio. Por otro lado, el mismo tipo de estructura supersecundaria puede tener diferente función en proteínas diferentes. Las distintas estructuras supersecundarias pueden estar formadas sólo por hélices α, sólo por hojas ß o por una combinación de ambos.





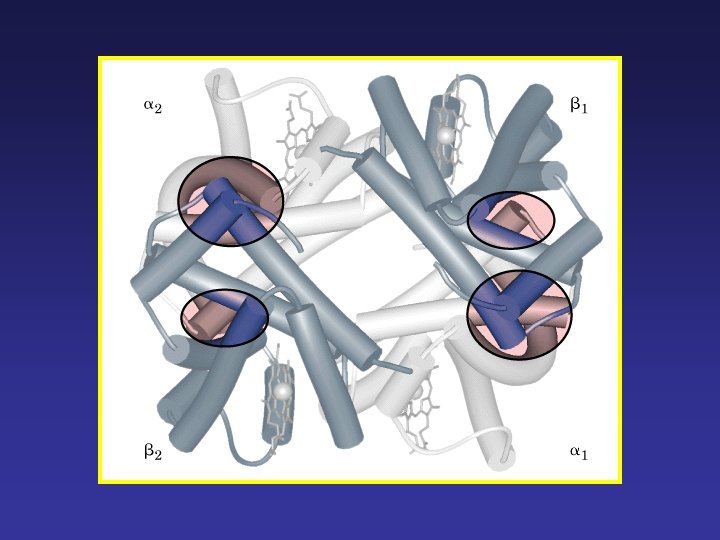
Estructura cuaternaria Es la conformación tridimensional de las subunidades que forman la proteína. Disposición de las distintas subunidades polipeptídicas que forman parte de una proteína multimérica La interacción entre las distintas subunidades da lugar a la proteína funcional. Fuerzas que estabilizan la estructura: • puentes de hidrógeno • interacciones hidrofóbicas • interacciones electrostáticas • puentes de azufre


Cambio en la conformación de la proteína: consecuencias patológicas Priones: Las encefalopatías espongiformes transmisibles son enfermedades mortales producidas por el depósito de agregados proteínico 0 s insolubles en células neurales. Enfermedad de alzheimer: debida al plegado erróneo de una proteína endógena cerabral, el b-amiloide. hélice hoja b Talasemia b: se produce por defectos genéticos que alteran la síntesis de una de las subunidades polipeptídicas de la hemoglobina.