Szerves kmia A sznhidrognek s halognezett szrmazkaik A

















































- Slides: 65

Szerves kémia A szénhidrogének és halogénezett származékaik

A szerves kémia tárgya A szerves kémia a szénvegyületek kémiája. A szerves kémia a szénvegyületek szerkezetének, sajátosságainak, átalakíthatóságának és előfordulásainak vizsgálatával foglalkozik.

A szerves kémia története Kezdetek (… – 1750) • nevek kialakulása • megfigyelések • adatok gyűjtése • kísérletezés (pl. : izolálás, kivonatok készítése) Ókor • • • „alkoholos” erjedés az ókori Egyiptomban már számtalan szerves vegyületet ismernek (ecet, bor stb. ) Arisztotelész külön említi a kőzetekből és az élőlényekből származó vegyületeket bőrcserzés bíborfestés (India, i. e. 2500)

Középkor • alkímia • „aranycsinálás” • „életelikszír” Alkotó korszak (1751 • rendszerezés • „szaknyelv” kialakulása • kísérletezés: izolálás, szintézis • elméletek és modellek megalkotása

1777 - Bergmann: vegyületek felosztása szervetlen és szerves anyagokra 1824, 1828 - Wöhler: kísérletei megdöntik a „Vis vitalis” elvet. (Sóskasav és karbamid előállítása szervetlen anyagokból. ) Friedrich Wöhler (1800 1882) 1830 - Berzelius: Az izoméria felfedezése és a szerves kémia fogalmának bevezetése. Jons Jacob Berzelius (1779– 1848)

1865 – Kekulé: A szénláncok gyűrűvé záródhatnak. August Kekulé 1829 - 1896 1874 – van’t Hoff és Le Bel: A metánban a szénatom kötései egy tetraéder csúcsai felé irányulnak. Jacobus van 't Hoff 1852 - 1911 Joseph Achille Le Bel 1847 - 1930

Modern korszak • Kísérletek és megfigyelések a korábbi tapasztalatok, elméletek és modellek alapján. • Az új tapasztalatok alapján az elméletek, modellek módosítása. • Gyors fejlődés a kémia tudományában. Új módszerek: • Elválasztástechnikai módszerek (pl. : kromatográfiák) • Szerkezetvizsgálati módszerek • Izotóptechnika

A szénatom molekulaképző sajátosságai 1. A szénatom kis atomtörzsű és közepes elektronegativitású elem. EH-H: 436 k. J/mol 2. A szénatom négy erős kovalens kötés kialakítására képes. EC-C: 344 k. J/mol ESi-Si: 187 k. J/mol EN-N: 159 k. J/mol 3. A szénláncokká, gyűrűkké kapcsolódva stabil molekulákat képeznek. • A létrejövő molekulák nagy stabilitásúak. • A molekulák stabilitása nem csökken a szénatomszám növekedésével. • Egyszeres és többszörös kötések kialakulására is lehetőség van.

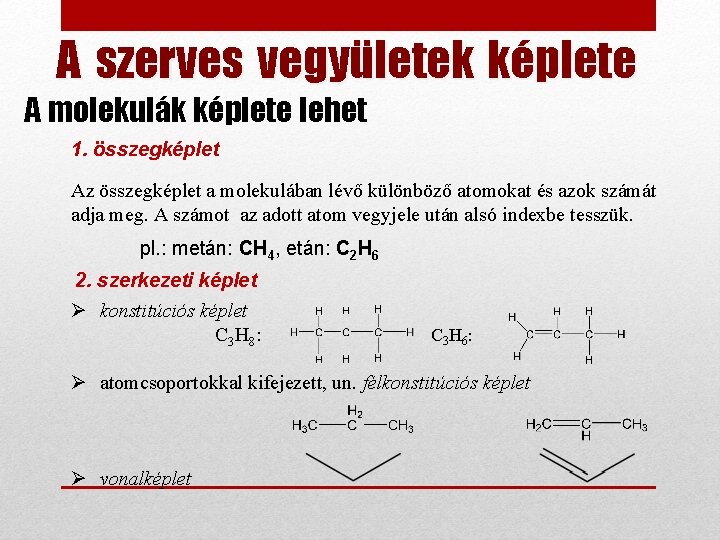
A szerves vegyületek képlete A molekulák képlete lehet 1. összegképlet Az összegképlet a molekulában lévő különböző atomokat és azok számát adja meg. A számot az adott atom vegyjele után alsó indexbe tesszük. pl. : metán: CH 4, etán: C 2 H 6 2. szerkezeti képlet Ø konstitúciós képlet C 3 H 8 : C 3 H 6 : Ø atomcsoportokkal kifejezett, un. félkonstitúciós képlet Ø vonalképlet

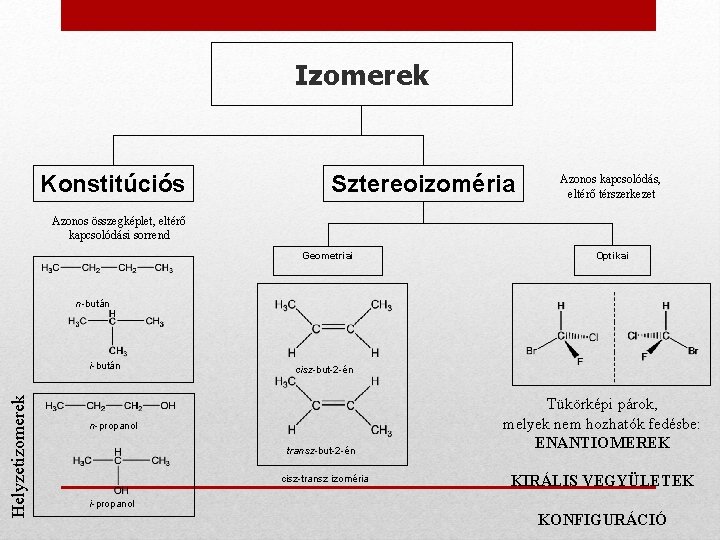
A szerves vegyületek szerkezete • Konstitúció: az atomok egymáshoz való kapcsolódásának sorrendje Pl. CH 3 -O-CH 3 vagy CH 3 -CH 2 -OH • Konfiguráció: az atomok térbeli elhelyezkedése (időben nem változó) Pl. • Konformáció: a molekulában különböző, egymással nem kapcsolódó atomok egymáshoz viszonyított térbeli elrendeződése (időben változhat) Izoméria: Azonos összegképlet mellett eltérő szerkezet

Izomerek Konstitúciós Sztereoizoméria Azonos kapcsolódás, eltérő térszerkezet Azonos összegképlet, eltérő kapcsolódási sorrend Geometriai Optikai n-bután Helyzetizomerek i-bután cisz-but-2 -én n-propanol transz-but-2 -én cisz-transz izoméria Tükörképi párok, melyek nem hozhatók fedésbe: ENANTIOMEREK KIRÁLIS VEGYÜLETEK i-propanol KONFIGURÁCIÓ

Szerves vegyületek csoportosítása 1. Molekulák szénváza szerint a) Szénlánc alakja szerint • Nyílt láncú (láncvégi szénatomok vannak) • Zárt láncú (láncvégi szénatomok nincsenek) b) Szénatomok közötti kötések szerint • Telített (csak σ-kötések) • Telítetlen (σ- és π-kötések) • Aromás (delokalizált π-elektronszextett) C) Szénatom rendűsége szerint • • Elsőrendű (primer) Másodrendű (szekunder) Harmadrendű (tercier) Negyedrendű (kvaterner)

Szerves vegyületek csoportosítása 2. Molekulák összetétele szerint A) Atomok minősége szerint • Szénhidrogének • Heteroatomos vegyületek B) Funkciós csoport szerint • • Hidroxivegyületek Oxovegyületek Éterek Karbonsavak Észterek Aminok Amidok

Fontosabb szerves vegyülettípusok Szénhidrogének: • • alifás telített (metán, propán, bután, …) alifás telítetlen (etén, etin, …) aromás (benzol, toluol, naftalin) halogénezett szénhidrogének Oxigéntartalmú vegyületek: • • • hidroxivegyületek (metanol, fenol) éterek (dietil-éter) aldehidek, ketonok (acetaldehid, aceton) karbonsavak (ecetsav) észterek szénhidrátok Nitrogéntartalmú vegyületek: • aminok (metil-amin, anilin) • aminosavak • amidok Műanyagok: • természetes alapú műanyagok (kaucsuk) • mesterséges alapú műanyagok (PVC, neylon)

Szénhidrogének Telített szénhidrogének Jellemzők: • Név: alkánok, paraffinok, összegképlet: Cn. H 2 n+2 • csak egyszeres (s) kovalens kötéseket tartalmaznak - nyílt láncú: nincs elágazás (bután) - elágazó: izobután - gyűrűs: cikloalkánok, cikloparaffinok (ciklohexán) • Apolárisak, vízzel nem, de egymással elegyenek. Szerves oldószerekben oldódnak • Savakkal, lúgokkal, oxidálószerekkel nem reagálnak. • Oxigén jelenlétében hőfelszabadulás közben elégnek: Cn. H 2 n+2 + (1, 5 n+0, 5)O 2 = n. CO 2 + (n+1)H 2 O Térszerkezet (konformáció): • Az atomok igyekeznek minél távolabb elhelyezkedni egymástól: a szemben levő kötések 60º-os (torziós) szöget zárnak be: axiális ekvatoriális

Telített szénhidrogének • Homológ sort alkotnak (olyan vegyületek sorozata, amelyeknek általános összegképlete megegyezik, és a sor egymást követő tagjai azonos atomcsoporttal különböznek egymástól) • A telített szénhidrogének nevét a szótő utáni -án szótaggal képezzük. • Jellemző reakciójuk a SZUBSZTITÚCIÓ (olyan kémiai reakció, melynek során egy molekula valamely atomja vagy atomcsoportja más atommal vagy atomcsoporttal helyettesítődik) Pl. : metán klórozása: CH 4 +Cl 2 CH 3 Cl +Cl 2 CH 2 Cl 2 +Cl 2 CHCl 3 +Cl 2 CH 3 Cl + HCl CH 2 Cl 2 + HCl CHCl 3 + HCl CCl 4 + HCl • Előfordulásuk: fölgáz, kőolaj • Előállításuk: frakcionált kondenzációval vagy frakcionált kondenzációval

Metán (CH 4)… …a legegyszerűbb szénhidrogén.

Fizikai tulajdonságai • Molekulaszerkezete: tetraéderes • Alakja: szimmetrikus → apoláris molekula (noha a C-H kötések poláris kovalens kötések!!!) → apoláris oldószerekben (pl. : benzinben, toluolban) jól oldódik → a molekulák között gyenge diszperziós kölcsönhatás van → standardállapotban gáz halmazállapotú • Színtelen, szagtalan, a levegőnél kisebb sűrűségű gáz. • A levegővel robbanóelegyet képez!

Kémiai tulajdonságai • Reakciókészsége: közönséges körülmények között az égést leszámítva kevéssé reakcióképes. 1. Égés: A metán tökéletes égése során szén-dioxid és víz képződik: CH 4 + 2 O 2 = CO 2 + 2 H 2 O (exoterm reakció) 2. Hőbontás Oxigénmentes atmoszférában, 500 °C feletti hőmérsékleten a metán gyökök* (pl. : • CH 3) képződése közben bomlik. Az acetilént iparilag a metán hőbontásával állítják elő: 2 CH 4 → C 2 H 2 + 3 H 2 *Gyökök: párosítatlan elektront tartalmazó atomok, vagy atomcsoportok.

Kémiai tulajdonságai 3. Reakció vízgőzzel: A metán magas (1000 °C) hőmérsékleten, katalizátor (Ni) jelenlétében a vízgőzzel reagál: CH 4 + H 2 O = CO + 3 H 2 szintézisgáz 4. Klórozás (tágabb értelemben halogénezés) UV sugárzás, vagy magas hőmérséklet (300 °C) hatására a metán reakcióba lép a klórgázzal: CH 4 + Cl 2 CH 3 Cl + HCl (ún. gyökös szubsztitúciós reakció) Szintézisgáz: a szén-monoxid és a hidrogén különböző arányú elegyei.

Előfordulás • A metán a földgáz és a mocsárgáz fő alkotója. • Előfordul: (szén)bányák légterében, bélgázokban, atmoszférában… (üvegházhatású gáz ) Felhasználás • fontos vegyiparai alapanyag (szintézisgáz gyártás, klór-metánok) • fűtés (szén kokszolásakor keletkező, régebben „városi gáz”-ként használt elegy: kb. 40% metán) • rakéta hajtóanyag • elektromos áram előállítás (metán égetésével) • alternatív üzemanyag (compressed natural gas)

A kőolaj és a földgáz A földgáz: a földkéregben előforduló, főként kis szénatomszámú (C 1 -C 4) szénhidrogéneket tartalmazó gázelegy. • • színtelen, szagtalan gyúlékony fő alkotója a metán megtalálhatók benne egyéb szerves és szervetlen gázok is, pl. : etán, propán, bután, CO 2, H 2 S, N 2, He metán (CH 4) 97% etán (C 2 H 6) 0, 919% propán (C 3 H 8) 0, 363% bután (C 4 H 10) 0, 162% szén-dioxid (CO 2) 0, 527% oxigén (O 2) 0 -0, 08% nitrogén (N 2) 0, 936% nemesgázok: Ar, He, Ne, Xe nyomelemként

A kőolaj a földkéregben előforduló folyékony, főként telített szénhidrogének elegye. Összetétele… • • …nagymértékben függ a lelőhelytől. Főként alkánok, cikloalkánok és aromás szénhidrogének alkotják. Oxigén-, nitrogén- és kéntartalmú szerves vegyületek is jelen vannak. Nyomokban különféle fémeket is tartalmaz, pl. : Fe, Ni, Cu, V. Elem Százalék tartomány szén 83 -85% hidrogén 10 -14% nitrogén 0, 1 -2% Szénhidrogének Átlag Tartomány alkánok 30% 15 -60% 49% 30 -60% oxigén 0, 05 -1, 5% cikloalkánok (naftének) kén 0, 05 -6, 0% aromások 15% 3 -30% aszfaltének 6% maradék fémek < 0, 1%

Feldolgozás és felhasználás Földgáz • tüzelőanyagként hasznosítják (ipar, háztartás) • nyersanyag szerves vegyületek ipari előállításához • alternatív üzemanyag Kőolaj • Laborban: frakcionált desztilláció • Iparban: frakcionált kondenzáció (szakaszos lecsapás) Termék Kőolajpárlatok: Szénatomszám Forráspont tartomány (°C) gáz 1 -4 < 20 nyersbenzin 4 -10 20 -200 kerozin 19 -16 175 -275 gázolaj (dízelolaj) 15 -25 200 -400 kenőolaj 20 -70 > 350 nehéz fűtőolaj 20 -70 > 350 aszfalt (pakura) maradék

Szénhidrogének Telítetlen szénhidrogének A telítetlen szénhidrogének molekuláiban kettős vagy hármas kötéssel kapcsolódó szénatompárok vannak. • Alkének (egy kettős kötésű olefinek) • Diének, poliének (kettő vagy több kettős kötést tartalmazó szénhidrogének) • Alkinek (hármas kötésű, acetilén-szénhidrogének) Mindkét csoportban lehetnek nyíltláncú és gyűrűs molekulák is.

Szénhidrogének Telítetlen szénhidrogének Kémiai tulajdonságok: A kettős kötésben a p-kötés könnyen felszakítható, a p elektronok azután egyszeres skötést képeznek. • Égés: világító, kormozó lánggal: C 2 H 4 + 3 O 2 = 2 CO 2 + 2 H 2 O részben tökéletlen égés: C 2 H 4 + 2 O 2 = CO 2 + 2 H 2 O + C (korom, izzás) • Enyhe oxidáció H 2 O 2 -vel: • Addíció: R-CH=CH-R’ + H 2 = R-CH 2 -R’ (Ni ill. Pt katalizátor jelenlétében) R-CH=CH-R’ + HCl = R-CH 2 -CHCl-R’ • Polimerizáció: egy telítetlen vegyület sok azonos molekulája egyesül melléktermék képződése nélkül: n. CH 2=CH 2 = -(CH 2 -CH 2)n- (300 ºC-on Ziegler-Natta katalizátor Al-, Ti, V- vegyületek keveréke) 1963 Nobel-díj Nagyobb olefinek polimerizációja: • Butadién: CH 2=CH-CH=CH 2 polimerizálva (műkaucsuk): -(H 2 C-CH=CH-CH 2)n-

Telítetlen szénhidrogének Nevezéktan Alkének : 1. Hagyományos nevük: olefinek 2. Szabályos kémiai nevük: alkének 3. Elnevezésük: Ø Az olefinek szabályos neve -én szótagra végződik. Ø A főlánc mindig tartalmaz kettős kötést, s a kettős kötés szénatomjainak kell a lehető legkisebb számot kapniuk. Ø A vegyület nevében a kettőskötés helyét a kettős kötéssel összekapcsolt két szénatom számai közül a kisebbikkel tüntetjük fel. 4. Összegképletük: Cn. H 2 n

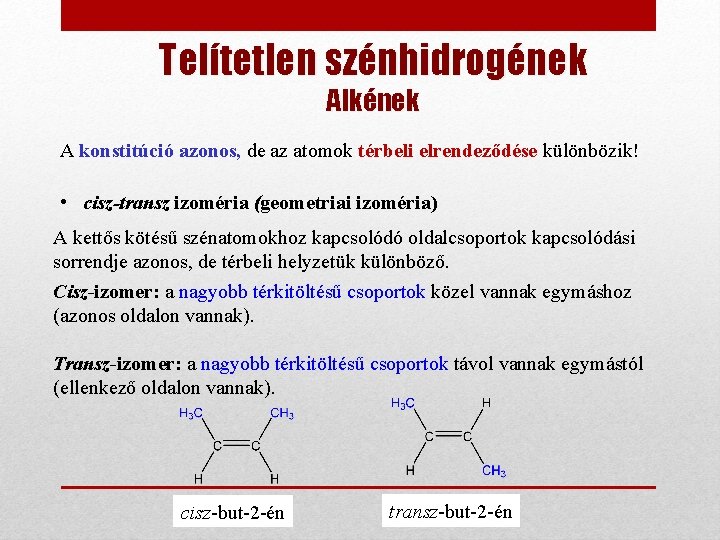
Telítetlen szénhidrogének Alkének A konstitúció azonos, de az atomok térbeli elrendeződése különbözik! • cisz-transz izoméria (geometriai izoméria) A kettős kötésű szénatomokhoz kapcsolódó oldalcsoportok kapcsolódási sorrendje azonos, de térbeli helyzetük különböző. Cisz-izomer: a nagyobb térkitöltésű csoportok közel vannak egymáshoz (azonos oldalon vannak). Transz-izomer: a nagyobb térkitöltésű csoportok távol vannak egymástól (ellenkező oldalon vannak). cisz-but-2 -én transz-but-2 -én

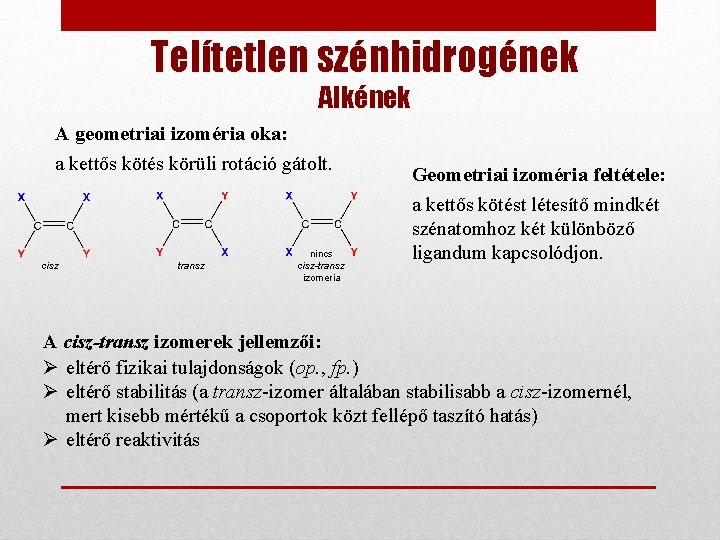
Telítetlen szénhidrogének Alkének A geometriai izoméria oka: a kettős kötés körüli rotáció gátolt. cisz transz nincs cisz-transz izomeria Geometriai izoméria feltétele: a kettős kötést létesítő mindkét szénatomhoz két különböző ligandum kapcsolódjon. A cisz-transz izomerek jellemzői: Ø eltérő fizikai tulajdonságok (op. , fp. ) Ø eltérő stabilitás (a transz-izomer általában stabilisabb a cisz-izomernél, mert kisebb mértékű a csoportok közt fellépő taszító hatás) Ø eltérő reaktivitás

Telítetlen szénhidrogének Alkének Fizikai tulajdonságok: Az alkánokéhoz hasonló (hasonló szerkezet és moláris tömeg): • Apolárisak, vízben nem oldódnak, kicsi a sűrűségük. • Alacsony op. , fp. , mely a molekulatömeg növekedésével nő. • Halmazállapotuk szobahőmérsékleten: • C 2 -C 3: gáz • C 4 -C 10: folyadék • > C 11: szilárd

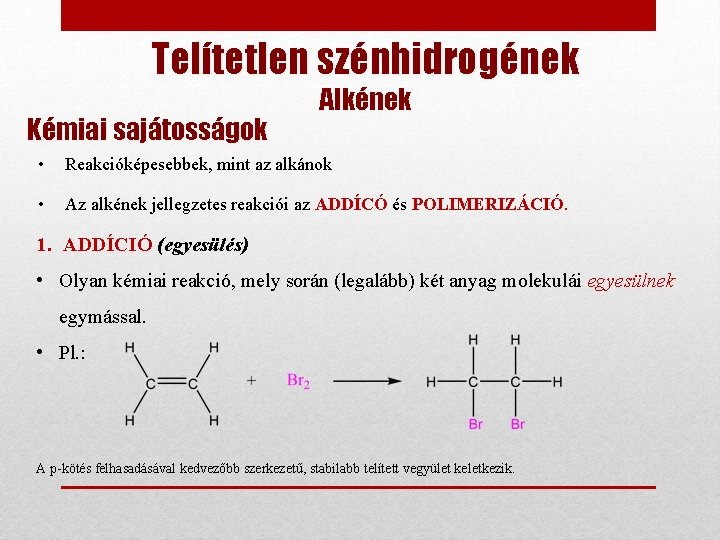
Telítetlen szénhidrogének Kémiai sajátosságok Alkének • Reakcióképesebbek, mint az alkánok • Az alkének jellegzetes reakciói az ADDÍCÓ és POLIMERIZÁCIÓ. 1. ADDÍCIÓ (egyesülés) • Olyan kémiai reakció, mely során (legalább) két anyag molekulái egyesülnek egymással. • Pl. : A p-kötés felhasadásával kedvezőbb szerkezetű, stabilabb telített vegyület keletkezik.

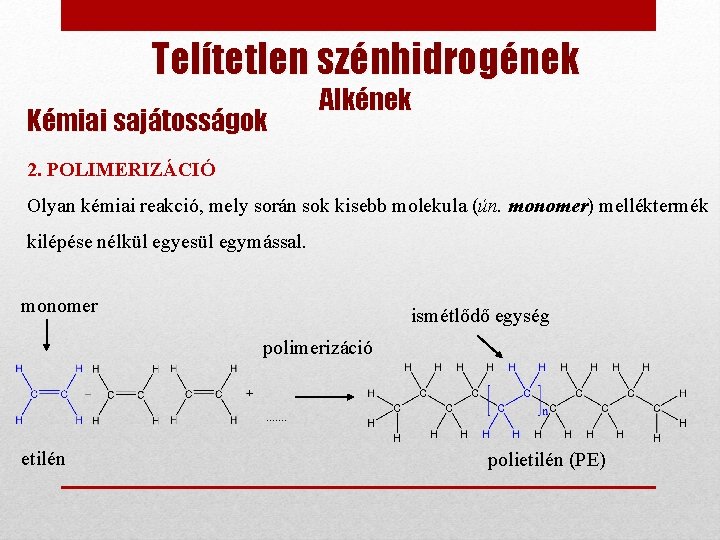
Telítetlen szénhidrogének Kémiai sajátosságok Alkének 2. POLIMERIZÁCIÓ Olyan kémiai reakció, mely során sok kisebb molekula (ún. monomer) melléktermék kilépése nélkül egyesül egymással. monomer ismétlődő egység polimerizáció etilén polietilén (PE)

Telítetlen szénhidrogének Alkének Kémiai sajátosságok Előfordulásuk A természetben ritkábban fordulnak elő mint az alkánok (reakcióképesebbek), de kis mennyiségben a földgáz és kőolaj tartalmaz alkéneket is. Ipari előállításuk magas forráspontú kőolajpárlatok krakkolásával. CH 3 -Cn. H 2 n-CH 2ζ-CH 2 -CH 3 → CH 3 -Cn. H 2 n-CH 3 + CH 2=CH 2 Felhasználásuk műanyagipari alapanyagok (pl. : etilén, propilén, izobutilén).

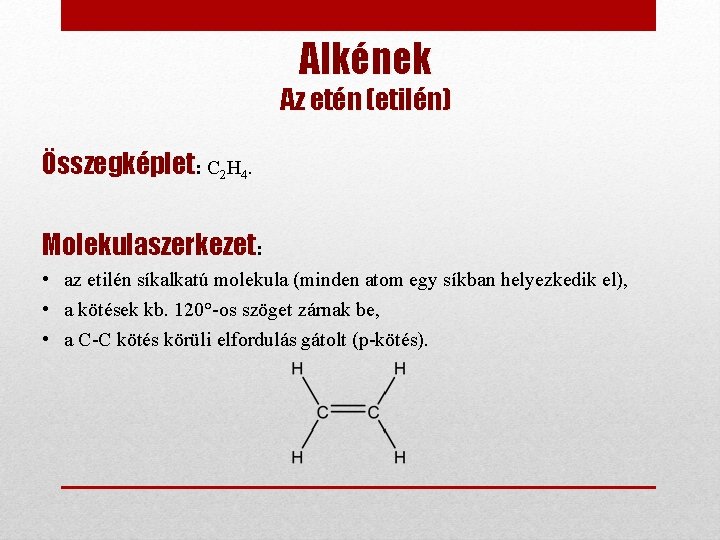
Alkének Az etén (etilén) Összegképlet: C 2 H 4. Molekulaszerkezet: • az etilén síkalkatú molekula (minden atom egy síkban helyezkedik el), • a kötések kb. 120°-os szöget zárnak be, • a C-C kötés körüli elfordulás gátolt (p-kötés).

Alkének Az etén (etilén) Fizikai tulajdonságok: • színtelen, • édeskés szagú, • kis sűrűségű gáz, • molekulái apolárisak, (szimmetrikus) ezért Ø apoláris oldószerekben jól oldódik, Ø molekulái között gyenge diszperziós kölcsönhatás van, Ø alacsony op. és fp.

Alkének Az etén (etilén) Kémiai tulajdonságok: • Nagyon reakcióképes vegyület, mivel a gyenge p-kötés könnyen felszakítható. • Jellemző reakciói: Ø Addíció: C 2 H 4 + Br 2 C 2 H 4 Br 2 Ø Polimerizáció: n. C 2 H 4 (C 2 H 4)n Ø Égés: C 2 H 4 + 3 O 2 2 CO 2 + 2 H 2 O

Alkének Előfordulás: Az etén (etilén) A természetben ritkán fordul elő (mivel reakcióképes). Előállítás: • iparban: alkánok krakkolásával (kőolaj és földgáz feldolgozás során). • laboratóriumban: etanolból vízelvonással: CH 3 -CH 2 -OH H 2 SO 4 Felhasználás: • PE gyártás • vegyipari alapanyaggyártás CH 2=CH 2 + H 2 O

Több kettős kötést tartalmazó szénhidrogének Elnevezésük: • hasonló mint az alkéneké… • Ha a vegyület több kettős kötést tartalmaz, azt a névben a di-, tri- stb. előtagokkal jelezzük. Ø diének (alkadiének) Ø triének (alkatriének) Ø… Ø poliének (alkapoliének)

Az alkadiének A kettőskötések helyzete alapján megkülönböztetünk: • kumulált dién: R–CH=C=CH–R R : hidrogén vagy alkilcsoport (a két kettőskötés egymás mellett van) R–CH=CH–R • konjugált dién: (a két kettős kötés között egyszeres C-C kötés van) R–CH=CH–(CH 2)n–CH=CH–R • izolált dién: (a két kettős kötés között legalább két egyszeres C-C kötés van) • A kumulált diének kevésbé stabilisak, mint izolált vagy konjugált izomerjeik. • A kettős kötések konjugált elhelyezkedése növeli a relatív stabilitást és a reakciókészséget! • Az izolált diének hasonlóan viselkednek, mint az egyszeres kettős kötést tartalmazó alkének.

Az izoprénvázas vegyületek • A gumigyártás latex kicsapás és töményítés természetes kaucsuk vulkanizálás gumi Ø A vulkanizálás során a természetes kaucsukot néhány % (3 -5%) kénporral összegyúrják, majd 130 -140 °C-ra hevítik. Ø Vulkanizáláskor ún. kénhidak alakulnak ki a szomszédos poliizoprén láncok között, ezáltal a gumi térhálós szerkezetű lesz. Ø Ez a térhálós szerkezet teszi a gumit rugalmassá.

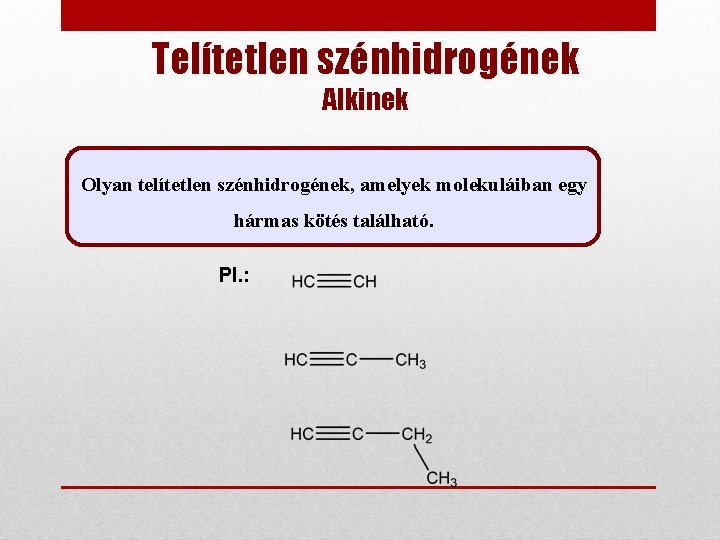
Telítetlen szénhidrogének Alkinek Olyan telítetlen szénhidrogének, amelyek molekuláiban egy hármas kötés található. Pl. :

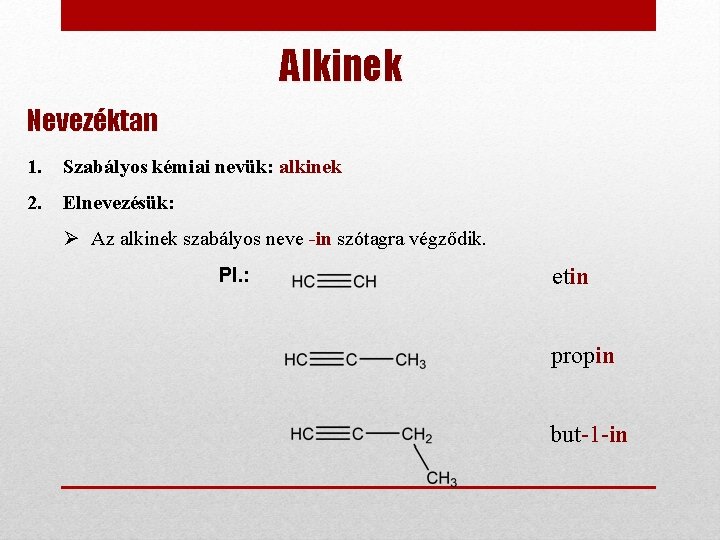
Alkinek Nevezéktan 1. Szabályos kémiai nevük: alkinek 2. Elnevezésük: Ø Az alkinek szabályos neve -in szótagra végződik. Pl. : etin propin but-1 -in

Alkinek Izoméria: • Szerkezeti izoméria: az izomerek a láncelágazásokban és a háromszoros kötés helyében is különbözhetnek egymástól. Pl. : C 6 H 8 hex-1 -in és izomerjei hex-2 -in és izomerjei hex-3 -in

Alkinek Fizikai tulajdonságok: Az alkénekéhez hasonló. • Apolárisak, vízben gyakorlatilag nem oldódnak, kicsi a sűrűségük. • Alacsony op. , fp. , melyek a molekulatömeg növekedésével növekednek. Kémiai tulajdonságok: az alkénekéhez hasonló • Nagyon reakcióképesek • Jellemző reakciói: Ø Addíció: C 2 H 2 + 2 Br 2 C 2 H 2 Br 4 Ø Polimerizáció: n. C 2 H 4 (C 2 H 4)n Ø Égés: C 2 H 4 + 3 O 2 • . 2 CO 2 + 2 H 2 O

Acetilén (etin) Összegképlet: C 2 H 2. Molekulaszerkezet: • Az acetilén molekula lineáris. • A szén-szén hármas kötést egy σ- és két π-kötés alkotja. Fizikai tulajdonságok: • Színtelen, szagtalan gáz. • Molekulái apolárisak (szimmetrikus), ezért Ø vízben rosszul oldódik, Ø apoláris oldószerekben és acetonban jól oldódik, Ø alacsony az op. , fp. • Nyomás hatására könnyen felrobban, s elemeire bomlik. Ø Acetonnal átitatott kovaföldet tartalmazó palackokban tárolják és hozzák forgalomba, ez az ún. DISSZUGÁZ („oldott gáz”).

Acetilén (etin) Kémiai tulajdonságok: • Nagyon reakcióképes vegyület, mivel a π-kötések könnyen felszakíthatók. • Jellemző reakciói: ü Égés (erősen kormozó láng): 2 C 2 H 2 + 5 O 2 = 4 CO 2 + 2 H 2 O ü addíció PVC: poli(vinil-klorid) gyártás

Acetilén (etin) Előállítása: • Ipari: metán hőbontásával (krakkolásával): 1200 °C 2 CH 4 C 2 H 2 + 3 H 2 • Laboratóriumi: kalcium-karbidból vízzel 2: Ca. C 2 + 2 H 2 O C 2 H 2 + Ca(OH)2 Felhasználása: • hegesztés és lángvágás (az acetilén-oxigén keverékének lángja akár 3300 °C is lehet) • vegyipari alapanyag: pl. : vinil-vegyületek, acetaldehid, poliacetilén gyártás alapanyaga • (karbidlámpa) [2] Rózsahegyi M. és Wajand J. : Látványos kémiai kísérletek (Mozaik Oktatási Stúdio – Szeged 1999) 227. old.

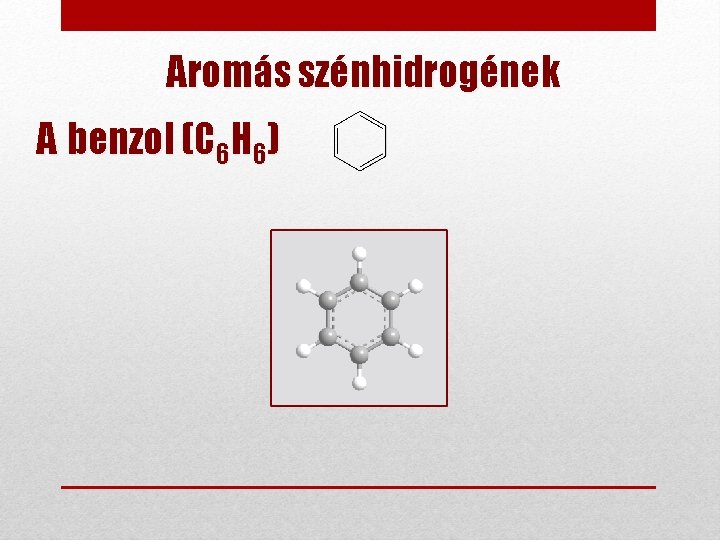
Aromás szénhidrogének Gyűrűs, telítetlen szénhidrogének, melyek szerkezetében egy vagy több benzolgyűrű található: Benzol (C 6 H 6) jellemzői: • Aromás: 6 elektron által alkotott gyűrűsen delokalizált p-elektronszextett • Annyira stabil, hogy – az alkénektől eltérően – telítetlen jellege ellenére nagyon nehezen vihető addíciós reakcióba. Fe, 50 CºC • Szubsztitúciós reakció: C 6 H 6 + Br 2 6 H 5 Br + HBr • Fenilcsoport: C 6 H 5 - csoport • Előfordulás: kőszénkátrányban, előállítás ebből 85 ºC-on desztillációval. • Felhasználás: oldószer, aromás vegyületek kiinduló anyaga Sztirol (vinil-benzol): C 6 H 6 -CH=CH 2 • Benzol és alkének reakcióit is adja → polimerizálható • Felhasználás: polisztirol gyártása

Aromás szénhidrogének • Régen: illatos vegyületek összefoglaló neve (egyes benzolszármazékokat illatos növényi balzsamokból izoláltak) • Formailag: folytonos konjugált kettőskötés-rendszert tartalmazó gyűrűs vegyületek (π-elektronszextett) • Az aromás szénhidrogének a benzolból származtathatók oly módon, hogy a benzol egy vagy több hidrogénatomját szénhidrogén-csoportra cseréljük. Aromásnak tekintünk minden olyan vegyületet, amely Ø gyűrűs szerkezetű, Ø a gyűrűt felépítő atomok egy síkban helyezkednek el, Ø a gyűrű(k)ben lévő delokalizált p-elekronok száma 4 n+2 (ahol n egész szám).

Az aromás vegyületek típusai • aromás szénhidrogének • policiklusok (több gyűrűből álló aromás vegyületek) • szubsztituált benzolszármazékok • aromás heterociklusos vegyületek

Aromás szénhidrogének Aromás sajátosságok • nehezen késztethetők addíciós reakcióra, • nehezen oxidálhatók, • jellemző reakciójuk a szubsztitúció. Izoméria • szerkezeti izoméria: van (pl. : orto-, meta-, para-xilol és az etilbenzol, összegképlet: C 8 H 10) • cisz-transz izoméria: az oldallánctól függ…

Aromás szénhidrogének Fizikai tulajdonságok • Apolárisak, vízben gyakorlatilag oldhatatlanok. • Folyadék állapotban a víznél kisebb a sűrűségük. • Molekulatömegükhöz képest alacsony az op. és fp. (melyek a moláris tömeg növekedésével nőnek). • Színtelenek, szagtalanok vagy jellegzetes szagúak. Kémiai tulajdonságok • Szubsztitúció az aromás gyűrűn (pl. : halogének, HNO 3). • Szubsztitúció vagy addíció az oldalláncon (az oldallánctól és a körülményektől függően).

Aromás szénhidrogének A benzol (C 6 H 6)

Tudod-e, hogy… Aromás szénhidrogének Benzol Szerkezete • A benzol gyűrűs molekulája síkalkatú (a molekula minden atomja egy síkban helyezkedik el). 120° • Kötésszögek: 120° • Minden C–C kötéshossz azonos. • A p-elektronok egyenletesen oszlanak el a Catomok által alkotott hatszög alatt és felett, ez az ún. delokalizált elektronrendszer). 120°

Aromás szénhidrogének Benzol Fizikai tulajdonságok • • • Színtelen, jellegzetes szagú folyadék. Sűrűsége kisebb mint a vízé. Op. : 5, 5 °C; fp. : 80, 1 °C. Apoláris, vízzel alig elegyedik. Alkohollal és egyéb szerves oldószerekkel korlátlanul elegyedik. • Mérgező, rákkeltő!!!

Aromás szénhidrogének Benzol Kémiai tulajdonságok • Erősen kormozó lánggal ég. • Tökéletes égésekor szén-dioxid és víz képződik: 2 C 6 H 6 + 15 O 2 = 12 CO 2 + 6 H 2 O • Szubsztitúciós reakcióba vihető pl. : halogénekkel, kénsavval, salétromsavval. kat. Pl. : C 6 H 6 + Br 2 → C 6 H 5 Br + HBr

Aromás szénhidrogének Benzol Előfordulása: kőszénkátrányban, és a kőolajban kis koncentrációban Előállítása: • kőolaj krakkolásával • kőszén kokszosításának egyik mellékterméke Felhasználása: • fontos vegyipari alapanyag (festékek, robbanóanyagok, műanyagok, mosóporok, gyógyszerek) • adalékanyag (pl. : oktánszám növelő) • kiváló oldószer • (régen: after shave…)

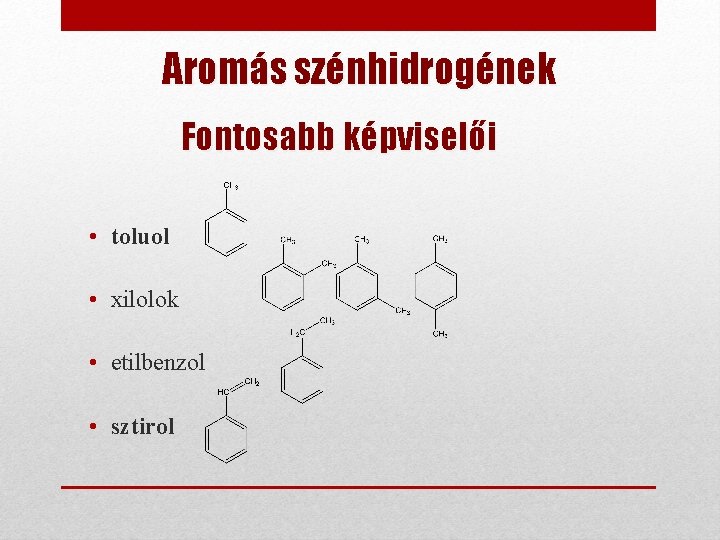
Aromás szénhidrogének Fontosabb képviselői • toluol • xilolok • etilbenzol • sztirol

Aromás szénhidrogének Policiklusos aromás szénhidrogének naftalin antracén • A hidrogénatomok száma kisebb, mint a szénatomoké. • Előfordulásuk: pl. koromban, kátrányban. • Számos PAH állatkísérletekben bizonyítottan rákkeltő. fenantrén

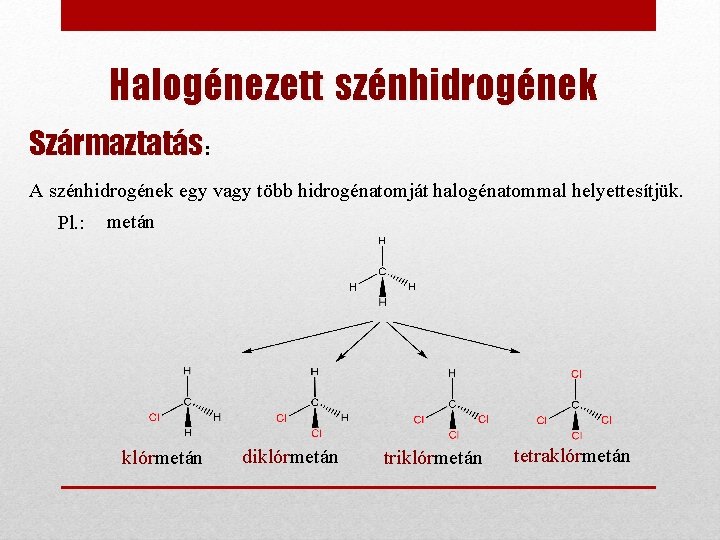
Halogénezett szénhidrogének Származtatás: A szénhidrogének egy vagy több hidrogénatomját halogénatommal helyettesítjük. Pl. : metán klórmetán diklórmetán triklórmetán tetraklórmetán

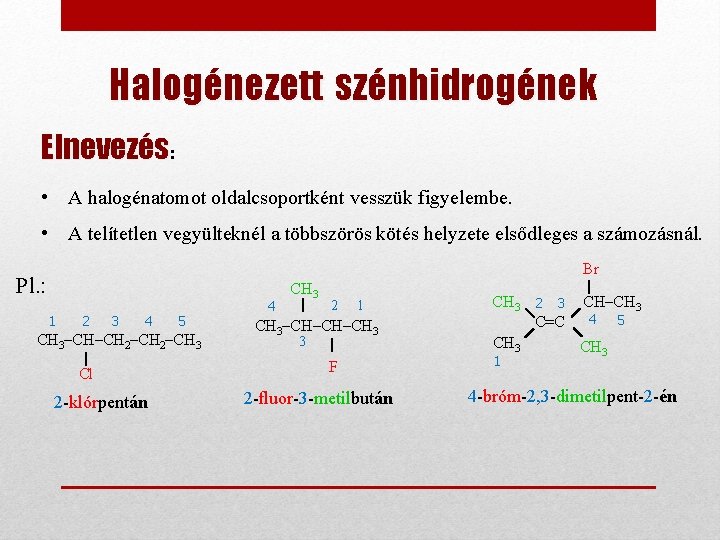
Halogénezett szénhidrogének Elnevezés: • A halogénatomot oldalcsoportként vesszük figyelembe. • A telítetlen vegyülteknél a többszörös kötés helyzete elsődleges a számozásnál. Br Pl. : 1 2 3 4 5 CH 3–CH–CH 2–CH 3 Cl 2 -klórpentán 4 CH 3 2 1 CH 3–CH–CH–CH 3 3 F 2 -fluor-3 -metilbután CH 3 2 3 CH–CH 3 4 5 C=C CH 3 1 4 -bróm-2, 3 -dimetilpent-2 -én

Halogénezett szénhidrogének Molekulaszerkezet • Általában kicsit polárisak (kivéve a teljesen szimmetrikus molekulák, pl. : CCl 4). Fizikai tulajdonságok • Oldhatóság: Általában apoláris oldószerekben oldódnak, vízben alig oldódónak (nem képesek hidrogénkötések kialakítására). • Op. , fp. : Az azonos szénatomszámú szénhidrogénekénél magasabb (nagyobb moláris tömeg, poláris vegyületek esetében: dipól-dipól kölcsönhatás). Standard állapotban csak a legkisebb moláris tömegű képviselőik gázok. • A sok halogént tartalmazó vegyületek a víznél nagyobb sűrűségűek. • Általában színtelenek, és jellegzetes szagúak.

Halogénezett szénhidrogének Kémiai tulajdonságok Jellemző reakcióik: Szubsztitúció: Pl. : CH 3–CH 2–Cl + Na. OH → CH 3–CH 2–OH + Na. Cl klóretán etanol Elimináció (addícióval ellentétes folyamat): Olyan kémiai reakció, amely során egy vegyületből kisebb molekula kilépése közben új vegyület képződik. Pl. : CH 3–CH 2–Cl klóretán cc. Na. OH hő CH 2=CH 2 + HCl etén

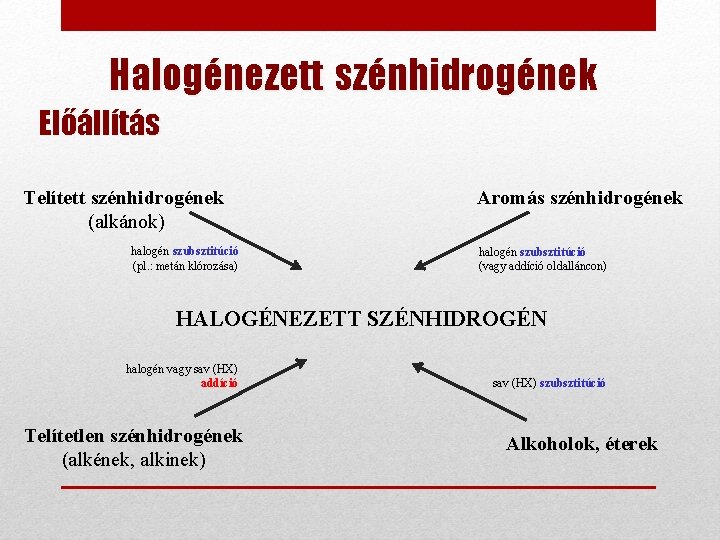
Halogénezett szénhidrogének Előállítás Telített szénhidrogének (alkánok) halogén szubsztitúció (pl. : metán klórozása) Aromás szénhidrogének halogén szubsztitúció (vagy addíció oldalláncon) HALOGÉNEZETT SZÉNHIDROGÉN halogén vagy sav (HX) addíció Telítetlen szénhidrogének (alkének, alkinek) sav (HX) szubsztitúció Alkoholok, éterek

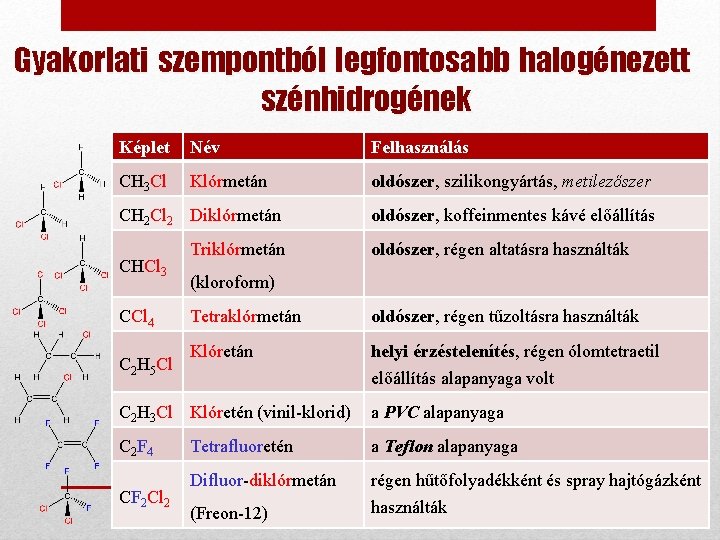
Gyakorlati szempontból legfontosabb halogénezett szénhidrogének Képlet Név Felhasználás CH 3 Cl Klórmetán oldószer, szilikongyártás, metilezőszer CH 2 Cl 2 Diklórmetán CHCl 3 CCl 4 C 2 H 5 Cl Triklórmetán oldószer, koffeinmentes kávé előállítás oldószer, régen altatásra használták (kloroform) Tetraklórmetán oldószer, régen tűzoltásra használták Klóretán helyi érzéstelenítés, régen ólomtetraetil előállítás alapanyaga volt C 2 H 3 Cl Klóretén (vinil-klorid) a PVC alapanyaga C 2 F 4 Tetrafluoretén a Teflon alapanyaga Difluor-diklórmetán régen hűtőfolyadékként és spray hajtógázként használták CF 2 Cl 2 (Freon-12)