9 Elads Sznhidrognek alknok 19 Sznhidrognek 19 1



![Fizikai tulajdonságok 1. Halmazállapot [jellemzői: olvadáspont, forráspont] 2. Kölcsönhatás fénnyel szín 3. forgatás [a] Fizikai tulajdonságok 1. Halmazállapot [jellemzői: olvadáspont, forráspont] 2. Kölcsönhatás fénnyel szín 3. forgatás [a]](https://slidetodoc.com/presentation_image_h/b36b12e75dd811bb870fba538c6a8fcc/image-11.jpg)




- Slides: 18

9. Előadás Szénhidrogének - alkánok

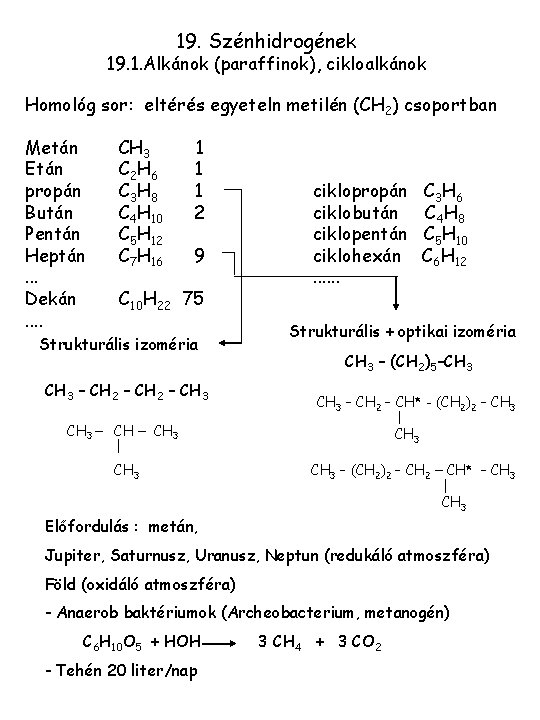
19. Szénhidrogének 19. 1. Alkánok (paraffinok), cikloalkánok Homológ sor: eltérés egyeteln metilén (CH 2) csoportban Metán Etán propán Bután Pentán Heptán. . . Dekán. . CH 3 C 2 H 6 C 3 H 8 C 4 H 10 C 5 H 12 C 7 H 16 1 1 1 2 9 C 10 H 22 75 Strukturális izoméria CH 3 – CH 2 – CH 3 ciklopropán ciklobután ciklopentán ciklohexán. . . Strukturális + optikai izoméria CH 3 – (CH 2)5–CH 3 – CH 2 – CH* - (CH 2)2 – CH 3 CH 3 C 3 H 6 C 4 H 8 C 5 H 10 C 6 H 12 CH 3 – (CH 2)2 – CH* – CH 3 Előfordulás : metán, Jupiter, Saturnusz, Uranusz, Neptun (redukáló atmoszféra) Föld (oxidáló atmoszféra) - Anaerob baktériumok (Archeobacterium, metanogén) C 6 H 10 O 5 + HOH - Tehén 20 liter/nap 3 CH 4 + 3 CO 2

Előfordulás PB gáz Petroléter C 1 C 2 70 -90% C 3 C 4 C 5 C 6 C 7 ~10% KÖNNYŰ BENZIN összes izomer n: i=2: 1 Izooktán, oktánszám C 8 C 9 C 10 C 11 C 12 Diesel FÖLDGÁZ C 16 cetánszám, cetán C 18 KENŐOLAJ MOTORBENZIN feromon C 22 C 26 Vazelin C 34 C 27 C 29 C 31 C 35 C 38 C 37 C 30 VIASZOK Polietilén almahéj káposztalevél méhviasz

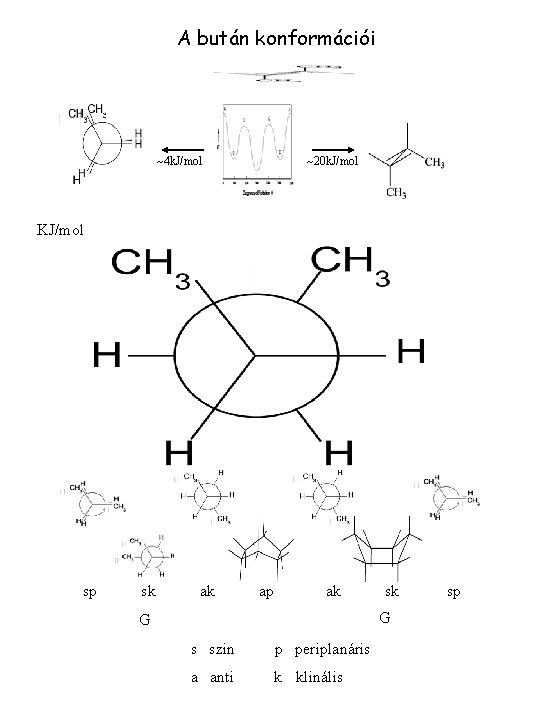
Az alkánok szerkezete KÖTÉS MÓD C(sp 3) - H(s) KÖTÉSHOSSZ r (C – C)=1. 54 Å r (C – H)=1. 09Å KÖTÉSSZÖG CCC HCH 109 o (CH 4) 109 o 112 o SZÖGFESZÜLTSÉG: 10 o TORZULÁS ~7. 1 k. J/mol KÖTÉSI ENERGIA 360 k. J/mol KONFIGURÁCIÓ TETRAÉDERES KONFORMÁCIÓ ZEG-ZUGOS lásd: bután konformációanalízise

A bután konformációi 4 k. J/mol 20 k. J/mol KJ/mol sp sk ak ap ak sk G G s szin p periplanáris a anti k klinális sp

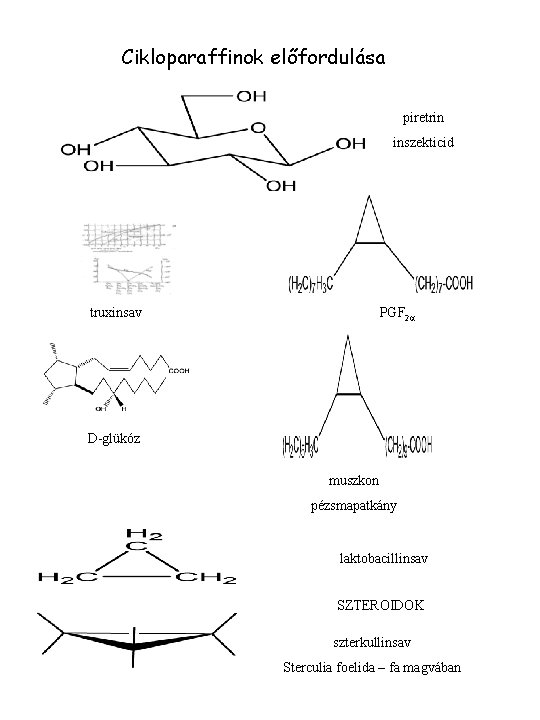
Cikloparaffinok előfordulása piretrin inszekticid truxinsav PGF 2 a D-glükóz muszkon pézsmapatkány laktobacillinsav SZTEROIDOK szterkullinsav Sterculia foelida – fa magvában

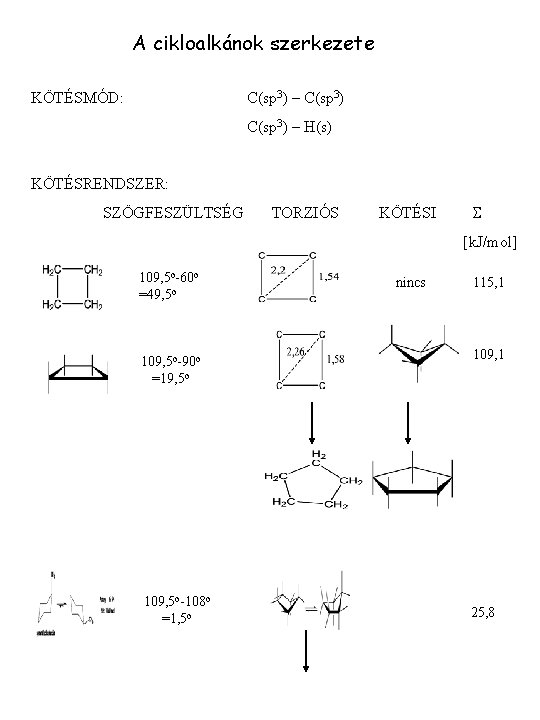
A cikloalkánok szerkezete KÖTÉSMÓD: C(sp 3) – H(s) KÖTÉSRENDSZER: SZÖGFESZÜLTSÉG TORZIÓS KÖTÉSI S [k. J/mol] 109, 5 o-60 o =49, 5 o 109, 5 o-90 o =19, 5 o 109, 5 o-108 o =1, 5 o nincs 115, 1 109, 1 25, 8

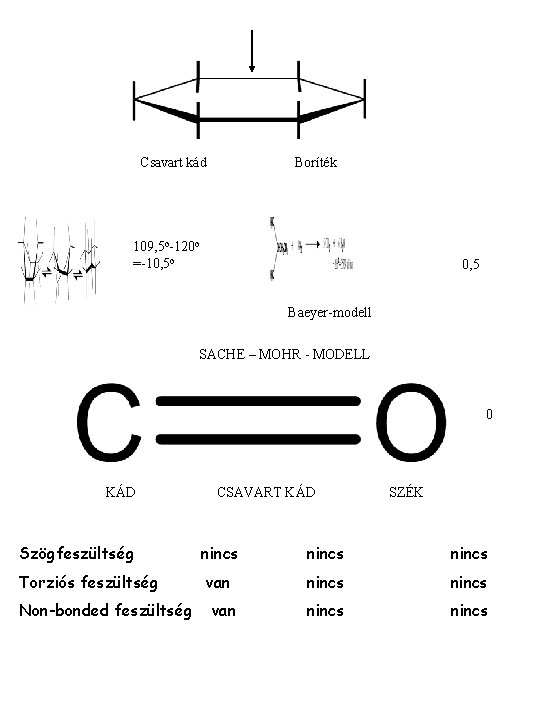
Csavart kád Boríték 109, 5 o-120 o =-10, 5 o 0, 5 Baeyer-modell SACHE – MOHR - MODELL 0 KÁD CSAVART KÁD SZÉK Szögfeszültség nincs Torziós feszültség van nincs Non-bonded feszültség van

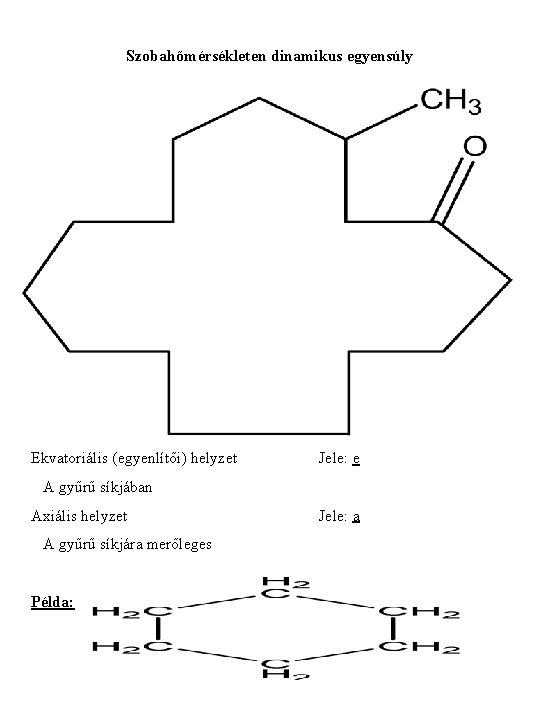
Szobahőmérsékleten dinamikus egyensúly Ekvatoriális (egyenlítői) helyzet Jele: e A gyűrű síkjában Axiális helyzet A gyűrű síkjára merőleges Példa: Jele: a

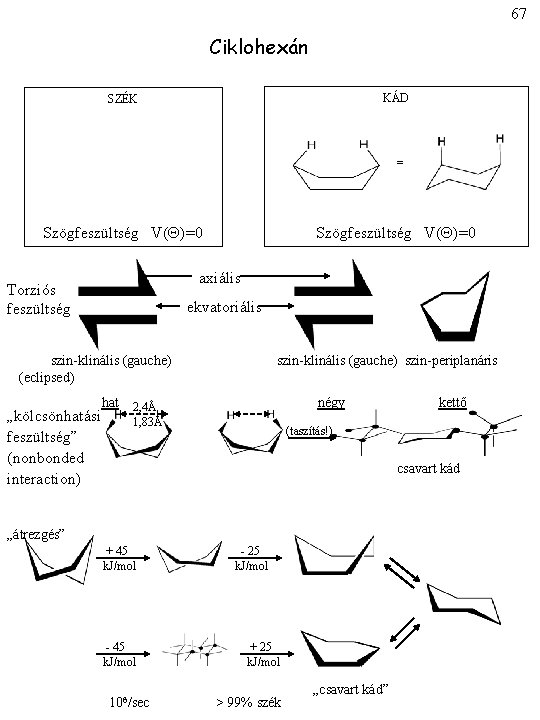
67 Ciklohexán KÁD SZÉK = Szögfeszültség V( )=0 axiális Torziós feszültség ekvatoriális szin-klinális (gauche) (eclipsed) „kölcsönhatási feszültség” (nonbonded interaction) hat szin-klinális (gauche) szin-periplanáris négy 2, 4Å 1, 83Å kettő (taszítás!) csavart kád „átrezgés” + 45 k. J/mol - 45 k. J/mol 106/sec - 25 k. J/mol + 25 k. J/mol > 99% szék „csavart kád”
![Fizikai tulajdonságok 1 Halmazállapot jellemzői olvadáspont forráspont 2 Kölcsönhatás fénnyel szín 3 forgatás a Fizikai tulajdonságok 1. Halmazállapot [jellemzői: olvadáspont, forráspont] 2. Kölcsönhatás fénnyel szín 3. forgatás [a]](https://slidetodoc.com/presentation_image_h/b36b12e75dd811bb870fba538c6a8fcc/image-11.jpg)
Fizikai tulajdonságok 1. Halmazállapot [jellemzői: olvadáspont, forráspont] 2. Kölcsönhatás fénnyel szín 3. forgatás [a] 4. törésmutató n 5. de: nem kötésfelbontás 3. Szag 4. Oldékonyság [oldószer, hőmérséklet, nyomás] 5. Sűrűség [hőmérséklet] HALMAZÁLLAPOT - Kohéziós erők C 1 -4 gáz C 5 -16 folyadék van der Waals kötőerők C 17 szilárd kristályrács: semleges molekulák OLDÉKONYSÁG Hasonló hasonlót old Pl: Apoláros oldószerben (benzol, éter) v. kevéssé poláros

Cikloparaffinok és paraffinok fizikai adatainak különbsége

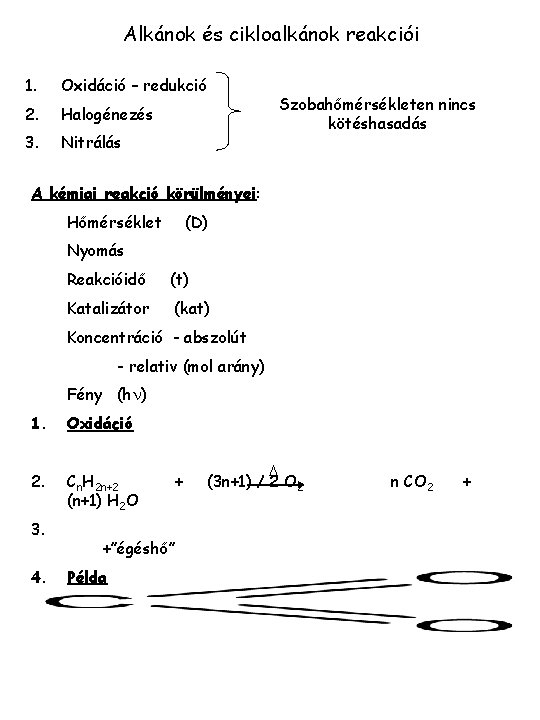
Alkánok és cikloalkánok reakciói 1. Oxidáció – redukció 2. Halogénezés 3. Nitrálás Szobahőmérsékleten nincs kötéshasadás A kémiai reakció körülményei: Hőmérséklet (D) Nyomás Reakcióidő (t) Katalizátor (kat) Koncentráció - abszolút - relativ (mol arány) Fény (hn) 1. Oxidáció 2. Cn. H 2 n+2 (n+1) H 2 O 3. 4. +”égéshő” Példa + D (3 n+1) / 2 O 2 n CO 2 +

Oxidácó szám Tegyük fel, hogy az O oxidációs száma – 2 és a H oxidációs száma +1 Ekkor a C oxidációs száma: Metán CH 4 -4 Metanol CH 3 OH -2 Formaldehid CH 2 O 0 Hangyasav HCOOH +2 Széndioxid CO 2 +4 Redukált forma: CH 4 Oxidált forma: CO 2 Alkalmazás: a. > b. ENx > ENc > Oxidációs szám növelő CH 4 + Cl 2 ENx < ENc (ox) CH 3 Cl + HCl Oxidációs szám csökkentő CH 3 Cl + 2 Li CH 3 Li + Li. Cl

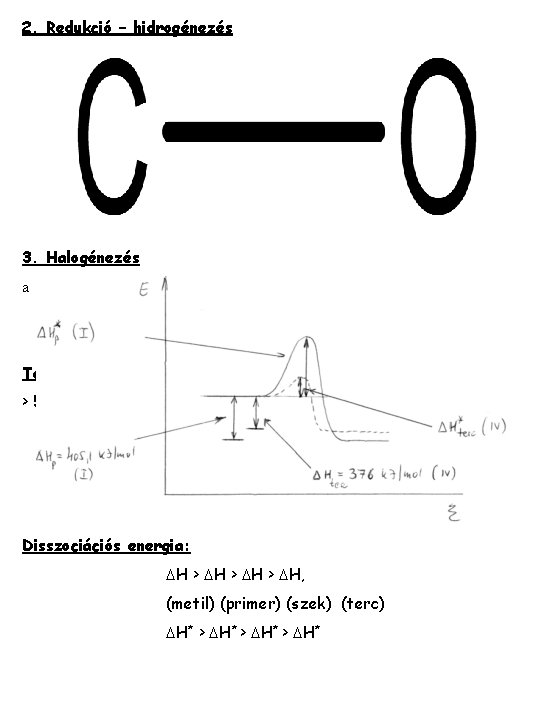
2. Redukció – hidrogénezés 3. Halogénezés a Termékarány > 500 o. C 50 -25 -16, 7 -8, 3% „statisztikus” 300 o. C 30 -15 -33 -22% ˇirányított Disszociációs energia: DH > DH, (metil) (primer) (szek) (terc) DH* > DH*

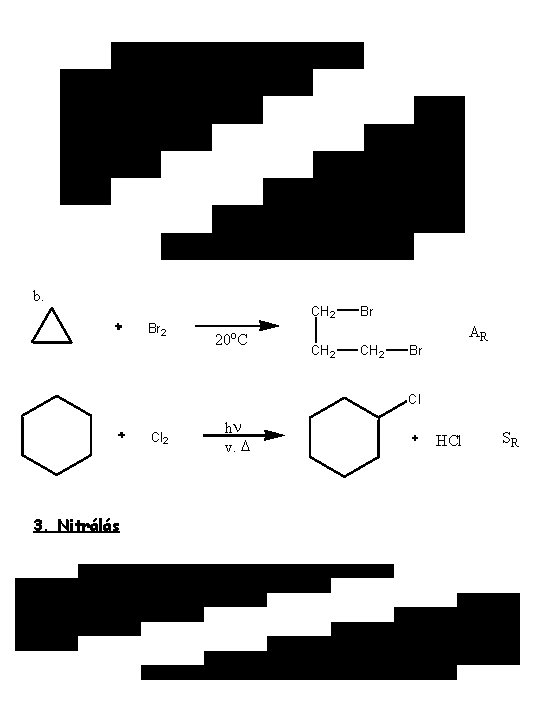
b. CH 2 Br 2 20 o. C Br AR CH 2 Br Cl Cl 2 3. Nitrálás hn v. D HCl SR