Oxigntartalm szerves vegyletek II sszetett funkcis csoportot tartalmaz






















- Slides: 25

Oxigéntartalmú szerves vegyületek II. Összetett funkciós csoportot tartalmazó vegyületek Azok a szerves molekulák amelyekben szén- és hidrogénatomokon kívül oxigénatomot is tartalmazó funkciós csoport(ok) is van(nak). • Molekuláikban C, H és O atom található • Az oxigénatom a funkciós csoport részeként többféle módon épülhet be a molekulába • Funkciós csoport: olyan atomcsoport, amely a vegyület tulajdonságit meghatározza.

Az oxigéntartalmú szerves vegyületek csoportosítása p Egy oxigénatomos funkciós csoportot tartalmazó vegyületek n hidroxivegyületek R–OH hidroxilcsoport R–O–R étercsoport C=O oxocsoport alkoholok p fenolok p n p éterek oxovegyületek p aldehidek p ketonok R–CHO =O n formilcsoport R–C–R karbonilcsoport Összetett (oxigéntartalmú) funkciós csoportot tartalmazó vegyületek karboxilcsoport R–COOH n karbonsavak R 1–COO–R 2 észtercsoport n észterek

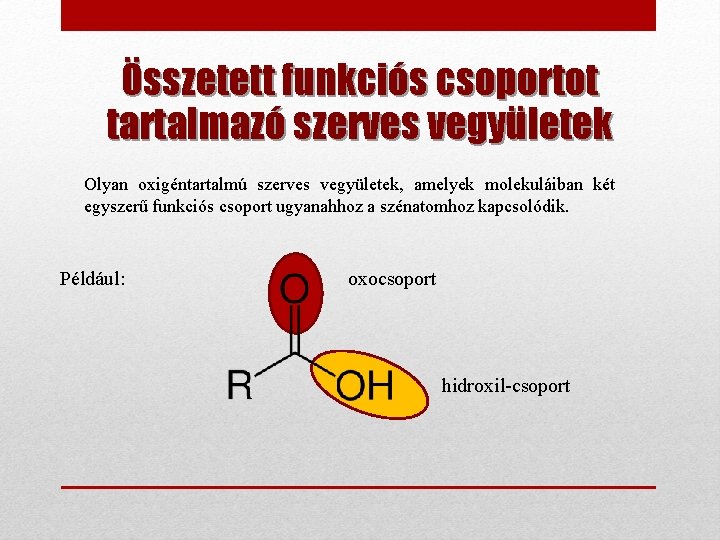
Összetett funkciós csoportot tartalmazó szerves vegyületek Olyan oxigéntartalmú szerves vegyületek, amelyek molekuláiban két egyszerű funkciós csoport ugyanahhoz a szénatomhoz kapcsolódik. Például: oxocsoport hidroxil-csoport

A karbonsavak olyan oxigéntartalmú szerves vegyületek, amelyek molekuláiban karboxilcsoport található. karbonilcsoport karboxilcsoport = O R–C – O–H hidroxilcsoport A karboxilcsoport O-H kötése erősen poláris, így H+ leadására képes

Elnevezése A karbonsavak • Néhány karbonsavnak régi eredetű neve van, és a gyakorlatban ezek a használatosak. (pl. hangyasav, tejsav, stb. ) • Az alapszénhidrogén nevéhez a -sav végződést illesztjük. • A szénhidrogénlánc szénatomszámába a karboxilcsoport szénatomját is bele kell számítani. etánsav = – – – metánsav = = • A főlánc számozását mindig a karboxilcsoport szénatomjával kezdjük. 1 O 2 3 2 1 O H–C CH 3–CH 2–C O–H O–H propánsav

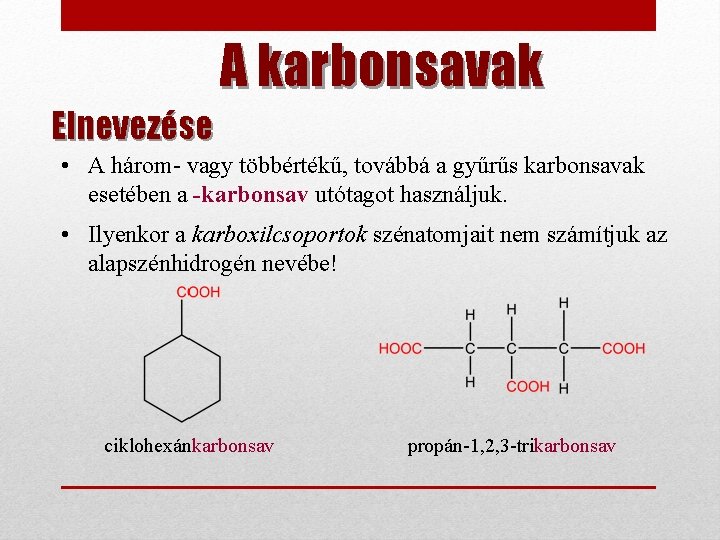
A karbonsavak Elnevezése • A három- vagy többértékű, továbbá a gyűrűs karbonsavak esetében a -karbonsav utótagot használjuk. • Ilyenkor a karboxilcsoportok szénatomjait nem számítjuk az alapszénhidrogén nevébe! ciklohexánkarbonsav propán-1, 2, 3 -trikarbonsav

A karbonsavak Csoportosítása • Szénváz jellege szerint (nyílt láncú vagy gyűrűs) • Szénatomok közötti kötések szerint (telített, telítetlen, aromás) • értékűség szerint (funkciós csoportok száma) o o egyértékű kétértékű (dikarbonsavak) háromértékű (trikarbonsavak) …

A karbonsavak Fizikai tulajdonságok • Olvadás- és forráspontjuk magas (erős hidrogénkötések!) • Halmazállapotuk folyékony (C 1 -C 10) vagy szilárd (szénatomszám, funkciós csoport számának növekedésével szilárdul) • Jellegzetes szagúak • C 4 -ig vízzel minden arányban elegyednek, de a nagy szénatomszámúak vízben nem oldódnak

A karbonsavak Kémiai tulajdonságok • Vizes oldatuk kémhatása savas (szerves vegyületek közül a legerősebb savak a karbonsavak, de gyengébbek a szervetlen savaknál) R-COOH + H 2 O � RCOO- + H 3 O+ • Saverősség a szénlánc hosszabbodásával csökken • Nehezen oxidálhatók és redukálhatók • Csak erélyes körülmények között redukálhatók, közvetlenül primer-alkohollá • A hangyasav a többi savtól eltérően redukálószerként viselkedik (molekulájában formilcsoport különíthető el) HCOOH + 2 Ag+ + 2 OH- CO 2 + 2 Ag + 2 H 2 O • Lúgokkal közömbösíthetők (sóit formiátoknak nevezzük) HCOOH + Na. OH HCOO- + Na+ + H 2 O

A karbonsavak Fontosabb képviselői Hangyasav (metánsav) - HCOOH • Színtelen, szúrósszagú folyadék. • Vízzel és alkohollal minden arányban elegyedik • A fémeket hidrogéngáz fejlődése közben oldja 2 HCOOH + Mg = 2 HCOO- + Mg 2+ + H 2 • A brómos vizet elszínteleníti HCOOH + Br 2 = 2 HBr + CO 2 • Adja az ezüsttükör-próbát HCOOH + 2 Ag+ + 2 OH- = CO 2 + 2 Ag + 2 H 2 O • Felhasználják: o gyapjú színezése o impregnálás o bőrcserzés o fahordók fertőtlenítése o reumás betegségek kezelésére

A karbonsavak Fontosabb képviselői Ecetsav (etánsav) – CH 3 -COOH • A legismertebb karbonsav, hétköznapi neve: ecet • Etil-alkohol erjedésével keletkezik CH 3 CH 2 OH + O 2 → CH 3 COOH + H 2 O • Szúrós szagú, színtelen folyadék, vízzel minden arányban elegyedik • Vizes oldata savas kémhatású CH 3–COOH + H 2 O CH 3–COO- + H 3 O+ • Lúgokkal közömbösíthető (sóit acetátoknak nevezzük): CH 3–COOH + Na. OH CH 3–COO- + Na+ + H 2 O • Vízmentes állapotában 17°C alatt megszilárdul (jégecet) • Felhasználása: o konyhában o élelmiszeriparban o műszálak előállítása o gyógyszerek, festékek gyártásához o oldószerként

A karbonsavak Fontosabb képviselői Vajsav (butánsav) – C 3 H 7 COOH • Színtelen, szúrós szagú, vízzel elegyedő folyadék. • Megtalálható a tejben, vajban (triglicerid formában, 3 -4%). • A vajsav okozza az avas vaj rossz szagát és a „testszagot”. Palmitinsav (hexadekánsav) – C 15 H 31 COOH • • A pálmazsír fő alkotója (neve is innen ered). Apoláris, ezért vízben gyakorlatilag nem oldódik. Szilárd halmazállapotú karbonsav. Lúgokkal sót képez, sói a palmitátok Sztearinsav (oktadekánsav) – C 17 H 35 COOH • A természetben leggyakrabban előforduló „zsírsav” (pl. faggyú). • Tulajdonságai a palmitinsavéhoz hasonlók. • Sói a sztearátok.

A karbonsavak sói Általános jellemzők • Ionvegyületek • Vízben jól oldódnak (akkor is, ha a sav maga nem oldódik) • Vizes oldatuk általában lúgos kémhatású • Magas olvadáspontú szilárd anyagok • A karbonsavak savmaradékionjában delokalizált pi-kötés van

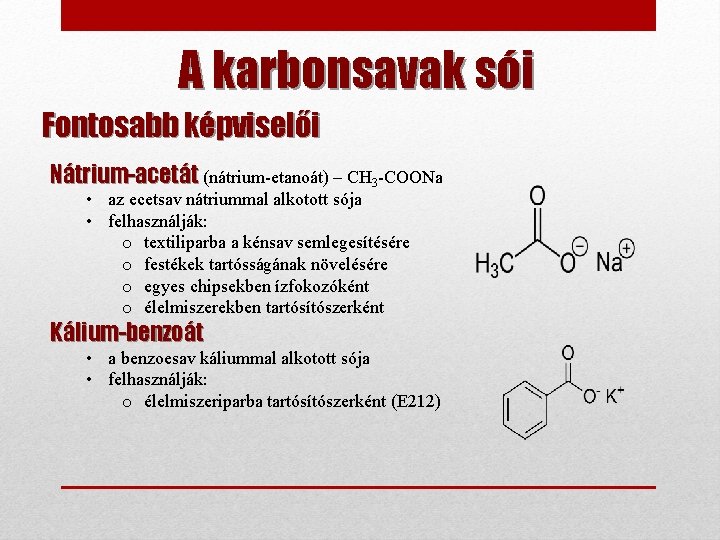
A karbonsavak sói Fontosabb képviselői Nátrium-acetát (nátrium-etanoát) – CH 3 -COONa • az ecetsav nátriummal alkotott sója • felhasználják: o textiliparba a kénsav semlegesítésére o festékek tartósságának növelésére o egyes chipsekben ízfokozóként o élelmiszerekben tartósítószerként Kálium-benzoát • a benzoesav káliummal alkotott sója • felhasználják: o élelmiszeriparba tartósítószerként (E 212)

A karbonsavak sói Nátrium-kálium-tartarát • kettős só: kálim, nátrium és borkősav reakciójából • vízben és alkoholban is oldható • felhasználják: o tükrök fényvisszaverő bevonatának készítéséhez o élelmiszeriparban tartósítószer (E 337) o emulgeálószer, stabilizátor o antioxidáns

A karbonsavak sói Szappanok (nagy szénatomszámú karbonsavak nátrium- vagy kálium sói, pl. nátrium-sztearát) • vízben kolloid oldatot képeznek • amfipatikus tulajdonságúak (kettős jellegűek): hidrofób (vízben nem oldódó) és hidrofil (vízben oldódó) • az anionok a víz felületén egyrétegű monomolekuláris hártyát (filmet) alkotnak, ezzel csökkentik a víz felületi feszültségét, fokozzák a vizes oldat habzását. • vizes közegben micellákat képeznek (ez tisztító hatásuk lényege)

Az észterek Olyan oxigéntartalmú szerves vegyületek, amelyek karbonsavból és alkoholból kondenzációval (víz kilépésével) keletkeznek. alkohol + sav észter + víz Funkciós csoportjuk az „észter-csoport” = O R–C – O–R’ Az észtercsoport egy karbonil- és egy étercsoportból álló összetett funkciós csoport.

Elnevezése Az észterek • Az alkohol szénhidrogéncsoportjának neve után a savmaradékának nevét írjuk. VAGY • A sav neve után írjuk a hidroxivegyület szénhidrogéncsoportjának nevét az észter szóval együtt. Pl. metil - formiát VAGY metil–metanoát hangyasav metilészter

Az észterek Fizikai tulajdonságok • Olvadáspont, forráspont: o sokkal alacsonyabb mint az azonos szénatomszámú karbonsavaké vagy alkoholoké o magasabb mint a megfelelő szénhidrogéneké • Halmazállapot: o C 2 -C 20 szénatomszámú észterek: folyadékok o C 20 felett: szilárdak • Vízben való oldhatóság: o Vízben alig vagy nem, apoláris oldószerekben jól oldódnak

Az észterek Kémiai tulajdonságok • Jellemző reakciójuk: hidrolízis (víz hatására bekövetkező bomlás) pl. etil-acetát hidrolízise: CH 3 -COO-CH 2 -CH 3 + H 2 O CH 3 -COOH + CH 3 -CH 2 -OH • Teljes hidrolízis Na. OH-dal az elszappanosítás Az észterek hidrolízise az észterképződéssel ellentétes irányú folyamat. Ennek során az észter víz hatására (sav vagy lúg katalízis mellett) karbonsavvá és alkohollá alakul.

Az észterek Csoportosítása • Gyümölcsészterek o Kis szénatomszámú alkoholokból és kis szénatomszámú karbonsavakból felépülő karbonsavészterek o Kis mennyiségben a gyümölcsök is tartalmazzák (ezek adják a jellemző illatot, zamatot) pl. etil-acetát � alma, málna, pentil-acetát � banán o Jó oldószerek (festék- és lakkipar felhasználja) • Telítetlen észterek o molekuláit felépítő alkoholok vagy karbonsavak telítetlen kötést tartalmaznak o telítetlen kötések mentén polimerizálhatók o fontosabb képviselői: metil-metakrilát (polimerizálva plexi) vinil-acetát (polimerizálva poli(vinil-acetát) – ragasztó)

Az észterek Csoportosítása • Viaszok o nagy és páros szénatomszámú, normális szénláncú, telített, egyértékű alkoholokból és ugyanilyen típusú karbonsavakból felépülő karbonsavészterek o vízben nem oldódnak o határozatlan olvadáspontú anyagok (nem egységesek, többféle molekula keverékei) o előfordulásuk: § levelek, gyümölcsök héján védőbevonat § méhviasz alkotóeleme (miricil-palmitát) § cipőpaszták, autófényezők alkotóeleme (karnaubaviasz) § gyógyszerek, kozmetikumok alapanyaga (lanolin)

Az észterek Csoportosítása • Zsírok és olajok (trigliceridek) o nagy szénatomszámú karbonsavak glicerinnel alkotott észterei o A zsírokban több a telített szénlánc, mint az olajokban o Az észteresítő sav: § normális szénláncú § telített vagy telítetlen § páros szénatomszámú § leggyakrabban: palmitinsav, sztearinsav és olajsav

Az észterek Csoportosítása • Zsírok és olajok (trigliceridek) o nagy szénatomszámú karbonsavak glicerinnel alkotott észterei o Nincs határozott olvadáspontjuk, csak ún. lágyulási hőmérsékletük o Vízben nem, apoláris oldószerekben jól oldódnak o Sűrűségük kisebb, mint a vízé o A tiszta zsírok és olajok színtelenek és szagtalanok o Hidrolizálnak § Lúgos hidrolízis során glicerinre és „szappanra” bomlanak (elszappanosítás) § Savas hidrolízissel glicerin és zsírsavak keletkeznek o Katalitikus hidrogénezés: a kettős kötések katalitikus hidrogénezéssel telíthetők (margaringyártás) o Élettani szerepük: § energiaforrás és tartalék tápanyag § állandó hőmérséklet fenntartása (hőszigetelő hatás, pl. bálnák, fókák) § mechanikai védelem (rezgéscsillapítás, pl. : macskák talppárnái) § A-, D-, E- és K-vitaminok (zsírban oldódó vitaminok) szervezetbe kerülésének, felszívódásának és szállíthatóságának elősegítése

Az észterek Felhasználásuk • • • mesterséges ízesítők készítése illatszerek illatanyagai műanyaggyártási alapanyagok koffeinmentes kávé gyártása (etil-acetát az egyik gyakori oldószer) robbanóanyagok előállítása (dinamit = glicerin-trinintrát) sütés-főzés…