OXIGNTARTALM SZERVES VEGYLETEK A KARBONSAVAK Az oxigntartalm szerves

OXIGÉNTARTALMÚ SZERVES VEGYÜLETEK A KARBONSAVAK

Az oxigéntartalmú szerves vegyületek csoportosítása p Egy oxigénatomos funkciós csoportot tartalmazó vegyületek n hidroxivegyületek R–OH hidroxilcsoport R–O–R étercsoport C=O oxocsoport alkoholok p fenolok p n p éterek oxovegyületek p aldehidek p ketonok R–CHO =O n R–C–R karbonilcsoport Összetett (oxigéntartalmú) funkciós csoportot tartalmazó vegyületek n karbonsavak n észterek formilcsoport

Összetett funkciós csoportot tartalmazó szénvegyületek

A karbonsavak olyan oxigéntartalmú szerves vegyületek, amelyek molekuláiban karboxilcsoport található. = O R–C karboxilcsoport – O–H Miért összetett funkciós csoport a karboxilcsoport? = O karbonilcsoport R–C – O–H hidroxilcsoport karboxilcsoport
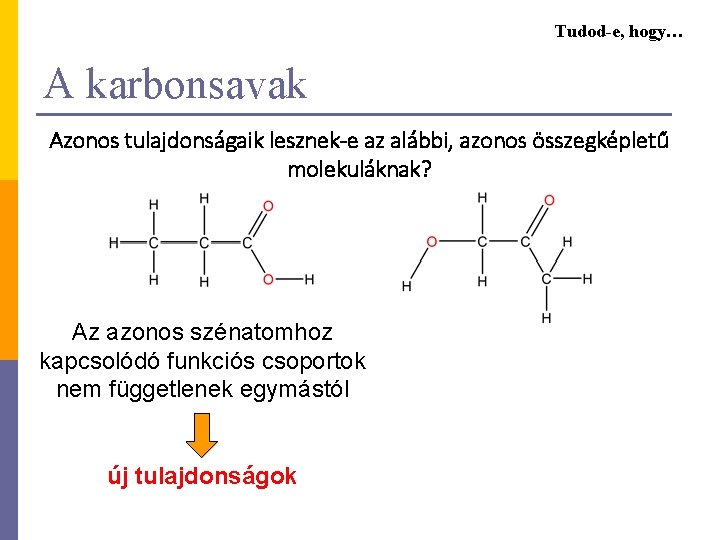
Tudod-e, hogy… A karbonsavak Azonos tulajdonságaik lesznek-e az alábbi, azonos összegképletű molekuláknak? Az azonos szénatomhoz kapcsolódó funkciós csoportok nem függetlenek egymástól új tulajdonságok

A karbonsavak A karboxilcsoport O-H kötése polárisabb, mint az alkoholok O-H kötése. A karboxilcsoportról könnyebben lehasadhat a proton (H+). És mivel ez már víz hatására is megy… … a karbonsavak vizes oldata savas kémhatású.

A karbonsavak elnevezése • Az alapszénhidrogén nevéhez a -sav végződést illesztjük. • A szénhidrogénlánc szénatomszámába a karboxilcsoport szénatomját is bele kell számítani. • A főlánc számozását mindig a karboxilcsoport szénatomjával kezdjük. CH 3–C O–H etánsav 3 2 1 O CH 3–CH 2–C – metánsav O – – O–H 1 = H–C 2 = O = 1 O–H propánsav

A karbonsavak elnevezése • A három- vagy többértékű, továbbá a gyűrűs karbonsavak esetében a -karbonsav utótagot használjuk. • Ilyenkor a karboxilcsoportok szénatomjait nem számítjuk az alapszénhidrogén nevébe! ciklohexánkarbonsav propán-1, 2, 3 -trikarbonsav

A karbonsavak elnevezése • Sok karbonsavnak régi eredetű neve van, és a gyakorlatban ezek a használatosak. Képlet Szisztematikus név Hétköznapi név HCOOH metánsav hangyasav CH 3 -COOH etánsav ecetsav CH 3 -CH 2 -COOH propánsav propionsav CH 3 -(CH 2)2 -COOH butánsav vajsav CH 3 -(CH 2)3 -COOH pentásav valeriánsav CH 3 -(CH 2)14 -COOH hexadekánsav palmitinsav CH 3 -(CH 2)16 -COOH oktadekánsav sztearinsav C 17 H 33 -COOH oktadec-9 -énsav olajsav HOOC-COOH etándisav sóskasav

A karbonsavak fizikai tulajdonságai Op. , Fp. : • A karbonsavak olvadásés forráspontja magas (a molekulák között kialakuló hidrogénkötések miatt). • Képlet Név, (M) Fp. (°C) CH 3 -CH 2 -CH 3 bután (58) 0 CH 3 -CH 2 -OH propanol (60) 97 CH 3 -COOH ecetsav (60) 118 CH 3 -(CH 2)6 -CH 3 oktán (114) 126 A karbonsavak forráspontja közel azonosa a kb. kétszeres molekulatömegű alkánokéval (dimerizálódnak!). • Forráspontjuk a hasonló molekulatömegű, egyértékű alkoholokénál is magasabb.

A karbonsavak fizikai tulajdonságai Halmazállapot • A C 1 -C 10 szénatomszámú karbonsavak cseppfolyósak. • A 10 szénatomnál nagyobb szénatomszámú és az aromás karbonsavak szilárdak. Oldhatóság • C 4 -ig: vízben jól oldódnak (a poláris jelleg dominál). • C 5 -től: a karbonsavak csak kismértékben oldódnak vízben. • C 9 -től: a karbonsavak vízoldhatatlanok (a hosszú szénlánc apoláris jellege dominál).

A karbonsavak csoportosítása A szénhidrogéncsoportok szerint: • telített • telítetlen szénláncúak • nyíltláncú • gyűrűs • aromás A karboxilcsoportok értékűsége szerint: • egyértékű • kétértékű (dikarbonsavak) • háromértékű (trikarbonsavak) • …

Fontosabb alkánsavak Hangyasav (metánsav) Előfordulása • a hangyák és méhek méregváladékában • csalánban

Fontosabb alkánsavak Hangyasav (metánsav) Fizikai tulajdonságai • Színtelen, szúrósszagú folyadék. • Vízzel és alkohollal minden arányban elegyedik (mivel poláris).

Fontosabb alkánsavak Hangyasav (metánsav) Kémiai tulajdonságai • Savas kémhatású (a legerősebb egyértékű, szubsztituálatlan karbonsav). • Lúgokkal közömbösíthető (sóit formiátoknak nevezzük). HCOOH + Na. OH Tudod-e, hogy… A hangya latinul: formica, És az angol formic acid kifejezés is innen származik… HCOO- + Na+ + H 2 O nátrium-metanoát (nátrium-formiát)

Fontosabb alkánsavak Hangyasav (metánsav) Kémiai tulajdonságai • A fémeket hidrogéngáz fejlődése közben oldja: 2 HCOOH + Mg = 2 HCOO- + Mg 2+ + H 2 magnézium-metanoát (magnézium-formiát) • A brómos vizet elszínteleníti: HCOOH + Br 2 = 2 HBr + CO 2

Fontosabb alkánsavak formilcsoport Hangyasav (metánsav) Kémiai tulajdonságai • Adja az ezüsttükör-próbát: HCOOH + 2 Ag+ + 2 OH- = CO 2 + 2 Ag + 2 H 2 O • A hangyasavból tömény kénsav hatására szén-monoxid képződik: cc. H 2 SO 4 HCOOH kat. CO + H 2 O

Fontosabb alkánsavak Hangyasav (metánsav) Felhasználása • gyapjú színezése • impregnálás • bőrcserzés • fahordók fertőtlenítése • reumás betegségek kezelésére

Fontosabb alkánsavak Ecetsav (etánsav) Előfordulása • a megerjedt alkoholos italokban • és (majdnem) minden konyhában…

Fontosabb alkánsavak Ecetsav (etánsav) Fizikai tulajdonságai • Színtelen, szúrósszagú folyadék. • Vízzel és alkohollal minden arányban elegyedik (poláris oldószer). • 17 °C alatt „megfagy” (ezért hívják jégecetnek a tömény ecetsavat).

Fontosabb alkánsavak Ecetsav (etánsav) Kémiai tulajdonságai • savas kémhatású: CH 3–COOH + H 2 O CH 3–COO- + H 3 O+ acetátion • lúgokkal közömbösíthető (sóit acetátoknak nevezzük: ) CH 3–COOH + Na. OH CH 3–COO- + Na+ + H 2 O nátrium-acetát

Fontosabb alkánsavak Ecetsav (etánsav) Kémiai tulajdonságai • számos* fémet hidrogéngáz fejlődése közben old. *: negatív standardpotenciálú fémek (pl. : Zn, Fe, Mg) Tudod-e, hogy… Az alumíniumot látszólag miért nem „bántja”?

Tudod-e, hogy… Fontosabb alkánsavak Ecetsav (etánsav) • Hogyan enyhíthetjük a túlecetezett ételek savanyú ízét? • Fém edényekben szabad-e ecetet tárolni?

Fontosabb alkánsavak Ecetsav (etánsav) Előállítása • Etil-alkoholból erjesztéssel: CH 3 CH 2 OH + O 2 → CH 3 COOH + H 2 O • Acetaldehid oxidációjával: 2 CH 3 CHO + O 2 → 2 CH 3 COOH • Metanol karbonilezésével: CH 3 OH + CO → CH 3 COOH

Fontosabb alkánsavak Ecetsav (etánsav) Felhasználása • konyhában • élelmiszeriparban • műszálak előállítása • gyógyszerek, festékek gyártásához • oldószerként

Tudod-e, hogy… Fontosabb alkánsavak Propionsav (propánsav) • Színtelen, szúrós szagú, vízzel elegyedő folyadék. • Gomba- és baktériumölő tulajdonságú (E 280, E 281). Vajsav (butánsav) • Színtelen, szúrós szagú, vízzel elegyedő folyadék. • Megtalálható a tejben, vajban (triglicerid formában, 3 -4%). • A vajsav okozza az avas vaj rossz szagát és a „testszagot”.

Tudod-e, hogy… Fontosabb alkánsavak Valeriánsav (pentásav) • A vajsavhoz hasonló fizikai tulajdonságai vannak. • A macskagyökérben fordul elő. • Észtereinek* kellemes illata van, ezért azokat parfümökben és gyümölcsaromának használják (alma, körte, ananász). *Az észterek savból és valamilyen hidroxivegyületből (általában alkoholból) víz kilépése mellett képződő oxigéntartalmú szerves vegyületek.

Fontosabb alkánsavak Palmitinsav (hexadekánsav) • A pálmazsír fő alkotója (neve is innen ered). • Apoláris, ezért vízben gyakolratilag nem oldódik. • Szilárd halmazállapotú karbonsav. • Lúgokkal sót képez, sói a palmitátok: C 15 H 31–COOH + Na. OH Tudod-e, hogy… C 15 H 31–COO- + Na+ + H 2 O nátrium-palmitát • A palmitinsav alumínium sója a napalm* egyik komponense volt… * A nafténsav és palmitinsav alumínium sóinak keverékéből állították elő, neve is erre utal.

Fontosabb alkánsavak Sztearinsav (oktadekánsav) • A természetben leggyakrabban előforduló „zsírsav”. • A faggyú jellegzetes alkotója (neve is innen származik). • Tulajdonságai a palmitinsavéhoz hasonlók. • Sói a sztearátok.

Fontosabb alkánsavak A palmitinsav és sztearinsav • A növényi olajok és állati zsírok alkotórészei. • Előállításuk ezekből történik. • Nátrium- és káliumsói a szappanok. Felhasználásuk: • mosószerek • szappanok és kozmetikumok (samponok, borotvahabok) • kenőanyagok

A telítetlen, aromás és kétértékű karbonsavak legfontosabb képviselői

Az akrilsav (prop-2 -énsav) • A legegyszerűbb telítetlen karbonsav. • Szúrós szagú, színtelen folyadék. • Addícióra és polimerizációra képes (mivel telítetlen). Metakrilsav • Az akrilsav fontos származéka. • A „plexiüveg” egyik kiindulási alapanyaga.

Az olajsav (cisz-oktadec-9 -énsav) • Telítetlen karbonsav. • Sűrűn folyó folyadék. • Vízben nem, alkoholban és éterben jól oldódik. • Jellemző reakciója az addíció: • a brómos vizet elszínteleníti, • sztearinsavvá telíthető. • A növényi olajok jellegzetes alkotórésze, de az állati zsírokban is megtalálható. Tudod-e, hogy… A hangyák és méhek tetemei ezt bocsájtják ki, s ez a szag a tetem eltávolítására késztetei az élő egyedeket.

A benzoesav (benzolkarbonsav) • A legegyszerűbb aromás karbonsav. • Fehér kristályos, szublimáló anyag. • Hideg vízben rosszul, apoláris oldószerekben jól oldódik. • Napjainkban a toluol oxidációjával állítják elő. • Baktériumölő hatása miatt a benzoesavat és sóit tartósításra használják (E 210 -E 213). Tudod-e, hogy… Régen a benzoefa nedvéből kivont benzoegyantából nyerték ki. A benzoegyanták gyakran alkalmazott füstölőszerek.

Az oxálsav (etándisav, sóskasav) • A legegyszerűbb dikarbonsav (kétértékű karbonsav). • Színtelen kristályos, mérgező vegyület. • Vízben jól oldódik, erős sav. • Sói az oxalátok. • Az oxalátok számos növényben megtalálhatók: pl. : sóska, spenót • Kalciumsója a vesekő fő alkotója (mivel vízben nem oldódik). Tudod-e, hogy… A sóskát és spenótot mindig sok tejjel kell készíteni, mert annak kalciumion-tartalma leköti a mérgező oxálsavat.

Egyéb funkciós csoportot is tartalmazó karbonsavak

Tudod-e, hogy… A tejsav (2 -hidroxipropánsav) • Miért savanyú az aludttej, a kovászos uborka és a savanyú káposzta? • Mi a közös a joghurtban és az izomlázban? • Színtelen, sűrűn folyó folyadék. • A természetben gyakran előforduló vegyület (a tejsavbaktériumok termelik a tejcukor bontása során). • Az iparban keményítőből állítják elő (fermentációval).

Tudod-e, hogy… A tejsav (2 -hidroxipropánsav) • Az élelmiszeriparban E 270 néven forgalmazzák. Felhasználják mint antioxidáns, savanyúságot szabályozó anyagot és tartósítószert. • Biológiailag lebontható, környezetbarát műanyagot is készítenek belőle. • A szájban is megtalálható Lactobacillus nevű baktérium biológiai erjedés útján állít elő tejsavat. • A képződő tejsav túlzott mennyisége a fogszuvasodás egyik oka lehet. • Királis.

Tudod-e, hogy… A citromsav (2 -hidroxipropán-1, 2, 3 -trikarbonsav) • Mitől savanyú a citromlé? • Milyen fontos felfedezése volt Szent-Györgyi Albertnek? • Színtelen, kristályos anyag. • Savanyú ízű, nem mérgező. • Vízben jól oldódik. • A citromsavciklus köztiterméke, így az emberi és állati szervezetekben is megtalálható. • Nátriumsója (nátrium-citrát) véralvadásgátló hatású.

Tudod-e, hogy… C-vitamin (aszkorbinsav) Az aszkorbinsav karbonsav-e?

A szalicilsav (2 -hidroxibenzoesav) Tudod-e, hogy… • Mikor iszunk kamilla teát? • Mire jó az aszpirin és a kalmopirin? • Színtelen, könnyen szublimáló kristályos anyag. • Alkoholban jól, vízben alig oldódik. • Baktériumölő hatása miatt élelmiszerek tartósítására használják. • Acetil származéka (acetil-szalicilsav) hatékony fájdalom és lázcsillapító (Aszpirin), kalcium sója a Kalmopyrin.

KÖSZÖNÖM A FIGYELMET!
- Slides: 42