Soorten evenwichten 1 Statisch evenwicht Er verandert helemaal















- Slides: 16


Soorten evenwichten 1 - Statisch evenwicht Er verandert helemaal niets. Het evenwicht bij krachten, is daar een voorbeeld van.

2 Dynamisch evenwicht - Er verandert wel iets, maar dat is niet waar te nemen omdat de snelheden van de tegengestelde veranderingen even groot zijn.

Soorten dynamische evenwichten: • Homogeen evenwicht Alle stoffen in een reactie hebben dezelfde fase. • Heterogeen evenwicht Als er verschillende fasen in de reactievergelijking staan. • Verdelingsevenwicht Opgeloste (vaste) stof verdeelt zich over twee oplosmiddelen (die niet mengen) in een vaste verhouding. B. v. jood in water en benzine

• Insteltijd: Tijd die verstrijkt tot zich een evenwicht heeft ingesteld

Voorwaarden voor een evenwicht: • Zowel de heengaande als de teruggaande reactie verlopen tegelijkertijd en even snel • Alle stoffen die bij de reactie betrokken zijn, komen tegelijkertijd in het reactiemengsel voor. • De concentraties/ hoeveelheden van de stoffen veranderen niet.

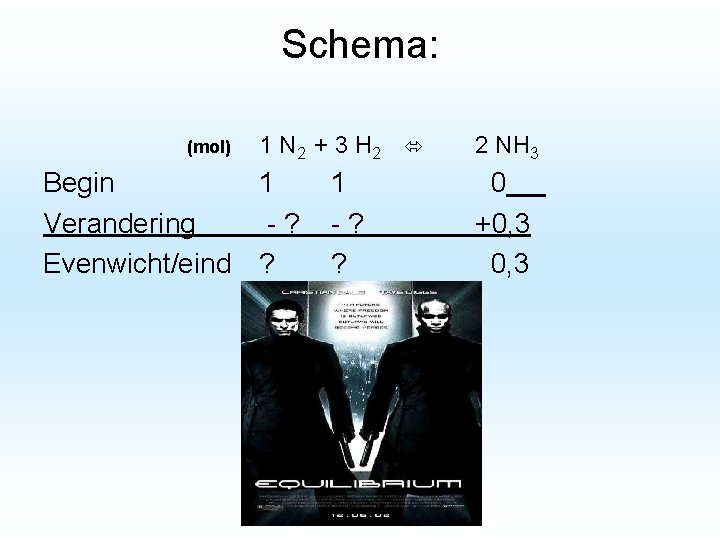
Rekenen aan chemische evenwichten In een vat van 2 liter brengen we 1 mol N 2 en 1 mol H 2. Er ontstaat een evenwicht; N 2 + 3 H 2 ↔ 2 NH 3 Bij evenwicht blijkt er 0, 3 mol NH 3 aanwezig te zijn. Hoe groot is de molariteit van elk van de drie stoffen in het evenwichtsmengsel?

Schema: (mol) 1 N 2 + 3 H 2 Begin 1 Verandering -? Evenwicht/eind ? 1 -? ? 2 NH 3 0 +0, 3

Evenwichtsvoorwaarde • De evenwichtsvoorwaarde is gelijk aan de concentratiebreuk: • = K (evenwichtsconstante) • = constante waarde van de concentratiebreuk bij een bepaalde temperatuur

Evenwichtsvoorwaarde • Concentraties worden weergegeven met vierkante haken • concentraties die rechts van het evenwichtsteken staan schrijf je boven de breukstreep en de concentraties die links staan van het evenwicht staan onder de streep.

• De coëfficiënten uit de reactievergelijking worden exponenten bij de concentraties • Vaste- en (zuivere) vloeistoffen komen niet in de breuk, hiervoor getal 1 invullen. • Dus alleen gassen en opgeloste stoffen invullen.

In het algemeen:

K (evenwichtsconstante) • waarde van K groot evenwicht ligt rechts (veel product) • waarde van K klein evenwicht ligt links (weinig product) • K is alleen van de temperatuur afhankelijk

Ligging van een evenwicht • Algemeen: • Principe van Le Chatelier- Van ‘t Hoff Oefent men op een stelsel in evenwicht een dwang uit, dan zal het stelsel er zo op reageren dat de gevolgen zoveel mogelijk worden teniet gedaan

• Druk: • Drukverhoging: Verschuift het evenwicht naar de kant met de minste gasmoleculen. • Concentratie: • Toevoegen van een bepaalde stof zorgt ervoor dat deze stof verdwijnt door verschuiving van het evenwicht naar de andere kant

• Een reactie is aflopend als er een neerslag wordt gevormd of een gas ontstaat. • Een katalysator versnelt zowel de heenals teruggaande reactie. Een katalysator beïnvloed de ligging niet, enkel de snelheid van het bereiken van het evenwicht.
 Homogeen evenwicht
Homogeen evenwicht Pqrst analyse
Pqrst analyse Statisch orderverzamelen betekenis
Statisch orderverzamelen betekenis Sterrenlichamen
Sterrenlichamen Meerzijdige partijdigheid voorbeeld
Meerzijdige partijdigheid voorbeeld Nash evenwicht
Nash evenwicht Nash-evenwicht
Nash-evenwicht Homogeen en heterogeen evenwicht
Homogeen en heterogeen evenwicht Krachtenveelhoek
Krachtenveelhoek Bloedgasanalyse
Bloedgasanalyse Nash-evenwicht
Nash-evenwicht Nash evenwicht
Nash evenwicht Hefboomwet
Hefboomwet Meeliftersgedrag economie
Meeliftersgedrag economie Nash-evenwicht
Nash-evenwicht Soorten evaluatie
Soorten evaluatie Soorten derving
Soorten derving