SEMANA LICDA 2021 NO 6 CORINA MARROQUIN O




















- Slides: 23

SEMANA LICDA. 2021 NO. 6 CORINA MARROQUIN O

Estequiometría Es el cálculo de las cantidades de las sustancias que participan en las reacciones químicas. Si se conoce la cantidad de una sustancia que participa en una reacción química (balanceada), se pueden calcular las cantidades de los demás reactivos y productos.

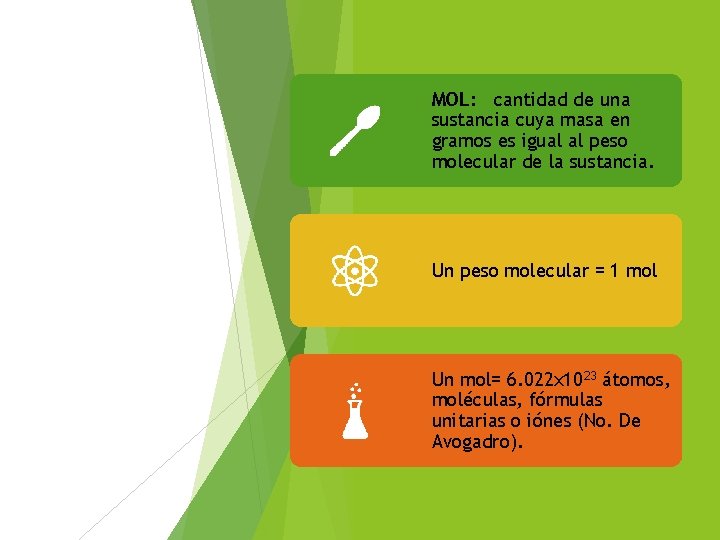
CANTIDAD Y UNIDADES: Estas cantidades pueden estar dadas en: MOLES MILIMOLES Un Mol GRAMOS Un gramo = 1000 miligramos MILIGRAMOS. . = 1000 milimoles

MOL: cantidad de una sustancia cuya masa en gramos es igual al peso molecular de la sustancia. Un peso molecular = 1 mol Un mol= 6. 022 x 1023 átomos, moléculas, fórmulas unitarias o iónes (No. De Avogadro).


S 32. 1 g Fe 55. 9 g. Na. Cl 58. 5 g K 2 Cr 2 O 7 294 g Sacarosa 342 g.

Los coeficientes numéricos que permiten balancear una ecuación están dados en moles. Ej. N 2(g) + 3 H 2(g) 2 NH 3(g) La ecuación se lee de siguiente manera: 1 mol de N 2 gaseoso, reacciona con 3 moles de H 2 gaseoso para producir 2 moles de amoniaco gaseoso.

2 Fe + 3 S Fe 2 S 3

No. De Avogadro Se puede usar como un factor de conversión entre los moles de una sustancia y el no. De partículas que contiene. Cuántos átomos contiene en 4 moles de Fe?

PESO MOLECULAR: Es la suma de las masas atómicas de todos los átomos de una molécula de un compuesto específico. Ej. H 2 SO 4 Elemento Peso atómico 2 H 1 x 2 S 2 32. 0 4 O 16 x 4 64 PM = Total 98. 0 g. 1 mol.

PESO FORMULA: Suma de las masas atómicas de todos los átomos de unidad formular de una sustancia (molecular o iónica) expresada en UMA.

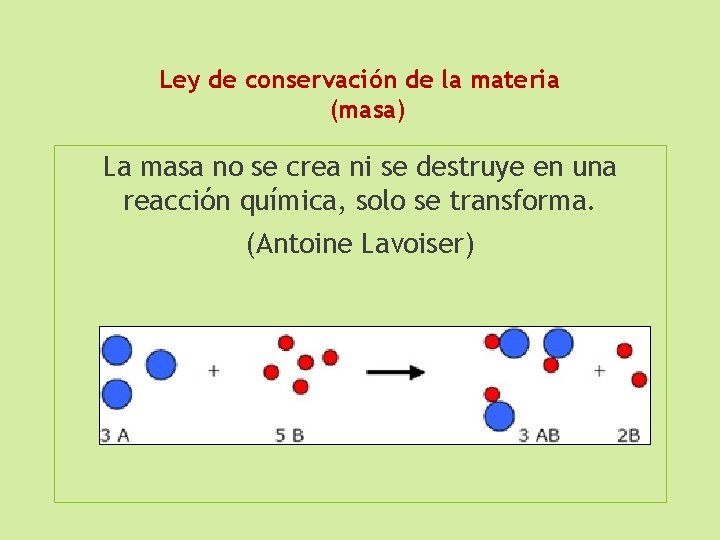
Ley de conservación de la materia (masa) La masa no se crea ni se destruye en una reacción química, solo se transforma. (Antoine Lavoiser)

Cálculo de Moles a Moles (trabajar con coeficientes) Cuántos moles de S se necesitan para reaccionar con 1. 42 moles de Hierro? 2 Fe(s) + 3 S(s) Fe 2 S 3(s)

Moles a Moles 3 moles de S x 1. 42 moles de Fe = 2. 13 moles de S 2 moles Fe ------- 3 moles de S 1. 42 moles Fe ------- X

MOLES A MOLES Cuántos moles de CO 2 se producen cuando reaccionan 8 moles de C 3 H 8? C 3 H 8(g) +5 O 2(g) 3 CO 2(g) + 4 H 2 O(g)

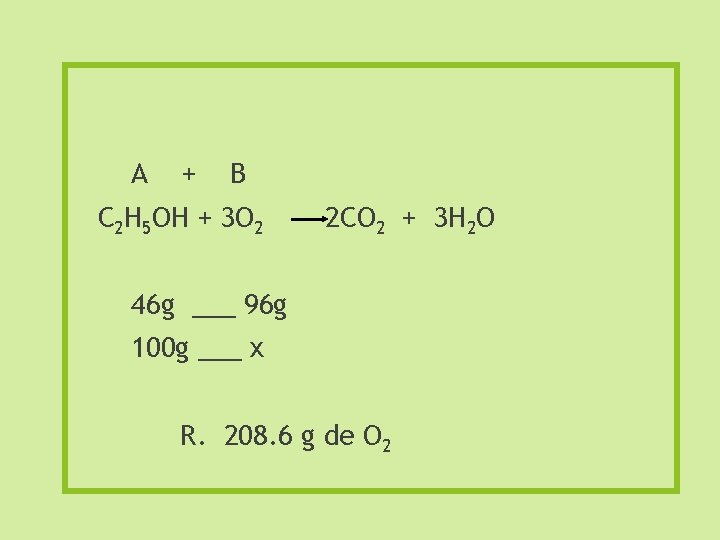
Cálculo de gramos a gramos. Cuántos gramos de oxígeno gaseoso se necesitan para quemar 100 gramos de alcohol etílico, C 2 H 5 OH? 1. Ecuación Balanceada. C 2 H 5 OH + 3 O 2(g) 2 CO 2 + 3 H 2 O

A + B C 2 H 5 OH + 3 O 2 2 CO 2 + 3 H 2 O 46 g ___ 96 g 100 g ___ x R. 208. 6 g de O 2

Cálculo de Moles a gramos Calcula cuántos gramos de sulfuro de plomo(II) se pueden oxidar con 6. 3 mol de oxígeno gaseoso. 2 Pb. S +3 O 2(g) 2 Pb. O + 2 SO 2(g)

Una caja de sal contiene 737 gr. de Na. Cl. ¿Cuántos moles de Na. Cl hay en la caja? 1 mol de Na. Cl = 58. 5 g de Na. Cl 737 g Na. Cl X 1 mol Na. Cl = 58. 5 g Na. Cl 12. 6 moles de Na. Cl.

Ley de las proporciones definidas: Un compuesto siempre tiene una razón atómica y una razón de masa específica (un porcentaje de masa específica) de cada elemento en el compuesto.

Ej. Porcentajes de composición. KMn. O 4 PM 158 100% K 39. 1 g 24. 74% Mn 54. 94 g 34. 77% O 4 64. 0 g 40. 50%

Cálculo del porcentaje % = g del elemento en el compuesto x 100 Peso fórmula % K = 39. 1 x 100 = 158 24. 74% % Mn= 54. 94 x 100 = 34. 77 % 158 %O= 64 x 100 = 40. 50 % 158 Suma de % = 100%

NOUAKCHOTT CAPITAL DE LA REPUBLICA ISLÁMICA DE MAURITANIA. CONOZCAMOS EL MUNDO ABRE LA MENTE Y CULTIVA EL ESPIRITU.
 Ricardo gorocica romero
Ricardo gorocica romero Tabla de grupos funcionales
Tabla de grupos funcionales Erika marroquín fabián
Erika marroquín fabián Sindrome de lambert eaton
Sindrome de lambert eaton Corina komi
Corina komi Recarbrio package insert
Recarbrio package insert Corina van den hurk
Corina van den hurk Corina copg
Corina copg Corina bautista
Corina bautista Accenture logo
Accenture logo Corina ursu
Corina ursu Daniel 9
Daniel 9 Cronograma de la semana
Cronograma de la semana Que haces normalmente los fines de semana
Que haces normalmente los fines de semana Numeros en kichwa del 1 al 10
Numeros en kichwa del 1 al 10 Ascentofsafed
Ascentofsafed Semana de estudos intensivos
Semana de estudos intensivos Das de la semana
Das de la semana Buscad primeramente el reino
Buscad primeramente el reino En que semana de tiempo ordinario estamos
En que semana de tiempo ordinario estamos Cuartina
Cuartina Fase 4: dirección. división del trabajo
Fase 4: dirección. división del trabajo Modulo 3 prepa en linea sep
Modulo 3 prepa en linea sep Semana 1 lunes martes miércoles jueves viernes
Semana 1 lunes martes miércoles jueves viernes