ESTEQUIOMETRIA Semana No 6 2015 Semana 6 Licda





























- Slides: 30

ESTEQUIOMETRIA Semana No. 6 - 2015 Semana 6 Licda. Isabel Fratti de Del Cid Diseño de diapositivas, imágenes e ilustraciones cortesía de Licda. Lilian Guzmán Melgar 1

ESTEQUIOMETRIA Parte de la química que se encarga de los cálculos de masas, moles, volúmenes y proporciones que se presentan en los compuestos y en las reacciones químicas. 2

Conceptos Básicos en estequiometria Peso molecular, masa molar, peso fórmula: se aplica a sustancias compuestas. Es la suma de las masas de los átomos que forman un compuesto ( molecular ó iónico). Se calcula multiplicando el peso atómico de cada elemento presente en el compuesto, por el número de veces que aparece en el ( esto lo indica el subíndice presente en la fórmula). La suma de éstos valores constituye el peso molecular (masa molar). Peso atómico ó masa atómica. Es la masa del elemento ( masa promedio ponderada de todos los isótopos naturales de un elemento). Este dato se obtiene directamente de la tabla periódica. 3

Ej: Calcule el peso molecular de el azúcar: C 12 H 22 O 11 : C = 12. 011 g x 12 = 144. 132 g H = 1. 0079 g x 22 = 22. 174 g O = 15. 999 g x 11 = 175. 99 g 342. 29 g 4

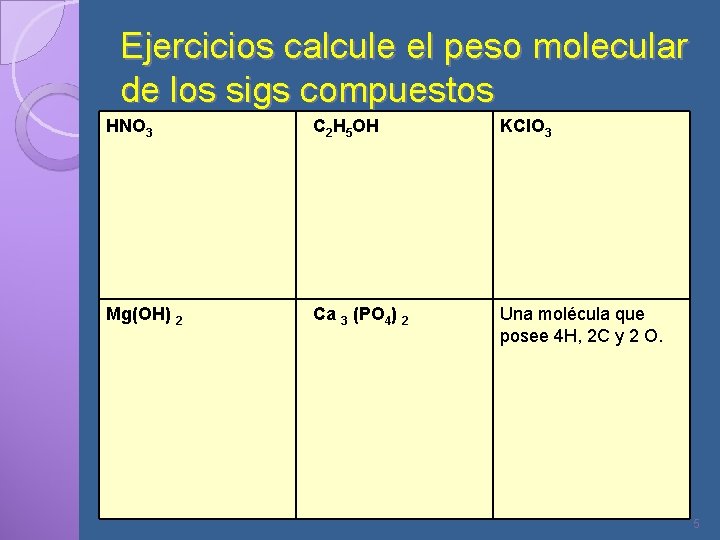
Ejercicios calcule el peso molecular de los sigs compuestos HNO 3 C 2 H 5 OH KCl. O 3 Mg(OH) 2 Ca 3 (PO 4) 2 Una molécula que posee 4 H, 2 C y 2 O. 5

MOL ü Es la cantidad de sustancia ( átomos, iones ó moléculas) que contiene el número de Avogadro ( 6. 02 X 1023 ) de partículas. ü Un mol de sustancia siempre contiene: 6. 022 x 1023 partículas. 1 mol de Na = 22. 9898 g 6. 02 x 10 23 átomos de Na 1 mol de glucosa ( C 6 H 12 O 6 ) = 180. 15 g 6. 02 x 10 moléculas de glucosa. 23 1 mol de iones fosfato : PO 4 -3 = 94. 97 g 6. 02 x 10 23 iones fosfato. 6

Ejercicios usando el número de Avogadro. 1 -Calcule el número de átomos de cobre hay en una moneda de cobre que pesa 50 gramos. # átomos de cobre= 6. 02 x 10 23 áts de Cu x 50 g Cu 63. 54 g Cu = 7. 8 x 10 22 átomos de Cu 2 -Cuantas moléculas de CH 4 hoy en 5. 4 moles de CH 4. ? Moléculas CH 4 = 6. 02 x 10 23 moléculas CH 4 x 5. 4 moles CH 4 1 mol de CH 4 = 3. 26 x 10 24 moléculas de CH 4 7

A continuación se le presentan las cantidades equivalentes a un mol de c/ u de las sustancias descritas abajo ( observe la diferencia entre c/u) 1 mol S 32. 064 g 1 mol Fe 55. 847 g 1 mol Na. Cl Sal común 58. 45 g 1 mol K 2 Cr 2 O 7 1 mol C 12 H 22 O 11 294. 18 g Azúcar común 342. 19 g 8

Milimol (mmol) Es la milésima parte de UN Mol. Para convertir moles a milimoles, se multiplica por 1000 el numero de moles dado. Ejemplos: 1 Mol de H 2 O = 1, 000 milimoles de H 2 O Ej: Cuántos mmoles de Ag hay en 5. 24 moles de plata (Ag). Resp: =5. 24 moles de Ag x 1000 = 5, 240 mmoles de Ag Ej: Cuántos mmoles de CO 2 hay en 0. 187 moles. Resp =0. 187 moles de CO 2 x 1000 = 187 mmoles de CO 2 9

Conversión de milimoles a moles Para esto debe dividir entre mil el número de milimoles dados. Ejemplos. Cuantos moles de CH 4 hay en 3450 milimoles de CH 4? Moles = milimoles /1000. Moles CH 4 = 3450 mmoles /1000 = 3. 450 moles. Cuantos moles de Na+ hay en 289 milimoles de Na+ ? . Moles de Na + = 289 mmoles /1000 = 0. 289 moles. 10

Cálculo de NÚMERO DE MOLES CUANDO NOS DAN MASAS ( ej: gramos) DE SUSTANCIAS SIMPLES y COMPUESTAS: A- Sustancias simples. Ej: Atomos no combinados. Ej. 1 - Cuántos moles de Fe hay en 340 g de Fe. ? Moles de Fe = 1 mol Fe x 340 g de Fe = 6. 08 moles de Fe 55. 85 g Fe dato obtenida en la tabla periódica Ej. 2 - Cuántos moles de Ca. Cl 2, hay en 65 g de Ca. Cl 2. ? Moles de Ca. Cl 2 = 1 mol de Ca. Cl 2 x 65 g Ca. Cl 2 110. 99 g Ca. Cl 2 dato corresponde 11

Cont. ejercicios Note: el primer factor es un dato de concepto : a que equivale un mol en cada caso. . En el numerador debe colocar el dato que lleva la unidad de la pregunta solicitada ej: moles y en el denominador se coloca, el dato que lleva la unidad del valor dado en le problema. Ej. g de Fe ó g de Ca. Cl 2 , para poder eliminarse las unidades comunes y obtener la solicitada en el problema. 12

Cálculo de masas, a partir de moles ó milimoles Cuántos g de KOH hay en 0. 43 moles de KOH. ? g. KOH= 56. 1 g de KOH x 0. 43 moles de KOH= 1 mol de KOH = 24. 123 g KOH Cuántos g de Hg hay en 315 milimoles de Hg. ? g Hg = 200. 59 g Hg x 315 mmoles de Hg 1, 000 mmoles * = 63. 18 g de Hg 13

Note: el primer factor es un dato de concepto, que lleva en el numerador la unidad de lo solicitado en el problema. e. J: g de KOH, ó g de Hg. En el denominador, se coloca las unidades que coinciden con el dato que da el problema ej : moles ó milimoles. 14

Ejercicios 1 -¿Cuantos gramos hay en un mol de cada uno de los siguientes compuestos? a) C 6 H 12 O 6 b) Cu 2 -¿Cuantos moles hay en ? : � 900 g de Pb � 120 g de KMn. O 4 3 -¿Cuantos gramos hay en ? : � 1. 8 moles de NH 3 � 670 milimoles de H 2 CO 3 4 -Cuántos milimoles hay en? 0. 516 moles de Ag. 2. 8 g de NH 3 15

LEYES DE LA ESTEQUIOMETRIA Ley de la conservación de la materia. Puede enunciarse de diferentes maneras: -La materia no puede ser creada, ni destruida aunque si transformada -La masa de un sistema que reacciona químicamente permanece constante. 16

LEY DE LAS PROPORCIONES DEFINIDAS Establece que un compuesto puro siempre contiene los mismos elementos en la misma proporción de masa. Esto significa que cualquier muestra de agua sea cual fuere el sitio de donde se obtenga ó del estado físico en el que se halle ( sólida, líquida ó gas), tendrá el mismo porcentaje de composición: 88. 81% de oxigeno y 11. 19% de hidrógeno y su composición no variará, siendo su fórmula H 2 O. 17

Ley de las Proporciones Definidas de de plomo de azufre de sulfuro de plomo Azufre (sobrante) plomo (sobrante) 18

PORCENTAJE DE COMPOSICIÓN Ej: Calcule el % de composición de cada uno de los elementos Ej: en el K 2 Cr 2 O 7. A- Calcule el peso molecular, multiplicando los pesos atómicos de los elementos presentes por el número de veces que aparecen: 2 K = 39. 102 gx 2 = 78. 204 g 2 Cr = 51. 992 g x 2 = 103. 984 g 7 O = 15. 999 g x 7 = 111. 993 g 294. 181 g B- Calcular el % de C/ elemento, de la siguiente manera: % de C/elemento = Peso aportado de ese elemento x 100 Peso molecular % K = 78. 204 g /294. 181 g x 100 = 26. 58 % de K % Cr= 103. 984 g / 294. 181 g x 100 = 35. 35 % de Cr % O = 111. 993 g / 294. 181 g x 100 = 38. 0 19

Ejercicio: Calcule el % de composición de C/ elemento en el Ca 3(PO 4)2 20

CÁLCULOS ESTEQUIOMETRICOS EN ECUACIONES QUÍMICAS Los coeficientes que balancean la ecuación indican la cantidad de moles de reactivos y de productos, participantes en la reacción, que pueden ser trasladados a cantidades de masas. 2 Ag (s) + S(s) → Ag 2 S (s) 2 moles de Ag 1 mol S ---> 1 mol Ag 2 S 2 (107. 87 g) 1(32. 064 g) 1(247. 8 g) 215. 74 g de Ag + 32. 064 g S = 247. 8 g de Ag 2 S 21

Recomendaciones para realizar cálculos estequiométricos en ecuaciones químicas. 1 - Deben hacerse exclusivamente en la ecuación balanceada. Si no se halla balanceada, debe balancearse. 2 - Debe concretarse exclusivamente a lo solicitado. Si le dan moles y le piden cálculo de moles y no de gramos no es necesario calcular los pesos moleculares. 3 - Si le piden gramos entonces si deberá calcular los pesos involucrados en la pregunta, no es necesario calcular los pesos de todos los participantes, sino solo los que le piden y se 22 relacionan con la pregunta.

Ej 1 -¿Cuántas moles y milimoles de Ag 2 S pueden ser preparados a partir de 0. 4 moles de plata (Ag)? 2 Ag (s) + S(s) → Ag 2 S (s) Cálculos: Moles de Ag 2 S = 1 mol de Ag 2 S x 0. 4 moles Ag 2 moles Ag = 0. 2 moles de Ag 2 S El primer factor : 1 mol Ag 2 S/ 2 moles de Ag. Es la relación molar que nos indica la ecuación, el otro dato nos lo da el problema (0. 4 moles Ag) 23

Milimoles de Ag 2 S= 1000 mmoles*de Ag 2 S x 0. 4 moles. Ag = 200 mmoles de Ag 2 S 2 moles Ag *Recordar 1 mol = 1000 mmoles. El primer factor (1 mol ó 1000 mmoles de Ag 2 S / 2 moles de Ag) lo obtenemos de la ecuación balanceada, el otro dato lo da el problema (0. 4 moles de Ag). Note: Que solo relacionamos los datos que tenían que ver con lo solicitado. 24

3) Dada la ecuación, calcular: calcular 3 Cu + 8 HNO 3→ 3 Cu(NO 3)2 + 2 NO + 4 H 2 O a) Moles de NO formados a partir de 50 milimoles de Cu. Moles NO = 2 moles NO x 50 mmoles de Cu 3(1000 mmoles *de Cu ) = 0. 033 moles de NO *Recordar que 1 mol = 1000 mmoles b-Moles de HNO 3 necesarios para preparar 80 g de Cu(NO 3)2 Moles de HNO 3 = 8 moles de HNO 3 x 80 g Cu(NO 3)2 3 ( 187. 65 g )Cu(NO 3)2 = 1. 136 moles de HNO 3 25

El oxido de hierro (III) Reacciona con carbono para dar hierro y monóxido de carbono. De acuerdo a la siguiente reacción. Fe 2 O 3 (s) + 3 C (s) → 2 Fe (s) + 3 CO (g) Esta balanceada, por eso puede proceder a hacer los cálculos ¿Cuántos gramos de C se requieren para reaccionar con 2. 5 moles de Fe 2 O 3? En éste caso se relacionan dos datos, los cuales se hallan del lado de los reactivos. g. C = 3 (12. 011 g) de C x 2. 5 moles de Fe 2 O 3 = 1 mol Fe 2 O 3 = 90. 08 g C 26

Cuantos gramos de CO se producen cuando reaccionan 16 g de C? Aquí se relacionan dos datos uno del lado de los productos con uno de los reactivos. g. CO = 3 (28. 01 g)de CO x 16 g de C 3 (12. 011 g )de C = 37. 31 g de CO 27

Para la reacción, calcule lo solicitado: 2 C 2 H 6+ 7 O 2→ 4 CO 2+ 6 H 2 O a) ¿Cuántas mmoles de C 2 H 6 se necesitan para producir 75 g de CO 2? b) ¿Cuantos gramos de H 2 O pueden producirse a partir de 62. 5 g de C 2 H 6 ? 28

De acuerdo a la siguiente reacción: C 3 H 8 + O 2 CO 2 + H 2 O Calcule : a- moles de H 2 O formados a partir de 320 g de C 3 H 8. B- g de O 2, necesarios para combinarse con 100 g de C 3 H 8. Acuérdese de balancear la ecuación antes. 29

Fin 30
 Estequiometria quimica
Estequiometria quimica Problemas estequiometria 3 eso
Problemas estequiometria 3 eso Conclusion de estequiometria
Conclusion de estequiometria A palavra estequiometria do grego
A palavra estequiometria do grego Normalidad
Normalidad Estequiometria
Estequiometria Estequiometría número de avogadro
Estequiometría número de avogadro Medioab
Medioab Cronograma semana de la salud
Cronograma semana de la salud Modulo 22 semana 4
Modulo 22 semana 4 Fase 6 control. medir y corregir
Fase 6 control. medir y corregir En que semana del tiempo ordinario estamos
En que semana del tiempo ordinario estamos Los dias de la semana
Los dias de la semana La semana pasada
La semana pasada Derivados de capas germinales
Derivados de capas germinales Adónde vas los fines de semana
Adónde vas los fines de semana Parasha bereshit
Parasha bereshit Quantas prendas a turma 403 já levou para a escola
Quantas prendas a turma 403 já levou para a escola Mateo 21 2832
Mateo 21 2832 Bienvenidos a una nueva semana
Bienvenidos a una nueva semana Actividad integradora 1 modulo 23
Actividad integradora 1 modulo 23 Podemos dizer que o cubismo
Podemos dizer que o cubismo Veces vas a la biblioteca durante la semana?
Veces vas a la biblioteca durante la semana? Hola amores
Hola amores Que haces normalmente los fines de semana
Que haces normalmente los fines de semana Luna llena semana santa
Luna llena semana santa Dula noong panahon ng kastila
Dula noong panahon ng kastila Modulo 23 semana 2 fase 3
Modulo 23 semana 2 fase 3 Que semana estamos del tiempo ordinario
Que semana estamos del tiempo ordinario Cuanto son 70 semanas
Cuanto son 70 semanas Parasha de la semana mesianica
Parasha de la semana mesianica





















































