ESTEQUIOMETRIA Semana No 6 2019 Semana 6 Licda































- Slides: 33

ESTEQUIOMETRIA Semana No. 6 - 2019 Semana 6 Licda. Isabel Fratti de Del Cid Diseño de diapositivas, imágenes e ilustraciones cortesía de Licda. Lilian Guzmán Melgar 1

ESTEQUIOMETRIA Parte de la química que se encarga de los cálculos de masas, moles, volúmenes y proporciones que se presentan en los compuestos y en las reacciones químicas. 2

Conceptos Básicos en estequiometria Peso molecular, masa molar, peso fórmula: se aplica a sustancias compuestas. Es la suma de las masas de los átomos que forman un compuesto ( molecular ó iónico). Se calcula multiplicando el peso atómico de cada elemento presente en el compuesto, por el número de veces que aparece en el ( esto lo indica el subíndice presente en la fórmula). La suma de éstos valores constituye el peso molecular (masa molar) o peso fórmula. Peso atómico ó masa atómica. Es la masa del elemento ( masa promedio ponderada de todos los isótopos naturales de un elemento). Este dato se obtiene directamente de la tabla periódica. 3

Ej: Calcule el peso molecular de el azúcar: ( sacarosa) C 12 H 22 O 11 : C = 12. 011 g x 12 = 144. 132 g H = 1. 0079 g x 22 = 22. 174 g O = 15. 999 g x 11 = 175. 99 g 342. 29 g 4

Ejercicios calcule el peso molecular de los siguientes compuestos HNO 2 C 3 H 7 OH Ga(OH) 3 Mg 3 (PO 4) 2 Kl. O 3 Una molécula que posee 10 H, 4 C, 2 N, 2 0, Escriba además su fórmula) 5

MOL ü Es la cantidad de sustancia ( átomos, iones ó moléculas) que contiene el número de Avogadro ( 6. 02 X 1023 ) partículas. ü Un mol de sustancia siempre contiene: 6. 022 x 1023 partículas. 1 mol de Na = 22. 9898 g 6. 02 x 10 23 átomos de Na 1 mol de glucosa ( C 6 H 12 O 6 ) = 180. 15 g 6. 02 x 10 moléculas de glucosa. 23 1 mol de iones fosfato : PO 4 -3 = 94. 97 g 6. 02 x 10 23 iones fosfato( PO 4 -3) 6

Ejercicios usando el número de Avogadro. 1 -Calcule el número de átomos de oro hay en un anillo de oro que pesa 50 gramos. # átomos de oro = 6. 02 x 10 23 áts de Au x 50 g Au 196. 97 g Au = 1. 53 x 10 23 átomos de Au 2 -Cuantas moléculas de CH 4 hoy en 5. 4 moles de CH 4. ? Moléculas CH 4 = 6. 02 x 10 23 moléculas CH 4 x 5. 4 moles CH 4 1 mol de CH 4 = 3. 26 x 10 24 moléculas de CH 4 7

A continuación se le presentan las cantidades equivalentes a un mol de c/ u de las sustancias descritas abajo ( observe la diferencia entre c/u) 1 mol S 32. 064 g 1 mol Fe 55. 847 g 1 mol Na. Cl Sal común 58. 45 g 1 mol K 2 Cr 2 O 7 1 mol C 12 H 22 O 11 294. 18 g Azúcar común 342. 19 g 8

Milimol (mmol) Es la milésima parte de UN Mol. Para convertir moles a milimoles , se multiplica por 1000 el numero de moles dado. Ejemplos: 1 Mol de H 2 O = 1, 000 milimoles de H 2 O Ej: Cuántos mmoles de Ag hay en 3. 548 moles de plata (Ag). mmoles de plata = 3. 548 moles de Ag x 1000 mmoles de Ag 1 mol de Ag = 3, 548 mmoles de Ag 9

Cuántos mmoles de CO 2 hay en 0. 187 moles de CO 2 mmoles de CO 2 =0. 187 moles de CO 2 x 1000 mmoles de CO 2 1 mol de CO 2 =187 mmoles de CO 2. Calcule cuantos milimoles de H 3 BO 3 hay en una onza de ácido bórico. ( 1 onza 28. 6 g ). 10

Conversión de milimoles a moles Para esto debe dividir entre mil el número de milimoles dados. Ejemplos. Cuantos moles de hay en 7340 milimoles de NO 2? Moles NO 2 = 7340 mmoles x 1 mol de NO 2 1, 000 mmoles de NO 2 = 7. 340 moles de NO 2. Cuantos moles de Na+ hay en 289 milimoles de Na+ ? . Moles de Na + = 289 mmoles /1000 = 0. 289 moles. 11

Cálculo de NÚMERO DE MOLES CUANDO NOS DAN MASAS ( ej: gramos) DE SUSTANCIAS SIMPLES y COMPUESTAS: A- Sustancias simples. Ej: Atomos no combinados. Ej. 1 - Cuántos moles de Fe hay en 340 g de Fe. ? Moles de Fe = 1 mol Fe x 340 g de Fe = 6. 08 moles de Fe 55. 85 g Fe dato obtenida en la tabla periódica Ej. 2 - Cuántos moles de Ca. Cl 2, hay en 85 g de Ca. Cl 2. ? Moles de Ca. Cl 2 = 1 mol de Ca. Cl 2 x 85 g Ca. Cl 2 110. 99 g Ca. Cl 2 dato corresponde 12

Cálculo de masas, a partir de moles ó milimoles Ej: Cuántos g de KOH hay en 0. 43 moles de KOH. ? g. KOH= 56. 1 g de KOH x 0. 43 moles de KOH= 1 mol de KOH = 24. 123 g KOH Cuántos g de Hg hay en 315 milimoles de Hg. ? g Hg = 200. 59 g Hg x 315 mmoles de Hg 1, 000 mmoles * = 63. 18 g de Hg 13

Note: el primer factor es un dato de concepto, que lleva en el numerador la unidad de lo solicitado en el problema. En el denominador, se coloca el valor que coincide con las unidades que da el problema. 14

Ejercicios 1 -¿Cuantos gramos hay en 0. 3 moles de cada uno de los siguientes compuestos? a) C 12 H 22 O 11 b) Cu 2 -¿Cuantos moles hay en ? : a) 900 g de Pb a) 120 g de KMn. O 4 15

3 -¿Cuantos gramos hay en ? : a) 1. 8 moles de NO 2 b) 670 milimoles de H 2 SO 3 4 -Cuántos milimoles hay en? a) 0. 816 moles de Ag. b) 7. 4 g de NH 3 16

LEYES DE LA ESTEQUIOMETRIA Ley de la conservación de la materia. Puede enunciarse de diferentes maneras: -La materia no puede ser creada, ni destruida aunque si transformada -La masa de un sistema que reacciona químicamente permanece constante. 17

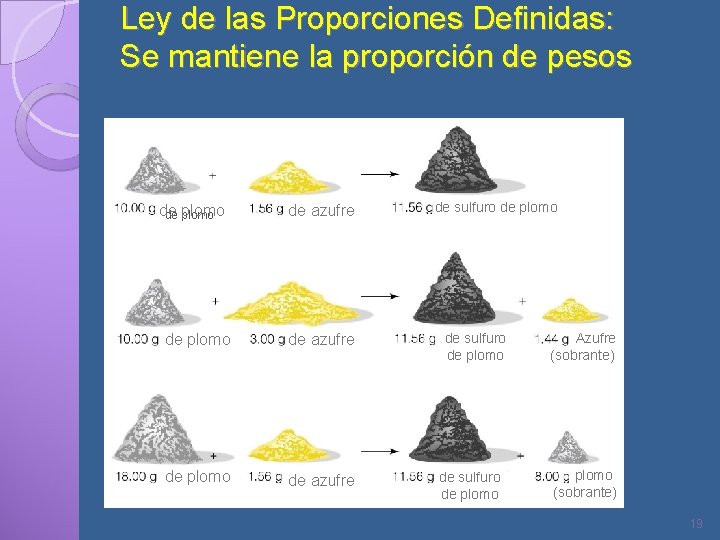
LEY DE LAS PROPORCIONES DEFINIDAS Establece que un compuesto puro siempre contiene los mismos elementos en la misma proporción de masa. Esto significa que cualquier muestra de agua sea cual fuere el sitio de donde se obtenga ó del estado físico en el que se halle ( sólida, líquida ó gas), tendrá el mismo porcentaje de composición: 88. 81% de oxigeno y 11. 19% de hidrógeno y su composición no variará, siendo su fórmula H 2 O , es decir 2 H : O 18

Ley de las Proporciones Definidas: Se mantiene la proporción de pesos de de plomo de azufre de sulfuro de plomo Azufre (sobrante) plomo (sobrante) 19

PORCENTAJE DE COMPOSICIÓN Ej: Calcule el % de composición de cada uno de los elementos Ej: en el K 2 Cr 2 O 7. A- Calcule el peso molecular, multiplicando los pesos atómicos de los elementos presentes por el número de veces que aparecen: 2 K = 39. 102 gx 2 = 78. 204 g 2 Cr = 51. 992 g x 2 = 103. 984 g 7 O = 15. 999 g x 7 = 111. 993 g 294. 181 g B- Calcular el % de C/ elemento, de la siguiente manera: % de C/elemento = Peso aportado de ese elemento x 100 Peso molecular % K = 78. 204 g /294. 181 g x 100 = 26. 58 % de K % Cr= 103. 984 g / 294. 181 g x 100 = 35. 35 % de Cr % O = 111. 993 g / 294. 181 g x 100 = 38. 0 % de O 20

Ejercicio: Calcule el % de composición de C/ elemento en el Ba 3(As. O 4)2 21

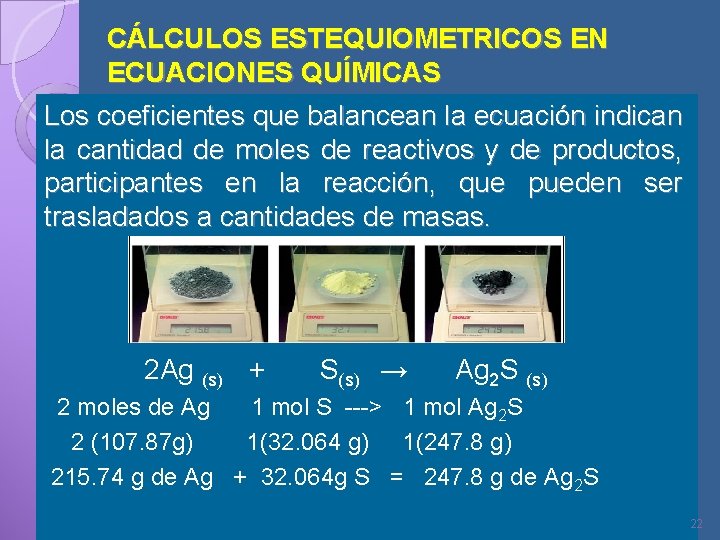
CÁLCULOS ESTEQUIOMETRICOS EN ECUACIONES QUÍMICAS Los coeficientes que balancean la ecuación indican la cantidad de moles de reactivos y de productos, participantes en la reacción, que pueden ser trasladados a cantidades de masas. 2 Ag (s) + S(s) → Ag 2 S (s) 2 moles de Ag 1 mol S ---> 1 mol Ag 2 S 2 (107. 87 g) 1(32. 064 g) 1(247. 8 g) 215. 74 g de Ag + 32. 064 g S = 247. 8 g de Ag 2 S 22

Recomendaciones para realizar cálculos Estequiométricos en ecuaciones químicas. 1 - Deben hacerse exclusivamente en la ecuación balanceada. Si no se halla balanceada, debe balancearse. 2 - Debe concretarse exclusivamente a lo solicitado. Si le dan moles y le piden cálculo de moles y no de gramos no es necesario calcular los pesos moleculares. 3 - Si le piden gramos entonces si deberá calcular los pesos involucrados en la pregunta, no es necesario calcular los pesos de todos los participantes, sino solo los que le piden y se relacionan con la pregunta. 23

Ej 1 -¿Cuántas moles y milimoles de Ag 2 S pueden ser preparados a partir de 0. 4 moles de plata (Ag)? 2 Ag (s) + S(s) → Ag 2 S (s) Cálculos: Moles de Ag 2 S = 1 mol de Ag 2 S x 0. 4 moles Ag 2 moles Ag = 0. 2 moles de Ag 2 S El primer factor : 1 mol Ag 2 S/ 2 moles de Ag. Es la relación molar que nos indica la ecuación balanceada, el otro dato nos lo da el problema (0. 4 moles Ag) 24

mmoles de Ag 2 S= 1000 mmoles*de Ag 2 S x 0. 4 moles de Ag 2 moles de Ag = 200 mmoles de Ag. *Recordar 1 mol = 1000 mmoles. El primer factor (1 mol ó 1000 mmoles de Ag 2 S / 2 moles de Ag) lo obtenemos de la ecuación balanceada, el otro dato lo da el problema (0. 4 moles de Ag). Note: Que solo relacionamos los datos que tenían que ver con lo solicitado no debemos de calcular ni obtener datos de las otras sustancias presentes en la ecuación que no se relacionan con los datos del problema. 25

3) Dada la ecuación, calcular: calcular 3 Cu + 8 HNO 3→ 3 Cu(NO 3)2 + 2 NO + 4 H 2 O a) Moles de H 2 O formados a partir de 50 milimoles de Cu. Moles H 2 O = 4 moles H 2 O x 1 mol de Cu x 50 mmoles Cu 3 moles de Cu 1000 mmoles de Cu = 0. 066 moles de H 2 O *Recordar que 1 mol = 1000 mmoles b-Moles de HNO 3 necesarios para preparar 80 g de Cu(NO 3)2 Moles de HNO 3 = 8 moles de HNO 3 x 1 mol Cu(NO 3)2 x 80 g Cu(NO 3)2 3 moles de Cu(NO 3)2 187. 65 g Cu(NO 3)2 = 1. 136 moles de HNO 3 26

El oxido de hierro (III) Reacciona con carbono para dar hierro y monóxido de carbono. De acuerdo a la siguiente reacción. Fe 2 O 3 (s) + 3 C (s) → 2 Fe (s) + 3 CO (g) Esta balanceada, por eso puede proceder a hacer los cálculos ¿Cuántos gramos de C se requieren para reaccionar con 2. 5 moles de Fe 2 O 3? En éste caso se relacionan dos datos, los cuales se hallan del lado de los reactivos. g. C = 12. 011 g C x 3 moles de C x 2. 5 moles de Fe 2 O 3 = 1 mol de C 1 mol Fe 2 O 3 = 90. 08 g C 27

En base al problema anterior resuelva: Cuantos gramos de CO se producen cuando reaccionan 16 g de C? 28

Para la siguiente reacción, calcule lo solicitado: ( Recuerde balancear la ecuación primero ) C 2 H 6+ O 2→ CO 2+ H 2 O a) ¿Cuántas mmoles de C 2 H 6 se necesitan para producir 75 g de CO 2? b) ¿Cuantos gramos de H 2 O pueden producirse a partir de 62. 5 g de C 2 H 6 ? 29

De acuerdo a la siguiente reacción *: Calcule Ca. SO 3 + HCl Ca. Cl 2 + SO 2 + H 2 O a- moles de SO 2 formados a partir de 320 g de Ca. SO 3. b- g de HCl, necesarios para combinarse con 100 g de Ca. SO 3. 30

La siguiente reacción muestra la conversión de Acido láctico a ácido pirúvico que ocurre en la Glucólisis. De acuerdo a la siguiente reacción: CH 3 CHOHCOOH CH 3 COCOOH Calcule cuantos miligramos de ácido pirúvico se obtienen cuando reaccionan 0. 007 moles de ácido láctico: 31

Resuelva ejercicio 6. 47 ( pag 233), VER RESPUESTA PAG: 254) 32

Resuelva prob. 6. 53 del libro de texto ( pag 235, ver respuesta en pág. . 254) 33
 Problemas estequiometria 3 eso
Problemas estequiometria 3 eso Conclusion de estequiometria
Conclusion de estequiometria A palavra estequiometria do grego
A palavra estequiometria do grego Numero de equivalentes normalidad
Numero de equivalentes normalidad Acido acetico
Acido acetico Formulas empiricas ejemplos
Formulas empiricas ejemplos Estequiometria
Estequiometria Gases
Gases Bienvenidos a una nueva semana
Bienvenidos a una nueva semana En que semana del tiempo ordinario estamos
En que semana del tiempo ordinario estamos Modulo 23 semana 2
Modulo 23 semana 2 Obras da semana de arte moderna de 1922
Obras da semana de arte moderna de 1922 Esta semana
Esta semana Que haces normalmente los fines de semana
Que haces normalmente los fines de semana Veces vas a la biblioteca durante la semana?
Veces vas a la biblioteca durante la semana? Mga halimbawa ng dula sa panahon ng kastila
Mga halimbawa ng dula sa panahon ng kastila Luna de parasceve
Luna de parasceve Parasha de la semana mesianica
Parasha de la semana mesianica Módulo 23 semana 2 fase 4
Módulo 23 semana 2 fase 4 Que semana estamos del tiempo ordinario
Que semana estamos del tiempo ordinario 70 semanas cuantos años son
70 semanas cuantos años son Modulo 23 semana 2 fase 3
Modulo 23 semana 2 fase 3 A semana cv
A semana cv Y el primer dia de la semana biblia
Y el primer dia de la semana biblia Adonde vas ahora a la clase de matematicas
Adonde vas ahora a la clase de matematicas Crase dias da semana
Crase dias da semana Los dias de la semana en kichwa
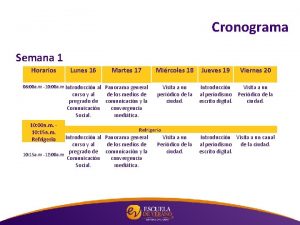
Los dias de la semana en kichwa Cronograma de la semana
Cronograma de la semana Tercera semana de desarrollo
Tercera semana de desarrollo Semana de estudos intensivos
Semana de estudos intensivos Navetero
Navetero Parasha pinjas messianic torah
Parasha pinjas messianic torah Buscad primeramente el reino de dios y su justicia
Buscad primeramente el reino de dios y su justicia Y el primer dia de la semana biblia
Y el primer dia de la semana biblia