Semana 19 y 20 2017 Alcoholes Fenoles Eteres

























- Slides: 32

Semana 19 y 20 2017 Alcoholes, Fenoles, Eteres, Tioles En esta presentación, se estudiaran familias que poseen grupos funcionales con oxígeno : Alcoholes, Fenoles, Eteres y que poseen grupos funcionales con azufre: Tioles ó mercaptanos. Diapositivas con imágenes cortesía de Licda. Lilian Guzmán

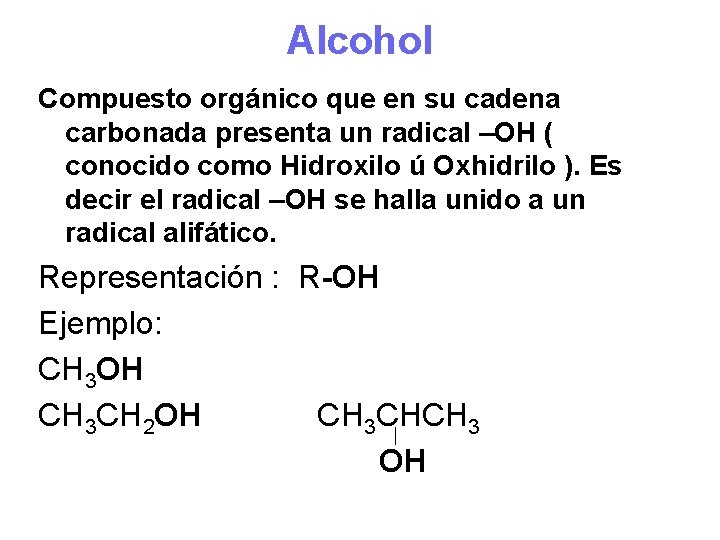
Alcohol Compuesto orgánico que en su cadena carbonada presenta un radical –OH ( conocido como Hidroxilo ú Oxhidrilo ). Es decir el radical –OH se halla unido a un radical alifático. Representación : R-OH Ejemplo: CH 3 OH CH 3 CH 2 OH CH 3 CHCH 3 OH

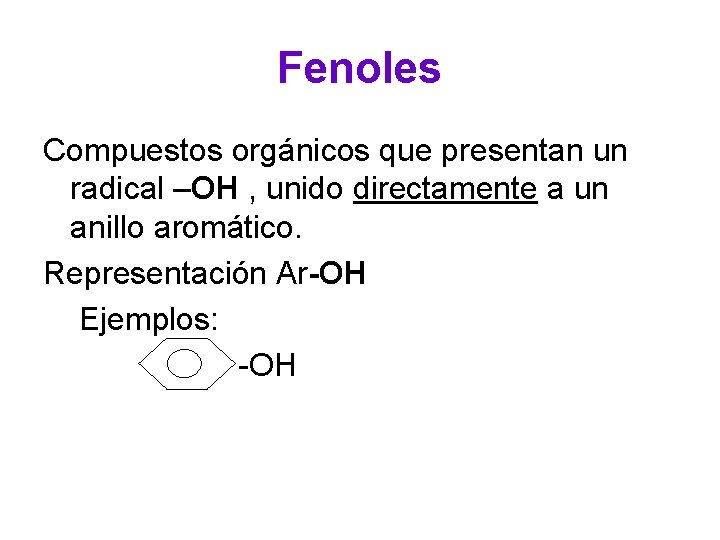
Fenoles Compuestos orgánicos que presentan un radical –OH , unido directamente a un anillo aromático. Representación Ar-OH Ejemplos: -OH

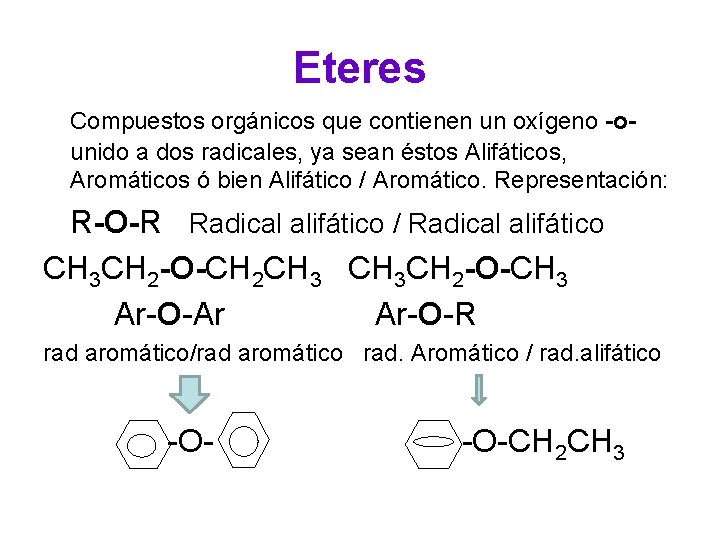
Eteres Compuestos orgánicos que contienen un oxígeno -ounido a dos radicales, ya sean éstos Alifáticos, Aromáticos ó bien Alifático / Aromático. Representación: R-O-R Radical alifático / Radical alifático CH 3 CH 2 -O-CH 2 CH 3 CH 2 -O-CH 3 Ar-O-Ar Ar-O-R rad aromático/rad aromático rad. Aromático / rad. alifático -O-CH 2 CH 3

Tioles ó mercaptanos Compuestos orgánicos que poseen dentro de su estructura al radical –SH ( tiol ó mercaptano). Se representan: R-S H. Ejemplos: CH 3 CH 2 SH CH 3 CHCH 3 SH note que son iguales a los alcoholes, pero tienen Azufre ( S) en lugar de Oxígeno. “tio” = “azufre”.

Clasificación de alcoholes Se clasifican de acuerdo al tipo de carbono al que se halla unido el radical –OH: Primarios: radical –OH unido a un carbono primario : CH 3 CH 2 -OH Secundarios: -OH unido a un Carbono 2 ario. CH 3 -CH-CH 3 OH Terciarios: -OH unido a Carbono 3 ario. CH 3 (CH 3)3 -C-OH CH 3 -C-CH 3 OH

Propiedades físicas de alcoholes y fenoles • Debido a la presencia del radical –OH, los alcoholes y fenoles son más polares y pueden formar Puentes de Hidrogeno, con el agua, lo que los hace más solubles que los alcanos respectivos. • También pueden formar puentes de Hidrogeno entre ellos, por lo tanto son líquidos en su mayoría ó sólidos y tienen puntos de ebullición mayores que los alcanos respectivos. • .

Al igual que todos, sus puntos de ebullición, fusión y densidad, aumentan al aumentar lo longitud de la cadena carbonada en tanto que la solubilidad en agua disminuye. Para alcoholes isoméricos ; al aumentar las ramificaciones: - Aumenta la solubilidad - Disminuye su punto de ebullición.

Propiedades físicas de éteres Debido a que en los éteres, no poseen Hidrogeno unido al Oxígeno, no forman Puentes de Hidrógeno de forma significativa, por lo tanto son poco solubles en agua, poseen puntos de ebullición más bajos que los alcoholes respectivos, por eso son muy volátiles.

Nomenclatura UIQPA de alcoholes. 1 -Escoger la cadena carbonada más larga que incluya al grupo funcional –OH. 2 -Numerar la cadena desde el extremo más cercano al radical –OH. 3 - Dar la posición del radical –OH por el número respectivo, y hacer terminar el nombre del alcano básico en “ol”. 4 - Si hay sustituyentes, éstos se nombran primero ( seguir normas ya vistas).

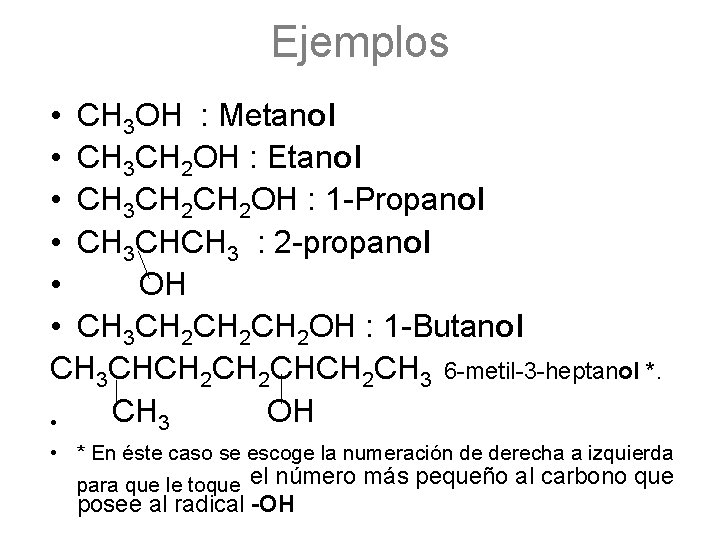
Ejemplos • CH 3 OH : Metanol • CH 3 CH 2 OH : Etanol • CH 3 CH 2 OH : 1 -Propanol • CH 3 CHCH 3 : 2 -propanol • OH • CH 3 CH 2 CH 2 OH : 1 -Butanol CH 3 CHCH 2 CHCH 2 CH 3 6 -metil-3 -heptanol *. CH 3 OH • • * En éste caso se escoge la numeración de derecha a izquierda para que le toque el número más pequeño al carbono que posee al radical -OH

Continuación construya las estructuras de: • a) 4, 4 -dimetil-2 -hexanol • b) 2 -etil-1 -pentanol d) 2, 4 -hexanodiol c) Ciclohexanol

Nombres comunes de alcoholes Se antepone la palabra “alcohol” y a continuación el nombre del alcano que lo origina quitando la terminación ano y se agrega “ílico”. Ó bien el nombre del radical al cual esta unido el –OH terminado en ico. Si hay posibilidad de isómeros se usan después de la palabra alcohol ; prefijos como: “ n- ; sec, ter”, que indica si el radical –OH se halla en un carbono primario, secundario ó terciario.

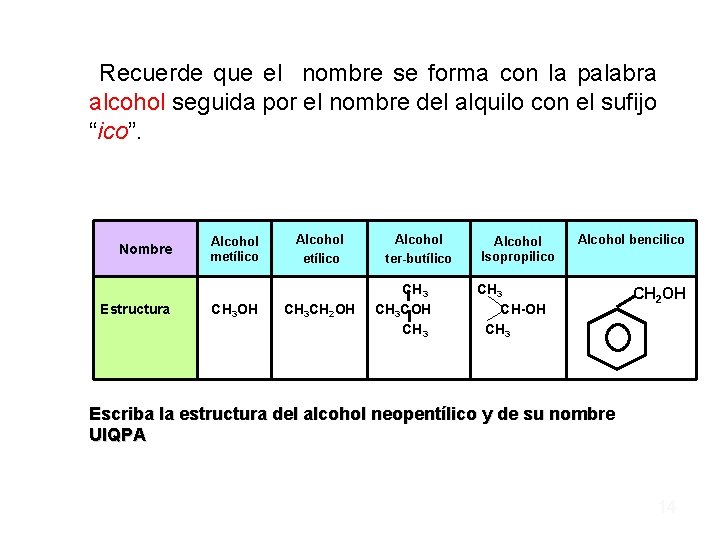
Recuerde que el nombre se forma con la palabra alcohol seguida por el nombre del alquilo con el sufijo “ico”. Nombre Estructura Alcohol metílico CH 3 OH Alcohol etílico CH 3 CH 2 OH Alcohol ter-butílico CH 3 COH CH 3 Alcohol Isopropilico Alcohol bencilico CH 3 CH-OH CH 3 CH 2 OH Escriba la estructura del alcohol neopentílico y de su nombre UIQPA 14

Ejemplos de uso de nomenclatura común. CH 3 OH : alcohol metílico ( UIQPA : Metanol ) CH 3 CH 2 OH : alcohol etílico ( UIQPA : Etanol) CH 3 CH 2 OH: alcohol n-propílico (UIQPA : 1 -Propanol) CH 3 CHCH 3 alcohol isopropílico (UIQPA: 2 -Propanol ) OH CH 3 CH 2 CH 2 OH: alcohol n-butílico (UIQPA: 1 - Butanol) • CH 3 CHCH 2 CH 3 : alcohol sec-butílico (UIQPA: 2 -Butanol) OH • (CH 3 )3 C-OH: alcohol ter-butílico (2 -metil-2 -propanol)

Propiedades químicas de alcoholes Oxidación con KMn. O 4 Los alcoholes primarios se oxidan a aldehídos. Los alcoholes secundarios se oxidan a cetonas. Los alcoholes terciarios no experimentan oxidación bajo éstas condiciones. La manifestación de la reacción positiva es una coloración café con precipitado, que se debe a la formación de Mn. O 2

Reacción de un alcohol primario con KMn. O 4, El alcohol primario se convierte en un aldehído • Representación general : R-CH 2 OH + KMn. O 4 R-CHO + Mn. O 2 + KOH + H 2 O Alcohol primario (aldehido) Ejemplos: CH 3 CH 2 OH + KMn. O 4 CH 3 CHO + Mn. O 2 + KOH +H 2 O Etanol Etanal Complete: CH 3 CH 2 CH 2 OH + KMn. O 4

Reacción de un alcohol secundario con KMn. O 4 El alcohol se convierte en una cetona Representación general: RCHR + KMn. O 4 RCOR + Mn. O 2 (s) + KOH + H 2 O cetona OH Alcohol secundario CH 3 CH 2 CHCH 3 +KMn. O 4 CH 3 CH 2 COCH 3 + Mn. O 2(s) + KOH + H 2 O OH Butanona 2 - Butanol ( alcohol 2 ario) (una cetona) Complete la siguiente reacción: 3 -hexanol + KMn. O 4

Prueba ó reacción de Lucas • Reactivo de Lucas ( HCl concentrado como reactivo y Zn. Cl 2 como catalítico). • Es una reacción de sustitución donde se sustituye el radical –OH de un alcohol por un ion cloruro (Cl-). Como subproducto se obtiene H 2 O. • La manifestación de la reacción es una “turbidez en el fondo del tubo”. • Al añadir el reactivo de Lucas debe hacerse “resbalado por las paredes del tubo y NO debe agitarse. • Los alcoholes terciarios reaccionan inmediatamente a temperatura ambiente. Los secundarios a los 1 -3 ‘, en baño Maria ( no hirviendo). Los Primarios dan una reacción negativa( aún en Baño Maria).

Ejemplos de reacción de Lucas : Zn. Cl 2 CH 3 CH 2 CHCH 3 + HCl CH 3 CH 2 CHCH 3 + H 2 O OH calor Cl Únicamente se sustituye el radical –OH por el Cl Zn. Cl 2 (CH 3)3 C-OH + HCl (CH 3)3 C-Cl + H 2 O Escriba la reacción de Lucas con el : a) 2 -metil-3 -pentanol b) 3 -metil-3 -hexanol

Deshidratación a 180°C con H 2 SO 4 concentrado. Los alcoholes pierden una molécula de H 2 O( se deshidratan), con ácido sulfúrico concentrado y originan un Alqueno. Esta reacción sigue la regla de Saytseff, que dice que el producto principal es el alqueno más ramificado ( el que posee más radicales alrededor del doble enlace, es decir casi NO se produce un alqueno cuyo doble enlace se halle en un extremo de la cadena a menos que el alcohol sea primario. )

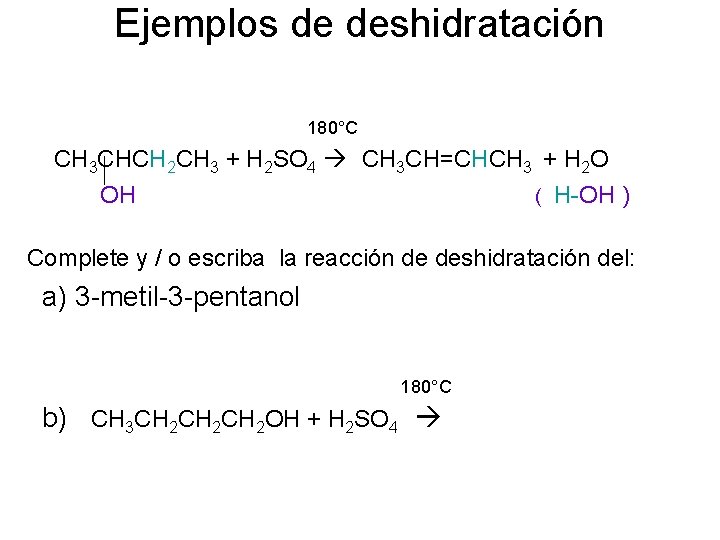
Ejemplos de deshidratación 180°C CH 3 CHCH 2 CH 3 + H 2 SO 4 CH 3 CH=CHCH 3 + H 2 O OH ( H-OH ) Complete y / o escriba la reacción de deshidratación del: a) 3 -metil-3 -pentanol 180°C b) CH 3 CH 2 CH 2 OH + H 2 SO 4

Usos y riesgos de algunos alcoholes • CH 3 OH ( alcohol metílico, metanol)”alcohol de madera”. Materia prima en la fabricación de formaldehído y polímeros, solvente y combustible en “Sterno” y mecheros para mantener la comida caliente. Altamente tóxico su ingestión produce ceguera y muerte. • CH 3 CH 2 OH : (alcohol etílico, etanol) “alcohol de grano”. , alcohol presente en todas las bebidas alcohólicas. Se usa como desinfectante, solvente y se puede adicionar a la gasolina. Al beberlo en cantidades moderadas, afecta el juicio personal y reduce inhibiciones. A mayor cantidad afecta coordinación motriz y articulación del habla, en mayores cantidades causa naúsea y pérdida de la conciencia. Y en cantidades elevadas puede causar paro respiratorio y muerte.

Continuación de usos e importancia CH 3 CHCH 3: “ 2 -propanol ó alcohol isopropílico. OH : sustituto del etanol para desinfección y fricciones. Es más toxico y no bebible. HOCH 2 OH Etilenglicol ó 1, 2 -etanodiol: principal componente del anticongelante. CH 2 OHCH 2 OH: 1, 2, 3 -propanotriol ( glicerol ó glicerina): producto de la digestión de grasas, usado en cremas pues favorece la humectación é hidratación. También usado como aditivo en alimentos.

ALCOHOL BENCÍLICO Usado en lociones que se aplican en el cuero cabelludo para tratar la pediculosis (piojos). Posee una ligera acción anestésica y antipruriginosa. También es usado como bacteriostático en soluciones inyectables. En neonatos se asocia al síndrome tóxico fatal, por eso se restringe su uso en ellos. 25

Tioles ó mercaptanos R-SH • Nombre UIQPA: • Se nombran igual que alcohol, pero se hace terminar en ”tiol”. • Nombre COMUN : se coloca el nombre del radical al que se halla unido el –SH y a continuación la palabra “mercaptano”.

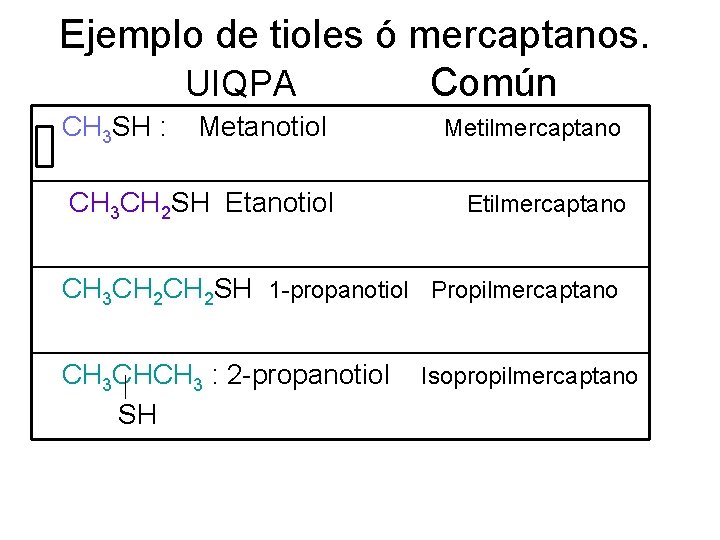
Ejemplo de tioles ó mercaptanos. UIQPA Común CH 3 SH : Metanotiol CH 3 CH 2 SH Etanotiol Metilmercaptano Etilmercaptano CH 3 CH 2 SH 1 -propanotiol Propilmercaptano CH 3 CHCH 3 : 2 -propanotiol SH Isopropilmercaptano

Nomenclatura de éteres (común / UIQPA • Común se enumeran los radicales en orden alfabético y a continuación la palabra éter. Si el mismo radical está presente se usa el prefijo “di”. • UIQPA: El radical más pequeño se nombra como un «alcoxi» y a continuación el nombre del alcano correspondiente al otro radical de mayor tamaño. • Común UIQPA • CH 3 OCH 3 : Dimetiléter Metoximetano • CH 3 CH 2 OCH 3 : Etilmetiléter. Metoxietano • CH 3 CH 2 OCH 2 CH 3: Etilpropiléter 1 -Etoxipropano • CH 3 CHOCH 2 CH 3 : Etilisopropiléter 2 -etoxipropano • CH 3

Usos y riesgos de algunos éteres El dietiléter: antiguamente usado como anestésico general. Actualmente se usa como solvente de sustancias apolares. Metilterbutiléter : se inyecta directamente en la vesícula biliar a través de un catéter, éste disuelve los cálculos que principalmente son de colesterol ( grasa), no presenta efectos secundarios desagradables.


Importancia de los tioles y tioeteres • El aminoácido metionina, posee una función “tioéter” y la Cisteina una función “tiol”. • Los tioles tienen olores desagradables EJ: • 3 -metil-1 -butanotiol : olor del zorrillo. • 1 -Propanotiol: olor de cebollas ( también es lacrimógeno) Mezcla de metanotiol y etanotiol: se agrega al gas para darle un “olor de advertencia”.

Comente química y salud, pág. 494, 495 y 490
 Site:slidetodoc.com
Site:slidetodoc.com Fenoles
Fenoles Eteres
Eteres Formula general de los eteres
Formula general de los eteres Los teres
Los teres Grupo funcional éster ejemplos
Grupo funcional éster ejemplos Eteres
Eteres Eteres concepto
Eteres concepto Nomenclatura común
Nomenclatura común Resistencia propiedades de los materiales
Resistencia propiedades de los materiales Dioles vecinales
Dioles vecinales Reducción de alquenos
Reducción de alquenos Alcoholes inocenti
Alcoholes inocenti Grupo funcional que identifica a los alcoholes
Grupo funcional que identifica a los alcoholes Meningohidroencefalocele
Meningohidroencefalocele Wrap irregular verb
Wrap irregular verb Lámina de la semana santa
Lámina de la semana santa Esta semana en amores
Esta semana en amores Miguel, ¿____ jugar al golf el fin de semana?
Miguel, ¿____ jugar al golf el fin de semana? Is a menudo preterite or imperfect
Is a menudo preterite or imperfect Sulu sou
Sulu sou ¿adónde vas los fines de semana?
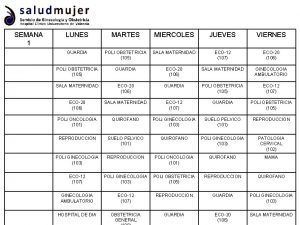
¿adónde vas los fines de semana? Semana 1 lunes martes miércoles jueves viernes
Semana 1 lunes martes miércoles jueves viernes Un autobus recorre cada dia de la semana 210 kilometros
Un autobus recorre cada dia de la semana 210 kilometros Parasha de la semana mesianica
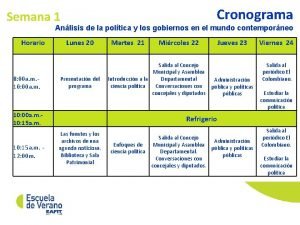
Parasha de la semana mesianica Cronograma de la semana
Cronograma de la semana No primeiro dia da semana maria madalena
No primeiro dia da semana maria madalena A semana da arte moderna
A semana da arte moderna Das de la semana
Das de la semana Y el primer dia de la semana biblia
Y el primer dia de la semana biblia Semana r
Semana r En que semana del tiempo ordinario estamos
En que semana del tiempo ordinario estamos En que semana del tiempo ordinario estamos
En que semana del tiempo ordinario estamos