SEMANA 19 ALCOHOLES y FENOLES SEMANA 20 TIOLES




















- Slides: 33

SEMANA 19 ALCOHOLES y FENOLES SEMANA 20 TIOLES Y ÉTERES QUÍMICA 2020 1

Semana 19 ALCOHOLES Y FENOLES Alcoholes Definición y representación general. Clasificación. Nomenclatura UIQPA y Común. Polihidroxilados (etilenglicol, propilenglicol, trimetilenglicol, glicerol) Isomería: -Posición -Función Propiedades físicas Reacciones químicas: -Oxidación con KMn. O 4 (frío) -Prueba de Lucas -Deshidratación a 180°C, con H 2 SO 4 (conc. ) aplicando Regla de Zaitsev Fenoles Definición y representación general. Nomenclatura. Propiedades Físicas. Reacción con Fe. Cl 3 Aplicación de los conceptos en la salud y el ambiente. Lecturas en libro de texto - La Química en la Salud: “Algunos alcoholes y fenoles importantes” “Desinfectante de manos y etanol” “Intoxicación con metanol” “Oxidación de etanol en el cuerpo” - Otras que se informe. Laboratorio: Propiedades físicas y químicas de alcoholes y fenoles. 2

Semana 20 TIOLES Y ÉTERES Tioles Definición y representación general. Nomenclatura UIQPA y común Importancia y usos Éteres Definición y representación general Nomenclatura UIQPA y Común Propiedades físicas Aplicación de los conceptos en la salud y el ambiente. Lecturas en libro de texto - La Química en el Ambiente -“Éteres tóxicos” -La Química en la Salud: -“Éteres como anestésicos 3

ALCOHOLES • Compuestos orgánicos con OXÍGENO. • Tienen la función química –OH (hidroxilo). • Representación: R-OH (R es radical alifático o alquilo -no aromático- ) Ej: CH 3 -OH, CH 3 CH 2 -OH • Clasificación: según el C al que se une el –OH Alcohol 1º Alcohol 2º Alcohol 3º (CH 3)3 -C-OH = 4

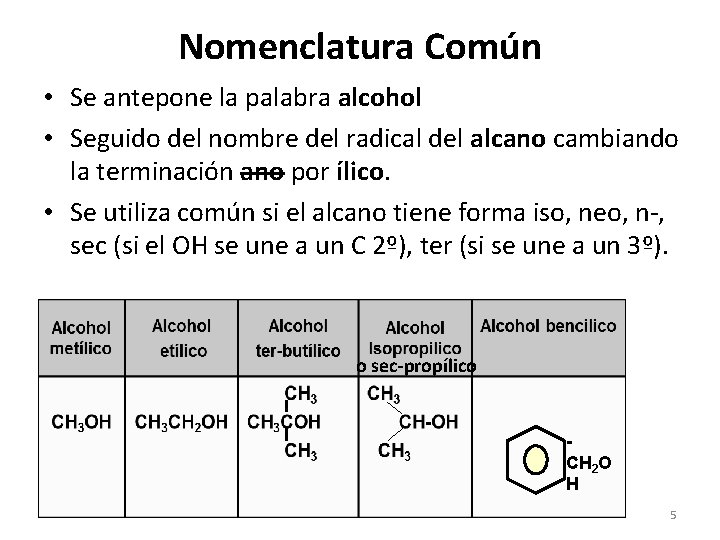
Nomenclatura Común • Se antepone la palabra alcohol • Seguido del nombre del radical del alcano cambiando la terminación ano por ílico. • Se utiliza común si el alcano tiene forma iso, neo, n-, sec (si el OH se une a un C 2º), ter (si se une a un 3º). o sec-propílico CH 2 O H 5

Nomenclatura UIQPA • Utilizar las mismas reglas básicas para alcanos. • La prioridad al numerar la cadena carbonada la tiene la función química hidroxilo (-OH), el # menor de C. • El nombre básico será el del alcano cambiando la terminación ano por ol. Se indica la posición del OH. • Si hay más de un –OH se usan prefijos diol, triol, etc. Nombrar y Clasificar: 6

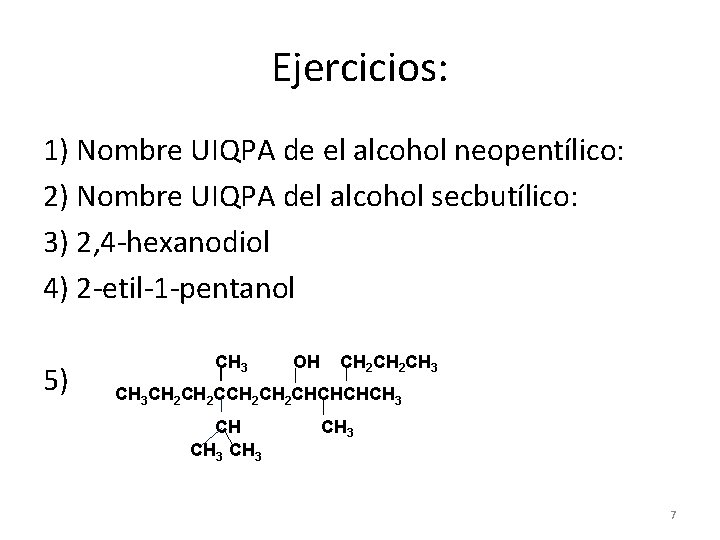
Ejercicios: 1) Nombre UIQPA de el alcohol neopentílico: 2) Nombre UIQPA del alcohol secbutílico: 3) 2, 4 -hexanodiol 4) 2 -etil-1 -pentanol 5) CH 3 OH CH 2 CH 3 CH 2 CH 2 CHCHCHCH 3 CH 3 7

Alcoholes polihidroxilados (algunos ejemplos) Los Glicoles: tiene 2 grupos hidroxilos (OH-). Ejemplos: • Etilenglicol o 1, 2 -etanodiol (uso: anticongelante, es tóxico) HO-CH 2 OH • Propilenglicol o 1, 2 -propanodiol (uso: humectante, solvente) • Trimetilenglicol o 1, 3 - propanodiol HO-CH 2 CH 2 OH (uso: síntesis de polímeros) Con 3 grupos OH • Glicerol, glicerina o 1, 2, 3 -propanotriol (humectante, forma parte de los lípidos) 8

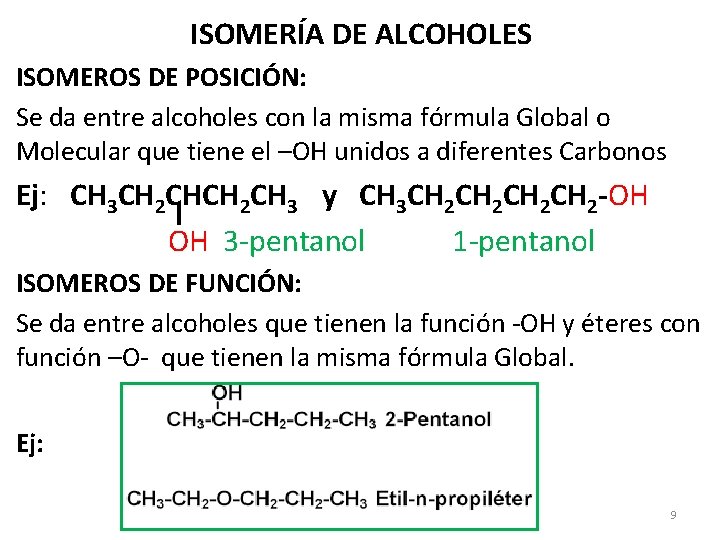
ISOMERÍA DE ALCOHOLES ISOMEROS DE POSICIÓN: Se da entre alcoholes con la misma fórmula Global o Molecular que tiene el –OH unidos a diferentes Carbonos Ej: CH 3 CH 2 CH 3 y CH 3 CH 2 CH 2 -OH OH 3 -pentanol 1 -pentanol ISOMEROS DE FUNCIÓN: Se da entre alcoholes que tienen la función -OH y éteres con función –O- que tienen la misma fórmula Global. Ej: 9

Propiedades físicas • Los alcoholes de 1 a 4 carbonos son solubles en H 2 O porque el –OH le da polaridad a la molécula. • De 5 a más C son más apolares por lo que son solubles en solventes orgánicos (apolares). • Los isómeros ramificaciones son más solubles que los lineales. • Los alcoholes tienen puntos de ebullición mas altos que los alcanos porque sus moléculas forman puentes de H entre sus grupos –OH. • Alcoholes de 1 a 10 C son líquidos, incoloros, olor característico. De 11 a más son sólidos cristalinos, blancos. 10

Usos y riesgos • Alcohol metílico ó metanol: se absorbe por la piel y es tóxico, por lo que no se debe usar para fricciones, causa ceguera, y muerte al ingerir 30 ml. • Alcohol etílico ó etanol: usado en bebidas alcohólicas. Se utiliza como desinfectante y para fricciones. (El etanol comercial no es ingerible). • Alcohol isopropílico: es tóxico al ingerirlo. No se absorbe por la piel por lo que se usa en fricciones • Etilenglicol (1, 2 -etanodiol): anticongelante, tóxico. • Glicerol o glicerina (1, 2, 3 -propanotriol): humectante. 11

REACCIONES QUÍMICAS DE ALCOHOLES Oxidación con permanganato de potasio (KMn. O 4) Los alcoholes 1º se oxidan y forman aldehídos (el aldehído puede seguir reaccionando hasta formar ácidos carboxílicos R-COOH) O RCH 2 OH + KMn. O 4→ R-C-H + H 2 O + Mn. O 2 + KOH Alcohol CH 3 CH 2 CH 2 OH + KMn. O 4 Aldehído Dióxido de Manganeso (prec. Café) O CH 3 CH 2 CH + H 2 O + Mn. O 2 + KOH butanal precipitado café 12

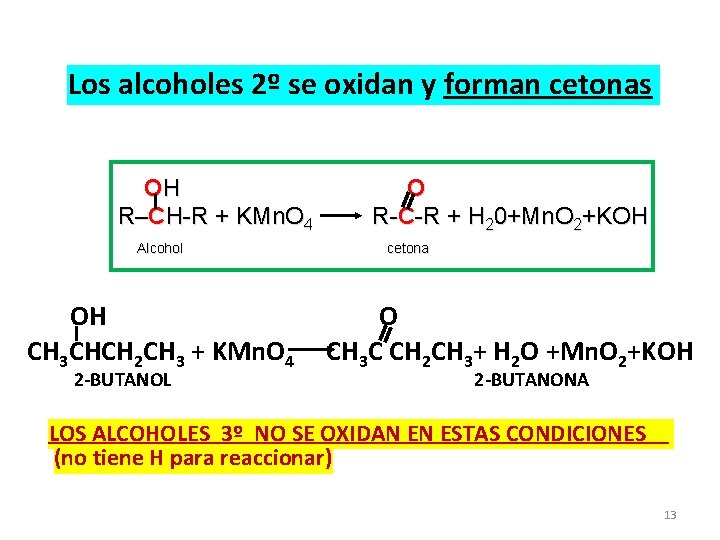
Los alcoholes 2º se oxidan y forman cetonas OH R–CH-R + KMn. O 4 Alcohol OH CH 3 CHCH 2 CH 3 + KMn. O 4 2 -BUTANOL O R-C-R + H 20+Mn. O 2+KOH cetona O CH 3 C CH 2 CH 3+ H 2 O +Mn. O 2+KOH 2 -BUTANONA LOS ALCOHOLES 3º NO SE OXIDAN EN ESTAS CONDICIONES (no tiene H para reaccionar) 13

REACCIÓN ó PRUEBA DE LUCAS esta servirá para la muestra desconocida #2 (El Reactivo de Lucas consiste en: HCl conc. + Zn. Cl 2 ) El Cloro Sustituye al –OH y forma un derivado halogenado ALCO HOL 1 o. 2 o. 3 o. MANIFESTACION REACCION CH 3 -CH 2 -OH + HCl Zn. Cl 2 NO HAY REACCION Zn. Cl 2 (CH 3)2 -CH-OH + HCl (CH 3)2 -CH-Cl + H 2 O (necesita calentamiento en baño de maria) (CH 3)3 -C-OH + HCl Zn. Cl 2 (CH 3)3 -C-Cl + H 2 O NO HAY TURBIDEZ después de calentar TURBIDEZ INMEDIATA sin calentar 14

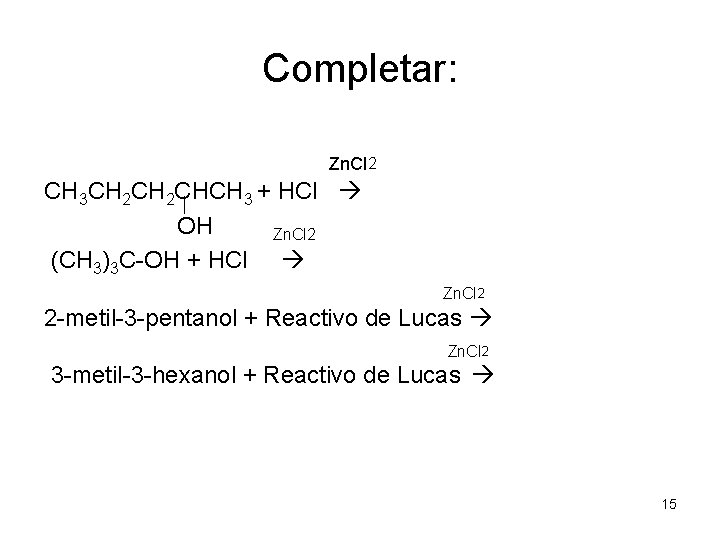
Completar: Zn. Cl 2 CH 3 CH 2 CHCH 3 + HCl OH Zn. Cl 2 (CH 3)3 C-OH + HCl Zn. Cl 2 2 -metil-3 -pentanol + Reactivo de Lucas Zn. Cl 2 3 -metil-3 -hexanol + Reactivo de Lucas 15

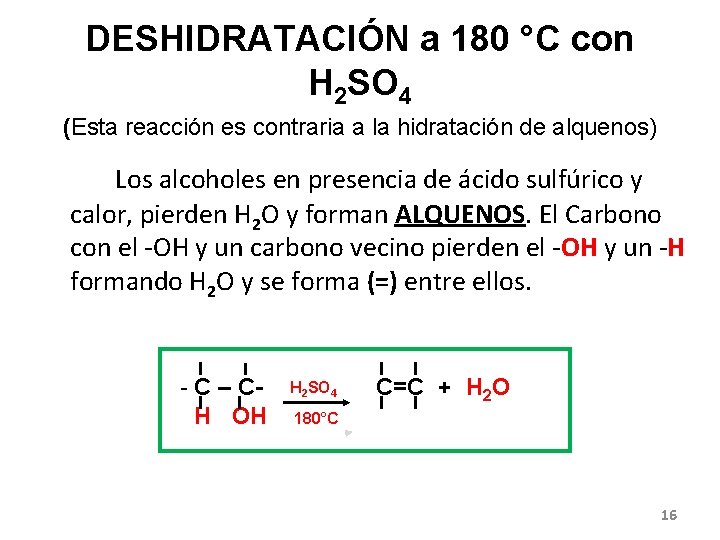
DESHIDRATACIÓN a 180 °C con H 2 SO 4 (Esta reacción es contraria a la hidratación de alquenos) • Los alcoholes en presencia de ácido sulfúrico y calor, pierden H 2 O y forman ALQUENOS. El Carbono con el -OH y un carbono vecino pierden el -OH y un -H formando H 2 O y se forma (=) entre ellos. - C – CH OH H 2 SO 4 C=C + H 2 O 180°C 16

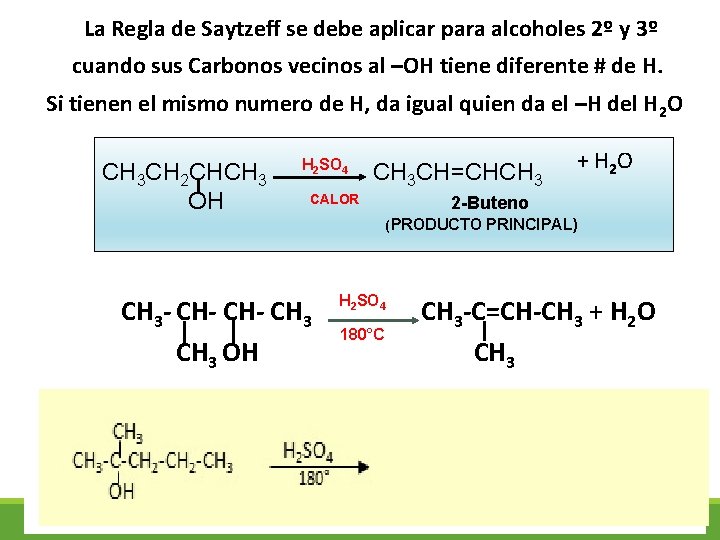
• Cuando se deshidrata un alcohol 2º o 3º se pueden formar dos alquenos dependiendo de cuál de los Hidrógenos de los C vecinos se eliminen con el –OH. • Esto lo determina la Regla de Saytzeff: El doble enlace se formará principalmente (o sea en mayor %) entre el carbono que contienen al grupo -OH y el C vecino que tenga menos hidrógenos del alcohol. (es contraria a la Regla de Markovnikof) Producto principal: es el alqueno que se forma en mayor% Producto secundario: es el que se forma en menor % 17

La Regla de Saytzeff se debe aplicar para alcoholes 2º y 3º cuando sus Carbonos vecinos al –OH tiene diferente # de H. Si tienen el mismo numero de H, da igual quien da el –H del H 2 O CH 3 CH 2 CHCH 3 OH H 2 SO 4 CH 3 CH=CHCH 3 CALOR + H 2 O 2 -Buteno ( PRODUCTO PRINCIPAL) CH 3 - CH- CH 3 OH H 2 SO 4 180°C CH 3 -C=CH-CH 3 + H 2 O CH 3 18

Fenoles • Compuestos orgánicos con OXÍGENO que presentan un radical –OH (hidroxilo) unido directamente a un anillo aromático. • Representación Ar-OH Fenol 19

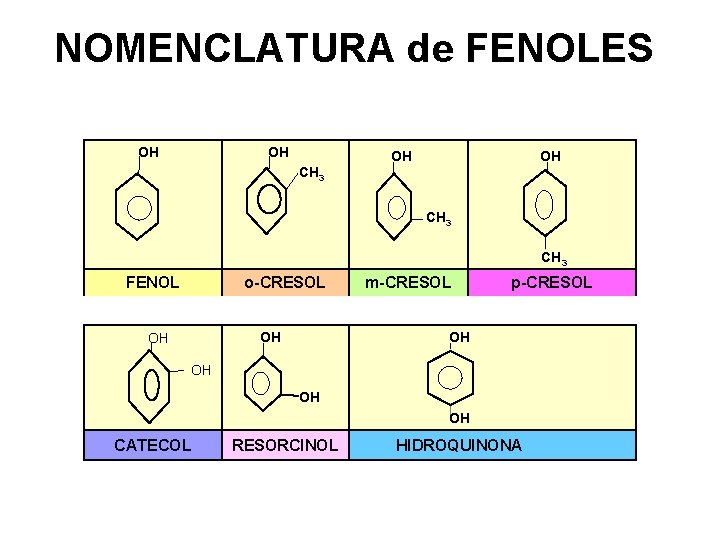
NOMENCLATURA de FENOLES OH OH CH 3 FENOL o-CRESOL OH OH m-CRESOL p-CRESOL OH OH CATECOL RESORCINOL HIDROQUINONA 20

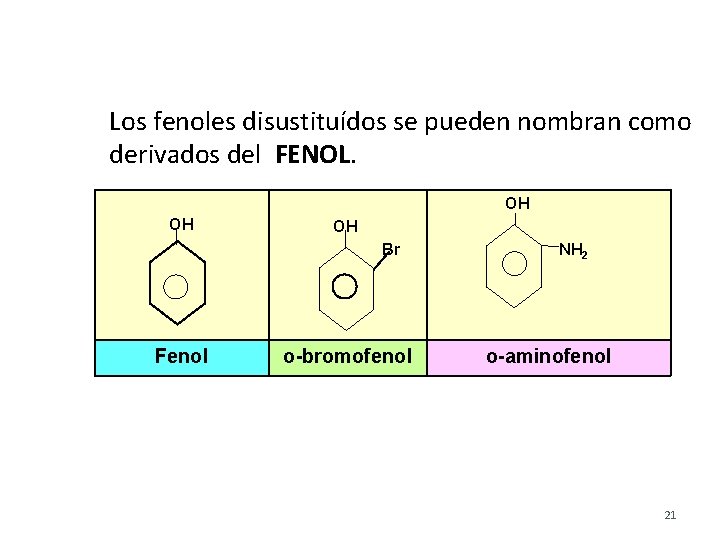
Los fenoles disustituídos se pueden nombran como derivados del FENOL. OH OH OH Br Fenol o-bromofenol NH 2 o-aminofenol 21

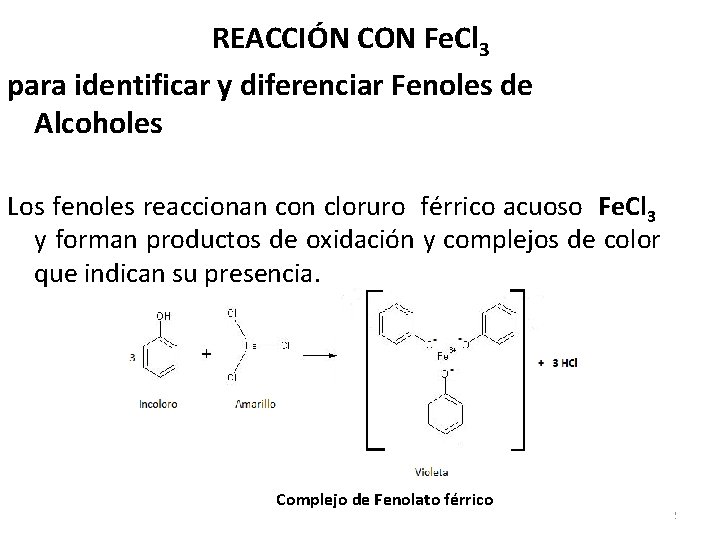
REACCIÓN CON Fe. Cl 3 para identificar y diferenciar Fenoles de Alcoholes Los fenoles reaccionan con cloruro férrico acuoso Fe. Cl 3 y forman productos de oxidación y complejos de color que indican su presencia. REACCIONES DE FENOL Complejo de Fenolato férrico 22

IMPORTANCIA , USOS Y RIESGOS del FENOL • El fenol es muy utilizado como desinfectante fungicida, bactericida, antiséptico. • Si se ingiere en altas concentraciones puede causar envenenamiento • Se absorbe por la piel • Es inflamable, corrosivo y sus gases son explosivos a la llama 23

Semana 20 TIOLES Y ÉTERES Tioles Definición y representación general. Nomenclatura UIQPA y común Importancia y usos Éteres Definición y representación general Nomenclatura UIQPA y Común Propiedades físicas Aplicación de los conceptos en la salud y el ambiente. Lecturas en libro de texto - La Química en el Ambiente -“Éteres tóxicos” -La Química en la Salud: -“Éteres como anestésicos 24

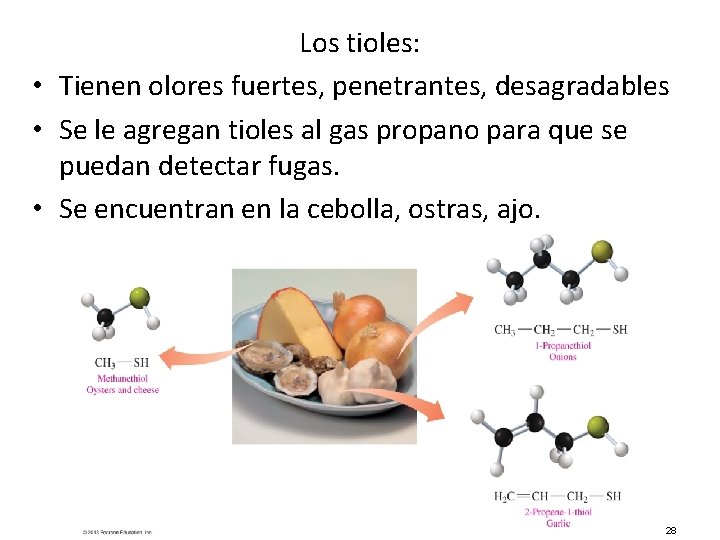
TIOLES ó MERCAPTANOS Compuestos orgánicos con AZUFRE que presentan la función química -SH Representación: R-SH R= radical puede ser alifático o aromático El grupo -SH se conoce como: MERCAPTANO ó SULFHIDRILO. TIENEN OLORES MUY DESAGRADABLES. Se le agrega al gas propano para detectar fugas. 25

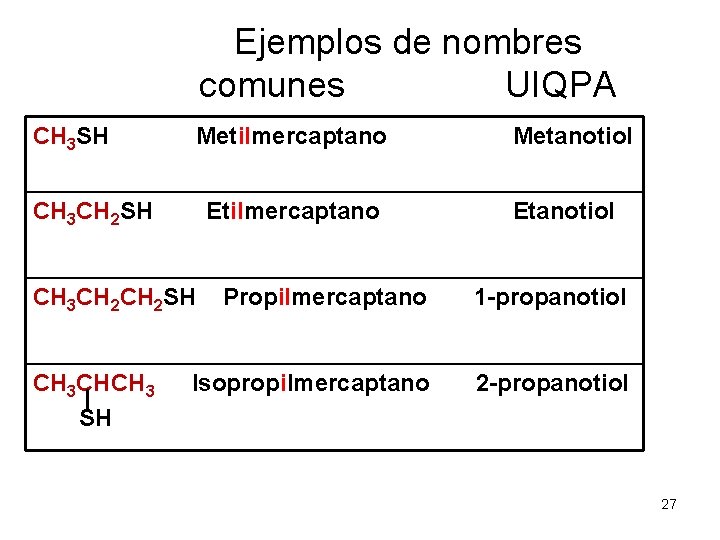
Nomenclatura de tioles ó mercaptanos COMUN: Se menciona primero el nombre del radical (il) del alcano (n, iso, neo, sec, ter) terminado con la palabra mercaptano. UIQPA: Se nombra como alcano con la terminación tiol siguiendo las reglas para los alcanos. 26

Ejemplos de nombres comunes UIQPA CH 3 SH Metilmercaptano CH 3 CH 2 SH Etilmercaptano CH 3 CH 2 SH CH 3 CHCH 3 SH Metanotiol Etanotiol Propilmercaptano 1 -propanotiol Isopropilmercaptano 2 -propanotiol 27

Los tioles: • Tienen olores fuertes, penetrantes, desagradables • Se le agregan tioles al gas propano para que se puedan detectar fugas. • Se encuentran en la cebolla, ostras, ajo. 28

ETERES • Compuestos orgánicos que contienen OXÍGENO y tienen la función química –C-O-C • Representación R-O-R ( también puede ser Ar-O-Ar) NOMENCLATURA COMÚN: • Se nombran los radicales R- unidos al Oxígeno en orden alfabético. R-O-R • El nombre puede empezar o terminar con la palabra éter • El solvente éter corriente es el dimetiléter (CH 3 OCH 3) Ej: CH 3 CH 2 -O-CH 2 CH 3 etiln-propileter ó éter etilnpropílico 29

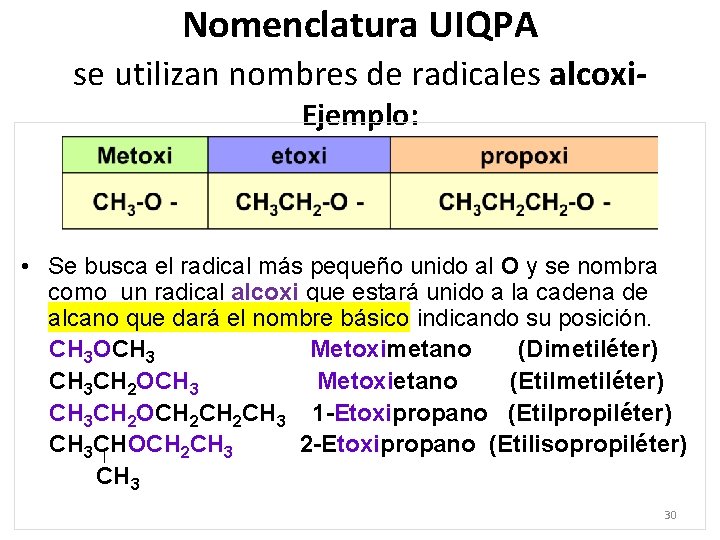
Nomenclatura UIQPA se utilizan nombres de radicales alcoxi. Ejemplo: • Se busca el radical más pequeño unido al O y se nombra como un radical alcoxi que estará unido a la cadena de alcano que dará el nombre básico indicando su posición. CH 3 OCH 3 Metoximetano (Dimetiléter) CH 3 CH 2 OCH 3 Metoxietano (Etilmetiléter) CH 3 CH 2 OCH 2 CH 3 1 -Etoxipropano (Etilpropiléter) CH 3 CHOCH 2 CH 3 2 -Etoxipropano (Etilisopropiléter) CH 3 30

1) CH 3 CH 2 -O-CHCH 2 CH 3 4) CH 3 -CH-CH 2 -CH 3 OCH 3 2) CH 3 CH 2 -O-CH 2 CH 2 CH 2 CH 3 3) CH 3 CH 2 CH 2 CH 3 O-CH 2 CH 3 5) CH 3 -CH-CH 2 -CH 2 -O-CH 2 -CH 3 31

PROPIEDADES FISICAS de los ETERES • Incoloros • Muy volátiles • Menos densos que el agua • Inflamables • Sus moléculas no forman puentes de H entre sí • Olores característicos • Los éteres de 1 a 4 carbonos son solubles en agua porque forman puentes de hidrógeno entre su oxígeno y el agua. 32

Usos y riesgos de algunos éteres • El dietiléter: antiguamente se utilizaba como anestésico general, pero era muy volátil e inflamable y causaba efectos secundarios. Actualmente se usa como solvente de sustancias apolares. • Metilterbutiléter : se inyecta directamente en la vesícula biliar a través de un catéter, éste disuelve los cálculos que principalmente son de colesterol, no presenta efectos secundarios desagradables. 33
 Propiedades químicas de los fenoles
Propiedades químicas de los fenoles Fenoles
Fenoles Como saber el grupo funcional de un compuesto
Como saber el grupo funcional de un compuesto Grupo funcional que identifica a los alcoholes
Grupo funcional que identifica a los alcoholes Amfofilo
Amfofilo Propiedades de los materiales resistencia
Propiedades de los materiales resistencia Reaccion de esterificacion
Reaccion de esterificacion Uso de los alcoholes
Uso de los alcoholes Nomenclatura del alcohol
Nomenclatura del alcohol Semana 1 lunes martes miércoles jueves viernes
Semana 1 lunes martes miércoles jueves viernes Fase 2: diagnóstico. causas y consecuencias
Fase 2: diagnóstico. causas y consecuencias Cronograma de actividades de una cafeteria
Cronograma de actividades de una cafeteria Das de la semana
Das de la semana Mistérios do terço dias da semana
Mistérios do terço dias da semana Lámina de la semana santa
Lámina de la semana santa En que semana del tiempo ordinario estamos
En que semana del tiempo ordinario estamos Modulo 22 fase 1
Modulo 22 fase 1 Altura uterina segun edad gestacional
Altura uterina segun edad gestacional La semana pasada
La semana pasada Quantas prendas a turma 403 já levou para a escola
Quantas prendas a turma 403 já levou para a escola Scvde
Scvde Semana de la salud bucodental
Semana de la salud bucodental En que semana de tiempo ordinario estamos
En que semana de tiempo ordinario estamos Imprimir bienvenidos
Imprimir bienvenidos Cronograma de la semana
Cronograma de la semana Embrion cuarta semana
Embrion cuarta semana Objetivo semana da arte moderna
Objetivo semana da arte moderna Deuteronomio 4 13
Deuteronomio 4 13 Esta semana
Esta semana Setenta semanas de daniel
Setenta semanas de daniel Querer hablar y no poder
Querer hablar y no poder Ano ang salitang espanyol ng sarsuwela
Ano ang salitang espanyol ng sarsuwela Bienvenidos a una nueva semana
Bienvenidos a una nueva semana Lunes martes miercoles jueves viernes
Lunes martes miercoles jueves viernes