QUMICA PSU MISS ROMINA VERGARA C 2020 CONTENIDO








- Slides: 20

QUÍMICA PSU MISS ROMINA VERGARA C. 2020

CONTENIDO: ENLACE IÓNICO Y SUS PROPIEDADES OBJETIVOS • • • Definir un Enlace Químico Conocer los tipos de Enlaces Químicos que existen Identificar el Enlace iónico y sus propiedades

Antes de comenzar… Las Propiedades características de las sustancias están relacionadas con la forma en que están unidas sus partículas y las fuerzas entre ellas, es decir, con el tipo de ENLACE que existe entre sus partículas.

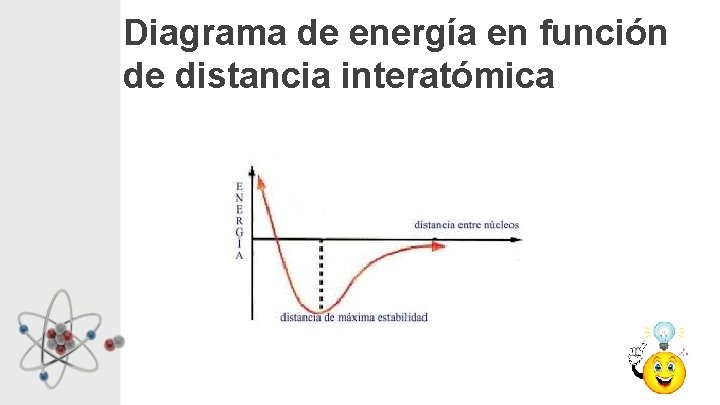
¿Por qué se unen los átomos? • Los átomos, moléculas e iones se unen entre sí, porque la hacerlo se llega a una situación de mínima energía, lo que equivale a decir de máxima estabilidad. • Son los electrones más externos, los también llamados electrones de valencia, los responsables de esta unión, al igual que la estequiometria y geometría de las sustancias químicas

Diagrama de energía en función de distancia interatómica

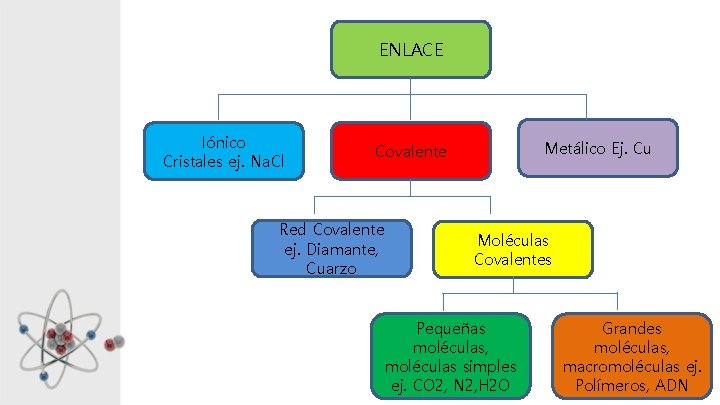
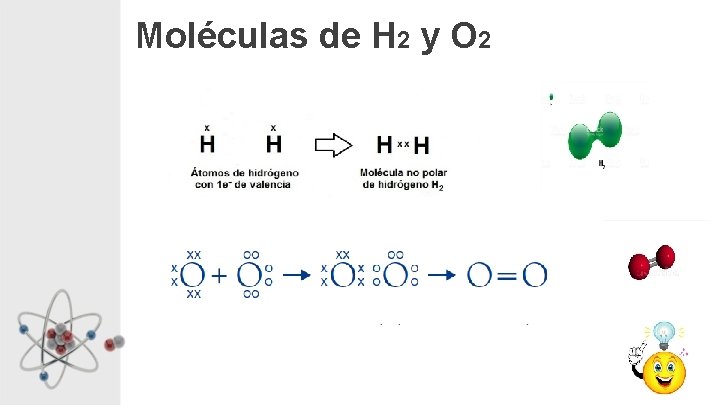
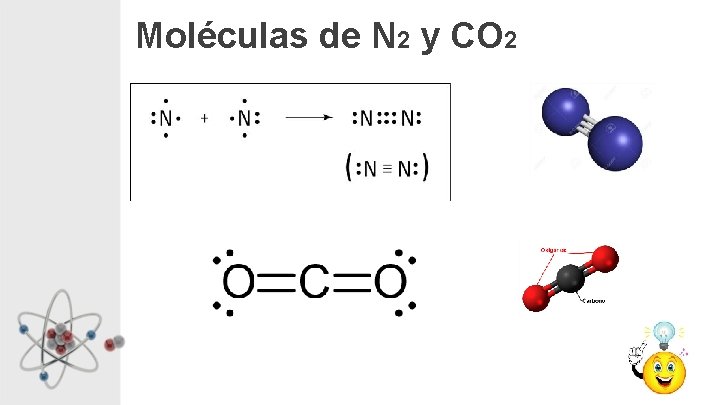
ENLACE Iónico Cristales ej. Na. Cl Metálico Ej. Cu Covalente Red Covalente ej. Diamante, Cuarzo Moléculas Covalentes Pequeñas moléculas, moléculas simples ej. CO 2, N 2, H 2 O Grandes moléculas, macromoléculas ej. Polímeros, ADN

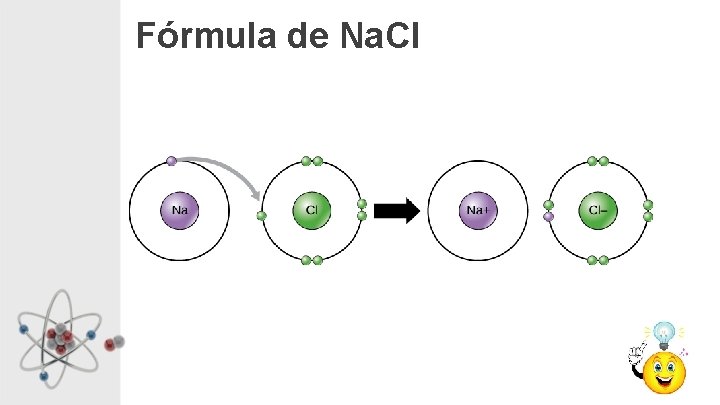
Fórmula de Na. Cl

Fórmula de Mg. F 2

Moléculas de H 2 y O 2

Moléculas de N 2 y CO 2

Tipos de Enlace Iónico Covalente Metálico

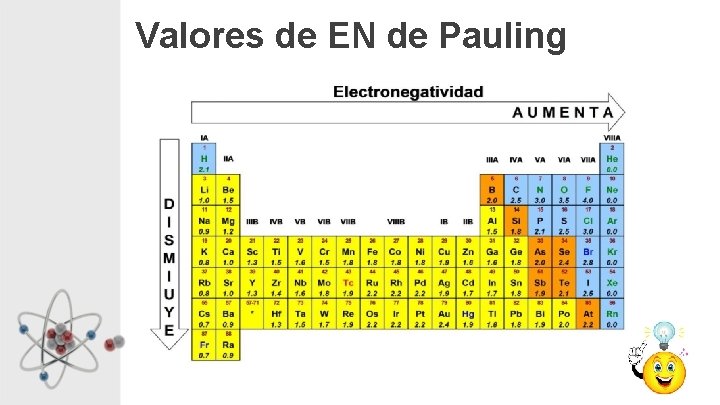
Electronegatividad • Capacidad que tiene un átomo de atraer electrones comprometidos en un enlace. • Los valores de EN son útiles para predecir el tipo de enlace que se puede formar entre átomos de diferentes elementos.

Valores de EN de Pauling

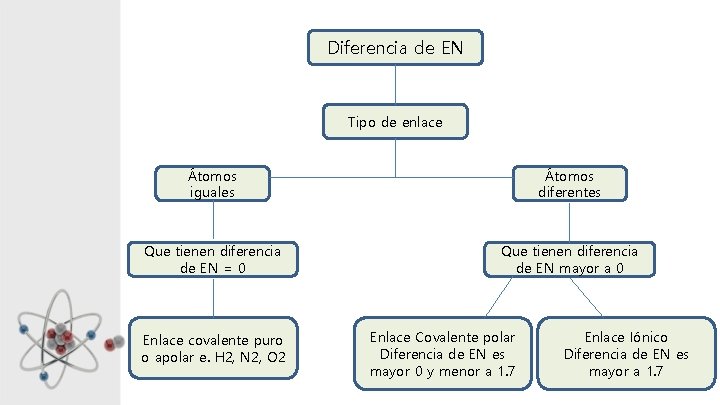
Diferencia de EN Tipo de enlace Átomos iguales Átomos diferentes Que tienen diferencia de EN = 0 Que tienen diferencia de EN mayor a 0 Enlace covalente puro o apolar e. H 2, N 2, O 2 Enlace Covalente polar Diferencia de EN es mayor 0 y menor a 1. 7 Enlace Iónico Diferencia de EN es mayor a 1. 7

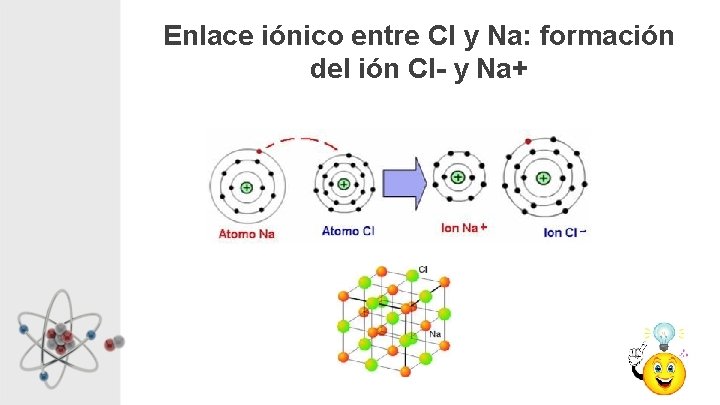
Enlace Iónico • El compuesto iónico se forma al reaccionar un metal con un no metal • Los átomos del metal pierden electrones (se forma un catión) y los acepta el no metal (se forma un anión) • Los iones de distinta carga se atraen electrónicamente, se ordenan y forman una red iónica. Los compuestos iónicos no están formados por moléculas.

Enlace iónico entre Cl y Na: formación del ión Cl- y Na+

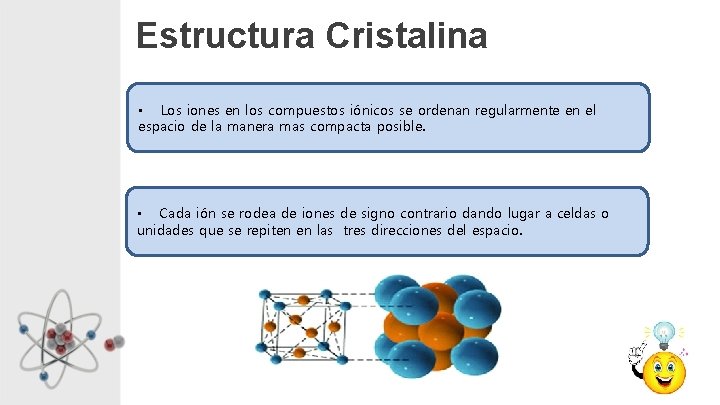
Estructura Cristalina • Los iones en los compuestos iónicos se ordenan regularmente en el espacio de la manera mas compacta posible. • Cada ión se rodea de iones de signo contrario dando lugar a celdas o unidades que se repiten en las tres direcciones del espacio.

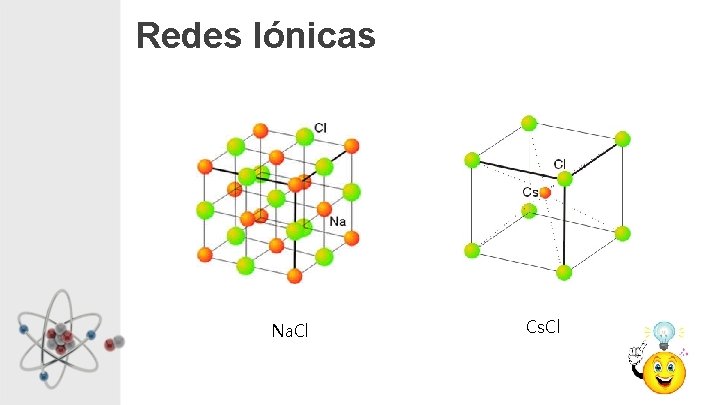
Redes Iónicas Na. Cl Cs. Cl

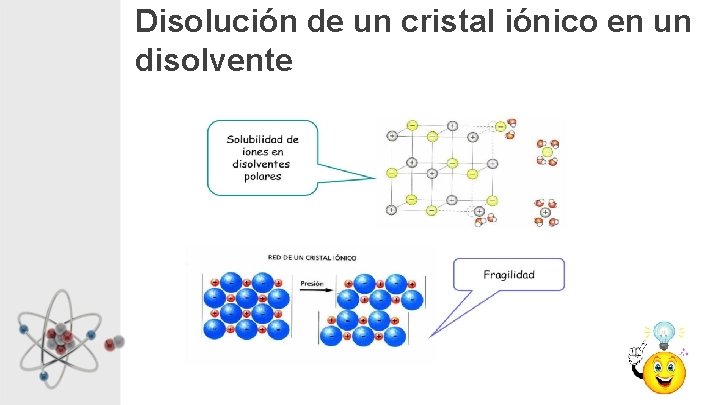
Propiedades Compuestos Iónicos • Forman estructuras cristalinas bien definidas • Elevados puntos de fusión y ebullición. • Solubles en agua y líquidos polares. • No conducen la electricidad en estado sólido, pero si en estado disuelto o fundido. • Al intentar deformarlos se rompe el cristal (fragilidad).

Disolución de un cristal iónico en un disolvente
 Romina vergara
Romina vergara Mara vergara
Mara vergara Dante vergara
Dante vergara Ubaldo roldan vergara
Ubaldo roldan vergara Eider oñate vergara
Eider oñate vergara Mara vergara
Mara vergara Ing. segundo fausto roncal vergara
Ing. segundo fausto roncal vergara Gawain bilang kasapi ng komunidad
Gawain bilang kasapi ng komunidad Boklunder sausage review
Boklunder sausage review Romina rot
Romina rot Romina graiver
Romina graiver Docteur baco lourdes
Docteur baco lourdes Kinisio
Kinisio Romina escalona
Romina escalona Romina ghassemi
Romina ghassemi Doctora romina gianini
Doctora romina gianini Romina gingaşu
Romina gingaşu Precipitado
Precipitado Qumica
Qumica Qumica
Qumica Tipos de carbono
Tipos de carbono