Configuracin Electrnica Qumica Miss Romina Vergara C 2020






- Slides: 19

Configuración Electrónica Química Miss Romina Vergara C. 2020

Modelos Atómicos Objetivos • Conocer y describir la configuración electrónica de los elementos químicos • Desarrollar el Diagrama de Orbitales • Identificar el principio de exclusión de Pauli

¿Cómo están distribuidos los electrones de un átomo entre sus niveles energéticos?

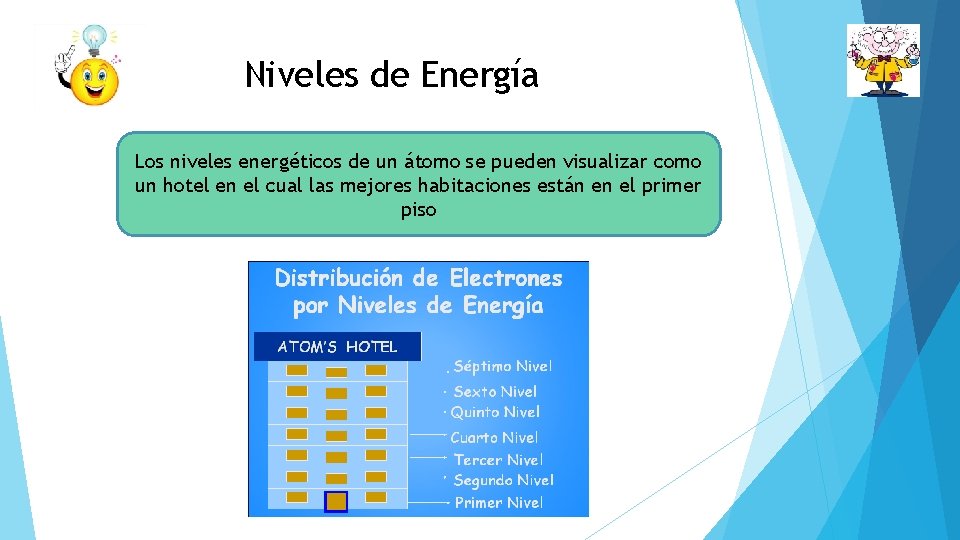
Niveles de Energía Los niveles energéticos de un átomo se pueden visualizar como un hotel en el cual las mejores habitaciones están en el primer piso

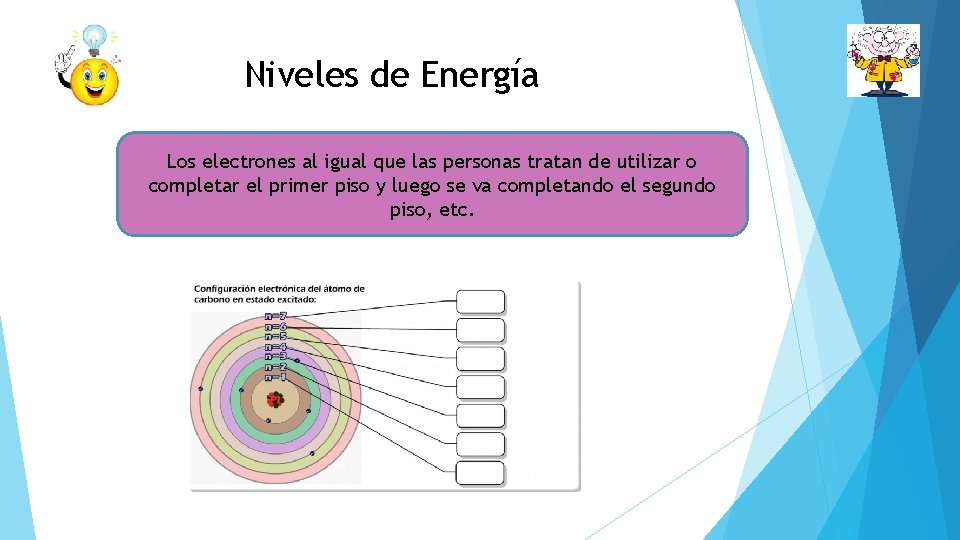
Niveles de Energía Los electrones al igual que las personas tratan de utilizar o completar el primer piso y luego se va completando el segundo piso, etc.

Repasemos algunos conceptos… Cuando trabajamos con la configuración electrónica de un elemento, la partícula principal es el ELECTRÓN.

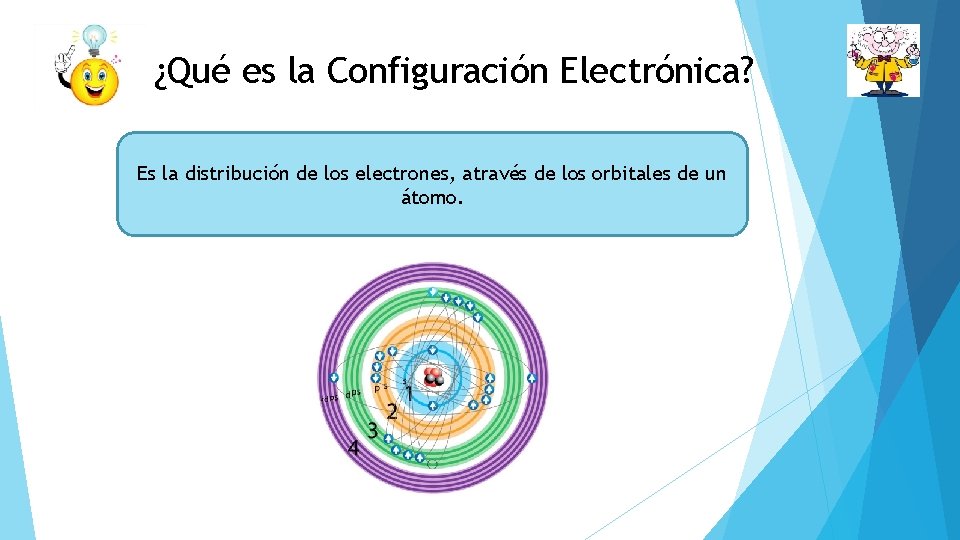
¿Qué es la Configuración Electrónica? Es la distribución de los electrones, através de los orbitales de un átomo.

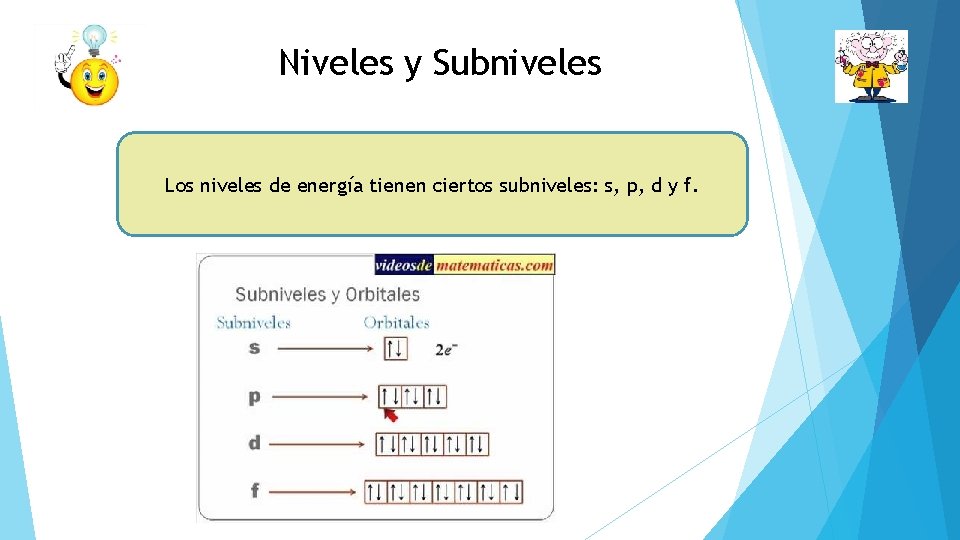
Niveles y Subniveles Los niveles de energía tienen ciertos subniveles: s, p, d y f.

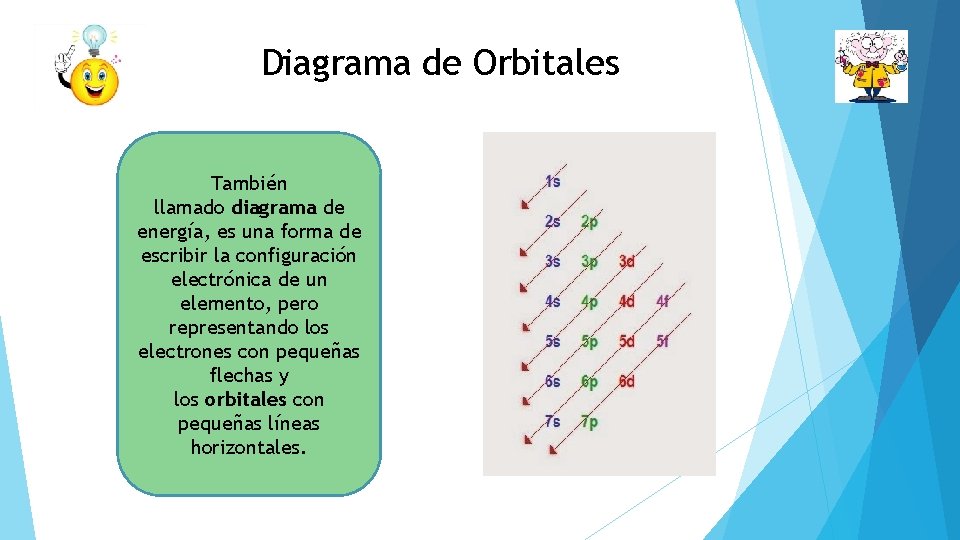
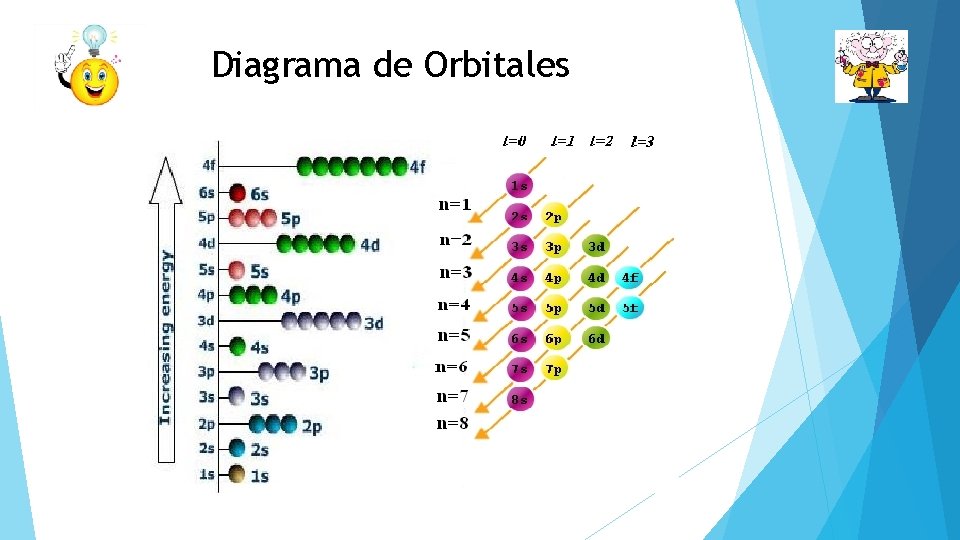
Diagrama de Orbitales También llamado diagrama de energía, es una forma de escribir la configuración electrónica de un elemento, pero representando los electrones con pequeñas flechas y los orbitales con pequeñas líneas horizontales.

Diagrama de Orbitales

Configuración Electrónica El Magnesio (Mg) tiene un Z= 12, recordemos que al ser un átomo neutro, la cantidad de e- y p+ es la misma. Entonces realicemos la configuración electrónica

¿Entendiste? . . . Entonces denuevo… Pon atención a la explicación en la pizarra • Na (Z=11) • Cr (Z=24) • K (Z=19)

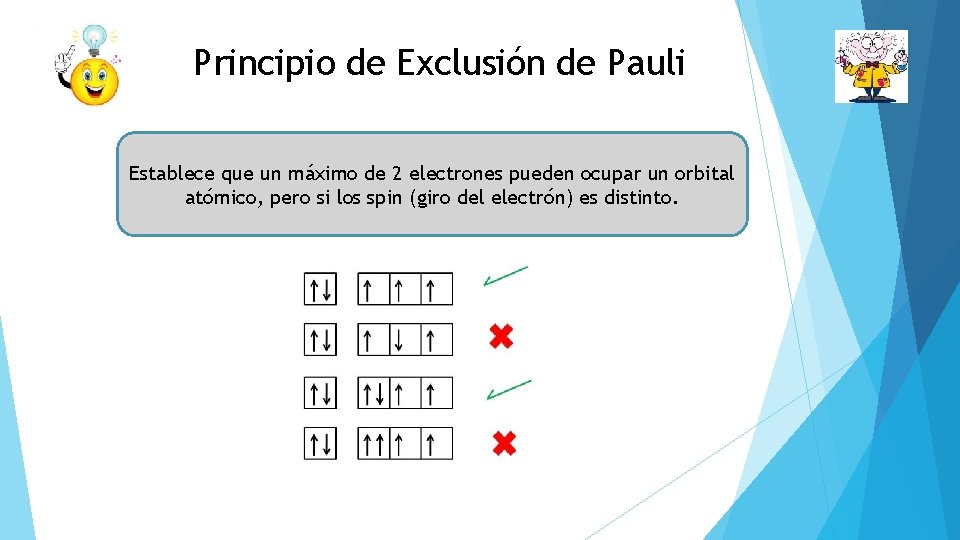
Principio de Exclusión de Pauli Establece que un máximo de 2 electrones pueden ocupar un orbital atómico, pero si los spin (giro del electrón) es distinto.

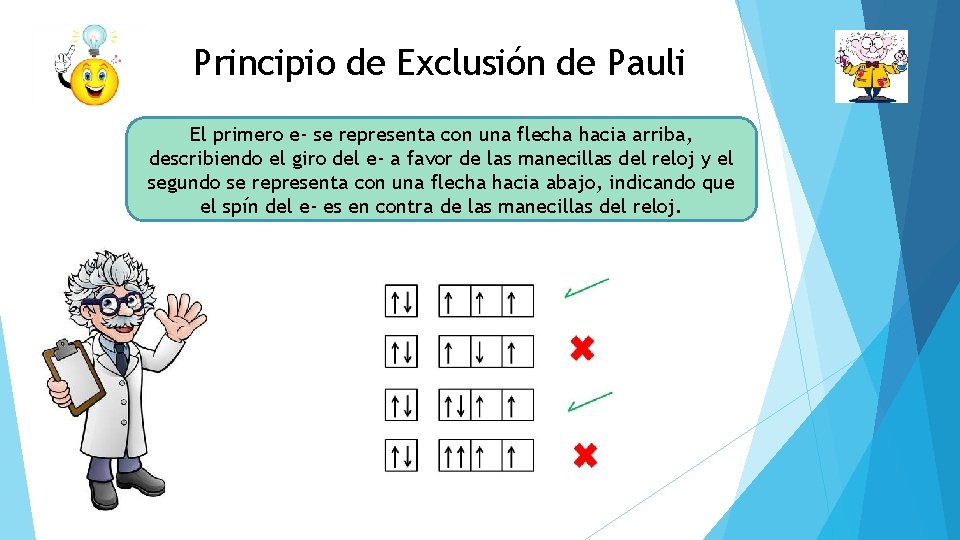
Principio de Exclusión de Pauli El primero e- se representa con una flecha hacia arriba, describiendo el giro del e- a favor de las manecillas del reloj y el segundo se representa con una flecha hacia abajo, indicando que el spín del e- es en contra de las manecillas del reloj.

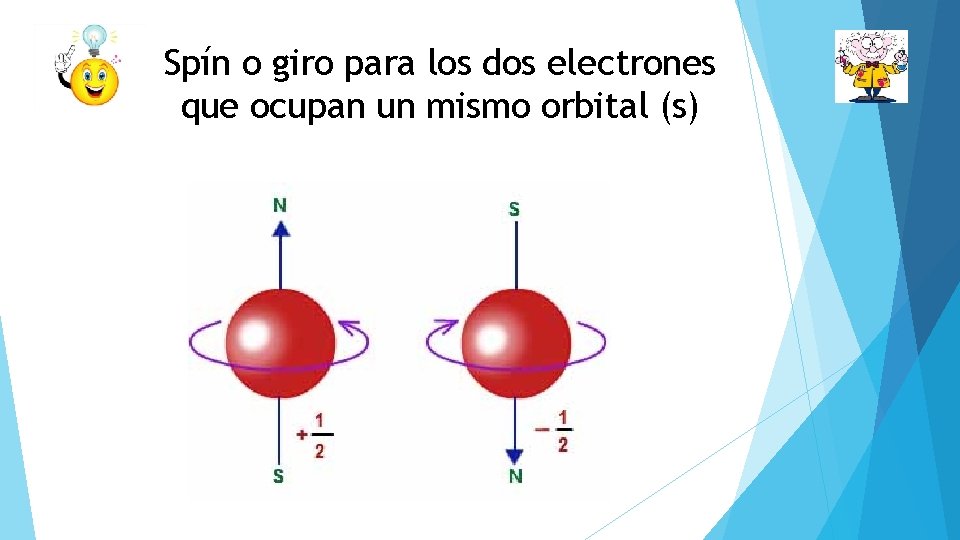
Spín o giro para los dos electrones que ocupan un mismo orbital (s)

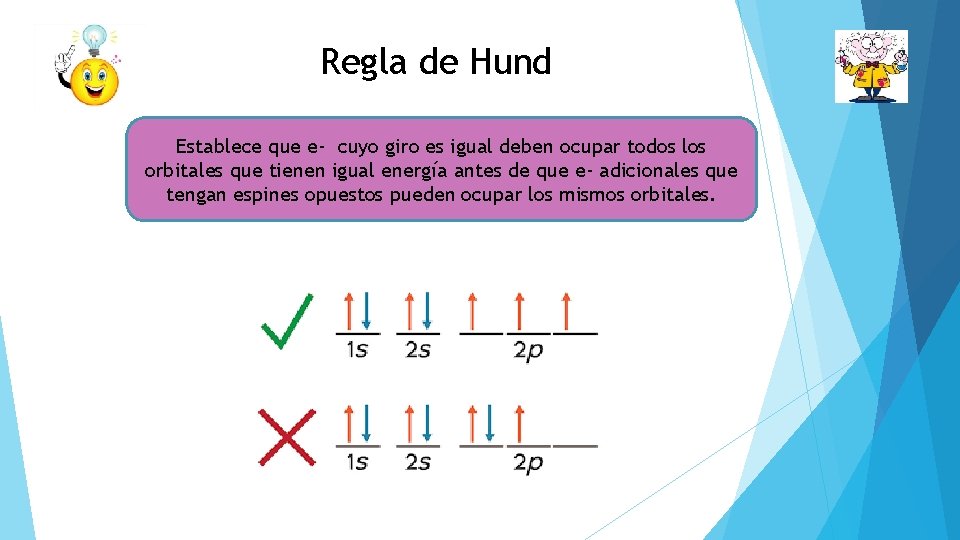
Regla de Hund Establece que e- cuyo giro es igual deben ocupar todos los orbitales que tienen igual energía antes de que e- adicionales que tengan espines opuestos pueden ocupar los mismos orbitales.

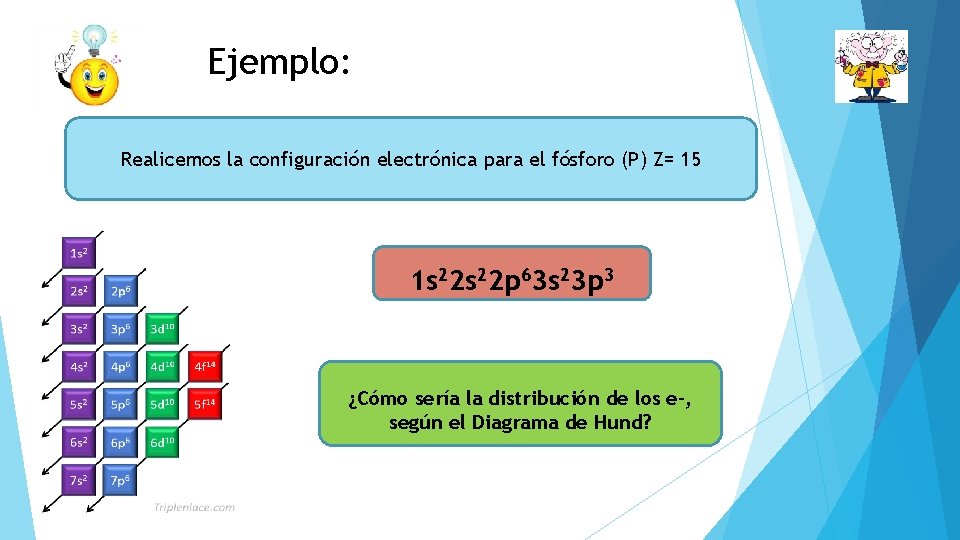
Ejemplo: Realicemos la configuración electrónica para el fósforo (P) Z= 15 1 s 22 p 63 s 23 p 3 ¿Cómo sería la distribución de los e-, según el Diagrama de Hund?

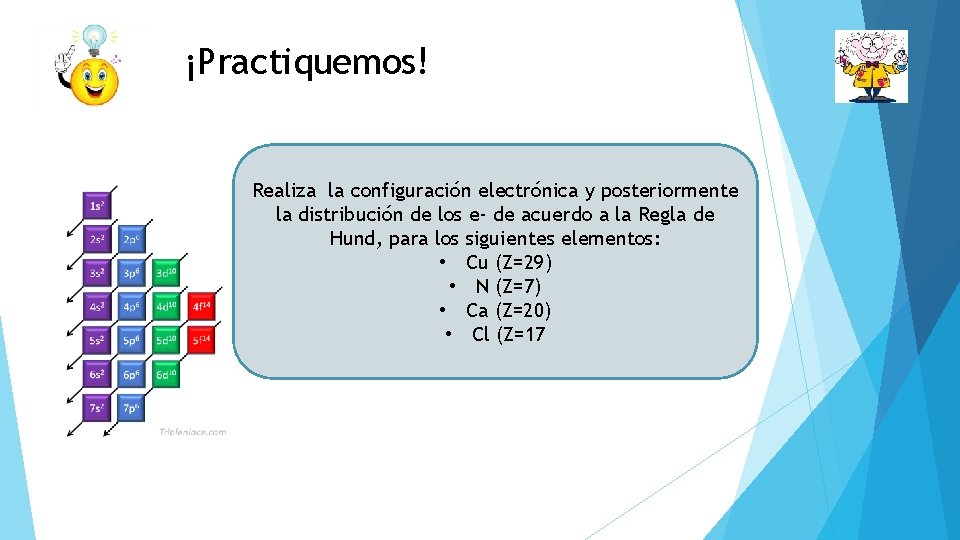
¡Practiquemos! Realiza la configuración electrónica y posteriormente la distribución de los e- de acuerdo a la Regla de Hund, para los siguientes elementos: • Cu (Z=29) • N (Z=7) • Ca (Z=20) • Cl (Z=17

¿Dudas?
 Romina vergara
Romina vergara Configuracin
Configuracin Configuracin
Configuracin Configuracines
Configuracines Pedagohiya
Pedagohiya Mara vergara
Mara vergara Dante vergara
Dante vergara Ubaldo roldan vergara
Ubaldo roldan vergara Eider oñate vergara
Eider oñate vergara Mara vergara
Mara vergara Ing. segundo fausto roncal vergara
Ing. segundo fausto roncal vergara Romina gianini
Romina gianini Romina graiver
Romina graiver Boklunder sausage review
Boklunder sausage review Romina rot
Romina rot Romina ghassemi
Romina ghassemi Docteur terrasi romina
Docteur terrasi romina Romina ghassemi
Romina ghassemi Romina escalona
Romina escalona Cncsis
Cncsis