Nmeros Cunticos Qumica Miss Romina Vergara C 2020



![Entonces, determinemos los números cuánticos… [n, l, m y s] 1 s 22 p Entonces, determinemos los números cuánticos… [n, l, m y s] 1 s 22 p](https://slidetodoc.com/presentation_image_h2/5ec1718a5467a13779a7b4854cbaa903/image-12.jpg)

- Slides: 13

Números Cuánticos Química Miss Romina Vergara C. 2020

Modelos Atómicos Objetivos • Conocer e identificar los números cuánticos para diferentes átomos. • Relacionar ý determinar la configuración electrónica con los números cuánticos. • Resolver ejercicios.

¿Qué son los números cuánticos? Recordemos que el modelo de Bohr introdujo un solo número, cuántico (n), para describir una órbita. Sin embargo la mecánica cuántica requiere de 3 números cuánticos para describir al orbital (n, l y m)

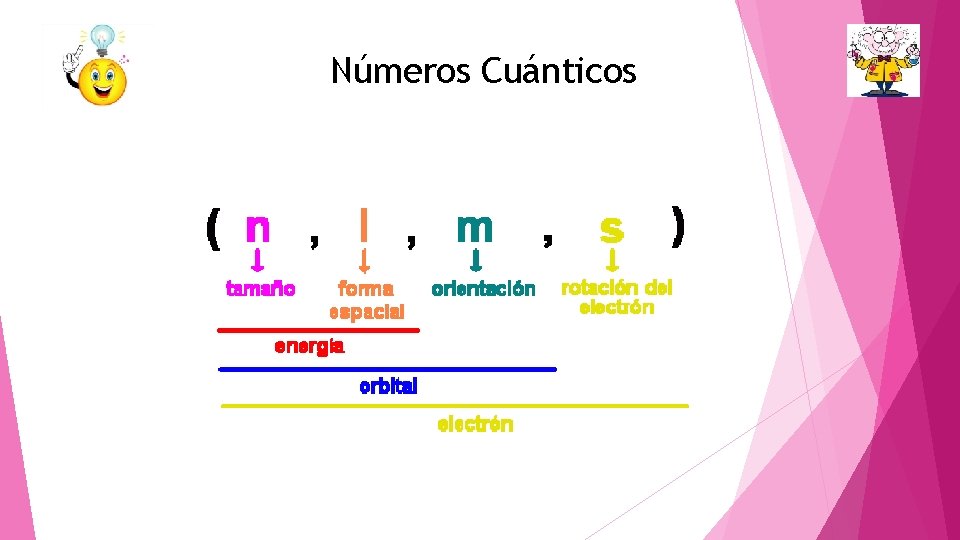
Números Cuánticos

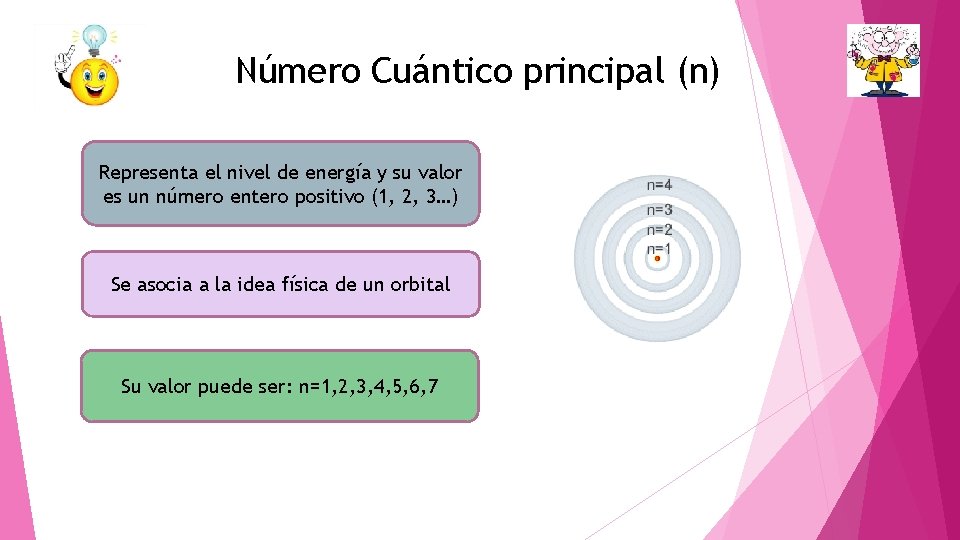
Número Cuántico principal (n) Representa el nivel de energía y su valor es un número entero positivo (1, 2, 3…) Se asocia a la idea física de un orbital Su valor puede ser: n=1, 2, 3, 4, 5, 6, 7

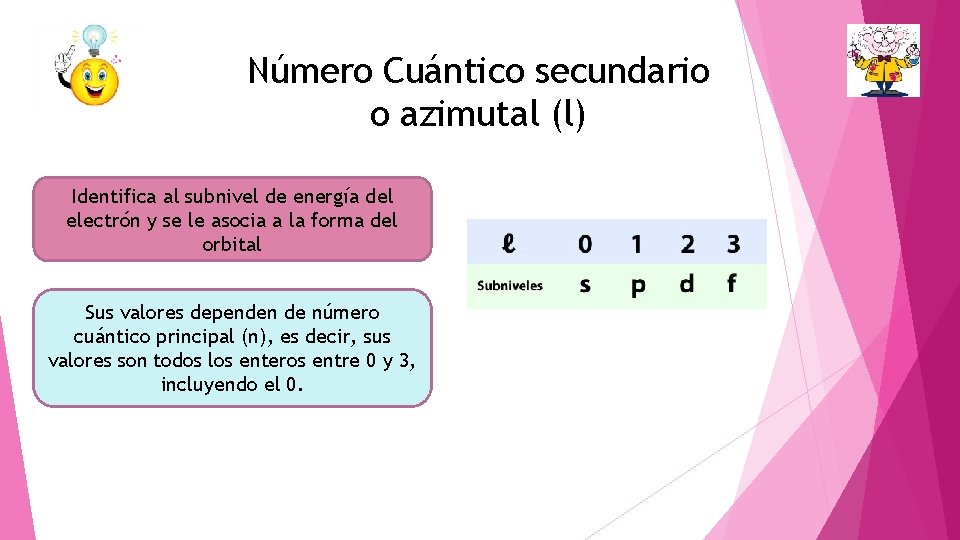
Número Cuántico secundario o azimutal (l) Identifica al subnivel de energía del electrón y se le asocia a la forma del orbital Sus valores dependen de número cuántico principal (n), es decir, sus valores son todos los enteros entre 0 y 3, incluyendo el 0.

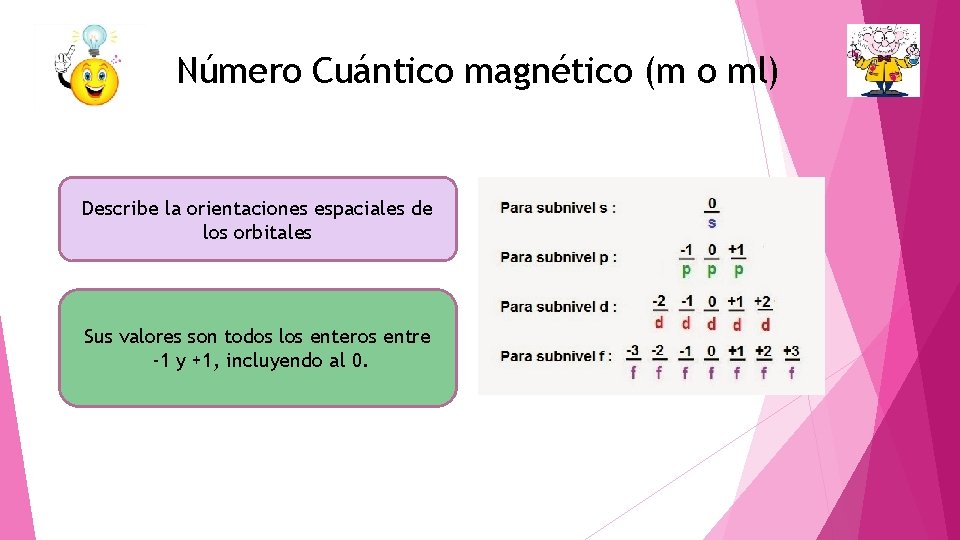
Número Cuántico magnético (m o ml) Describe la orientaciones espaciales de los orbitales Sus valores son todos los enteros entre -1 y +1, incluyendo al 0.

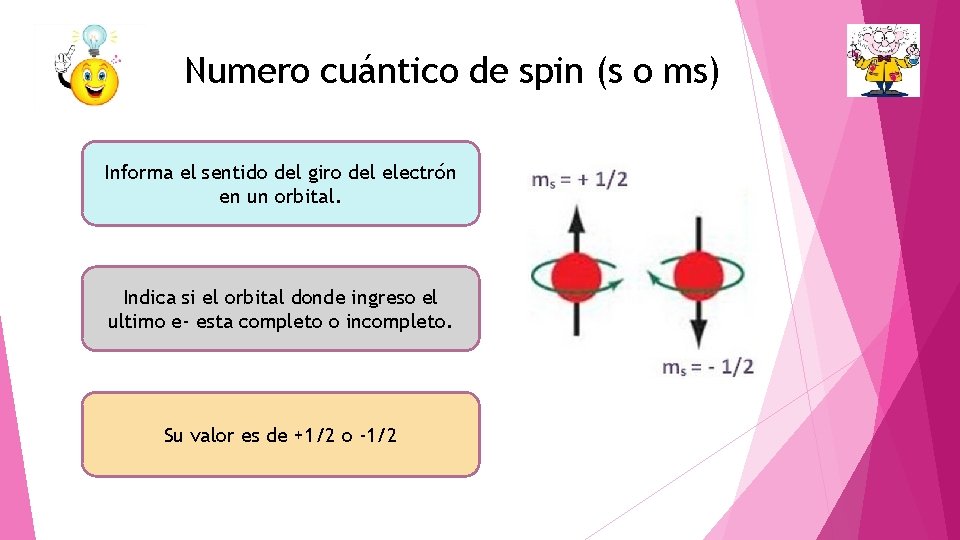
Numero cuántico de spin (s o ms) Informa el sentido del giro del electrón en un orbital. Indica si el orbital donde ingreso el ultimo e- esta completo o incompleto. Su valor es de +1/2 o -1/2

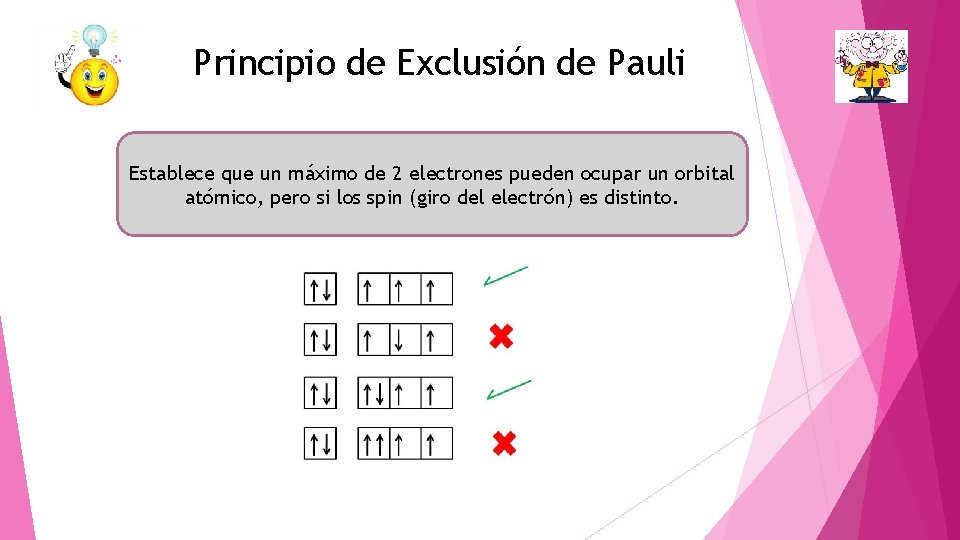
Principio de Exclusión de Pauli Establece que un máximo de 2 electrones pueden ocupar un orbital atómico, pero si los spin (giro del electrón) es distinto.

Regla de Hund Establece que e- cuyo giro es igual deben ocupar todos los orbitales que tienen igual energía antes de que e- adicionales que tengan espines opuestos pueden ocupar los mismos orbitales.

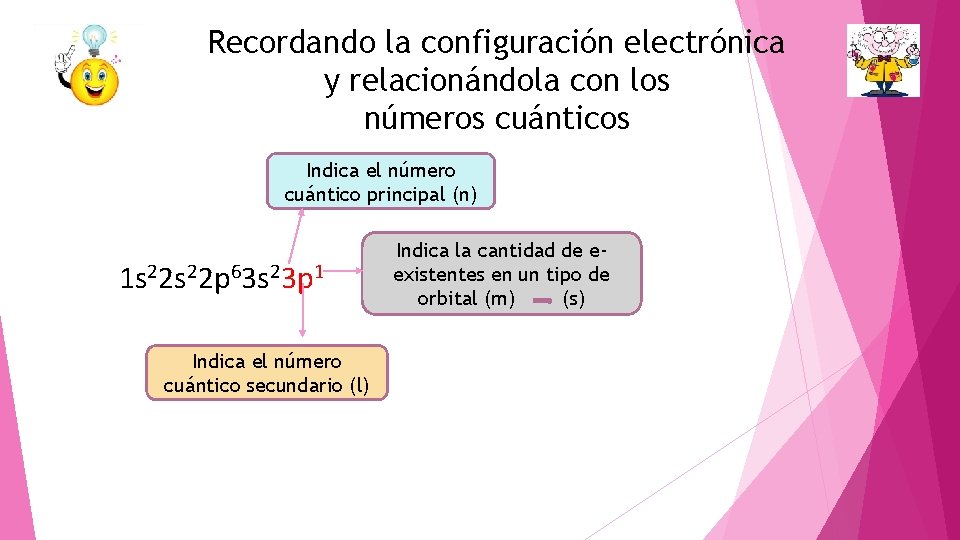
Recordando la configuración electrónica y relacionándola con los números cuánticos Indica el número cuántico principal (n) 1 s 22 p 63 s 23 p 1 Indica el número cuántico secundario (l) Indica la cantidad de eexistentes en un tipo de orbital (m) (s)
![Entonces determinemos los números cuánticos n l m y s 1 s 22 p Entonces, determinemos los números cuánticos… [n, l, m y s] 1 s 22 p](https://slidetodoc.com/presentation_image_h2/5ec1718a5467a13779a7b4854cbaa903/image-12.jpg)
Entonces, determinemos los números cuánticos… [n, l, m y s] 1 s 22 p 63 s 23 p 1 n= 3 l=1 m=-1 s=-1/2 [3, 1, -1/2]

¡Practiquemos! Realiza la configuración electrónica y a partir de ella los números cuánticos de los siguientes elementos químicos • Cu (Z=29) • N (Z=7) • Ca (Z=20) • Cl (Z=17

























