Qumica A Prof Sussumu Qumica Geral Massas Estequimetria

- Slides: 15

Química A Profº Sussumu

Química Geral Massas Estequimetria

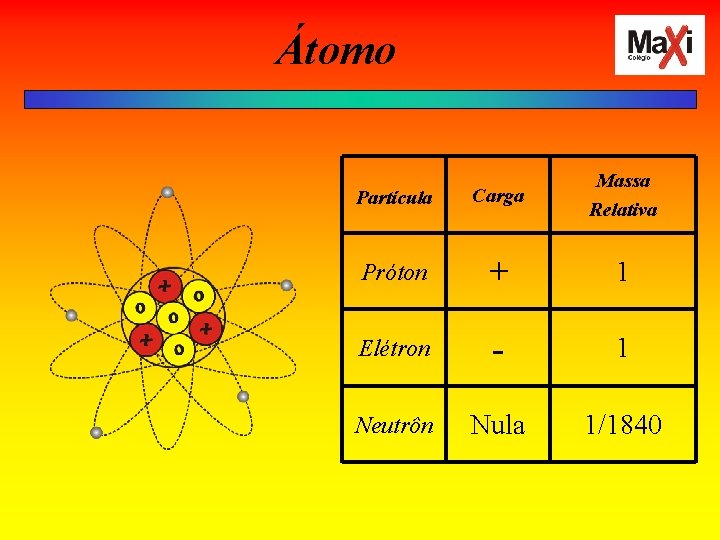
Átomo Partícula Carga Massa Relativa Próton + 1 Elétron - 1 Neutrôn Nula 1/1840

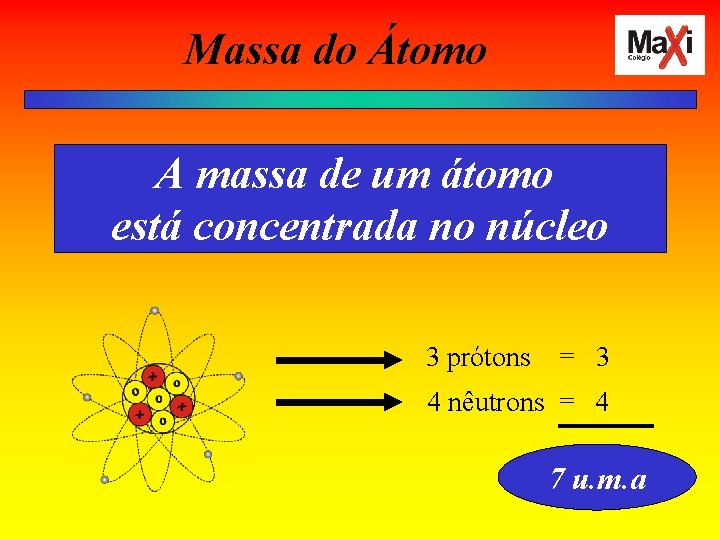
Massa do Átomo A massa de um átomo está concentrada no núcleo 3 prótons = 3 4 nêutrons = 4 7 u. m. a

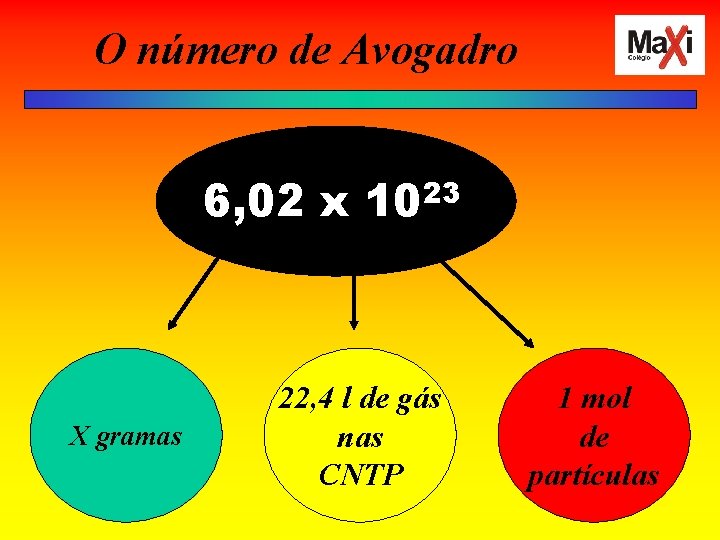
O número de Avogadro 6, 02 x 1023 X gramas 22, 4 l de gás nas CNTP 1 mol de partículas

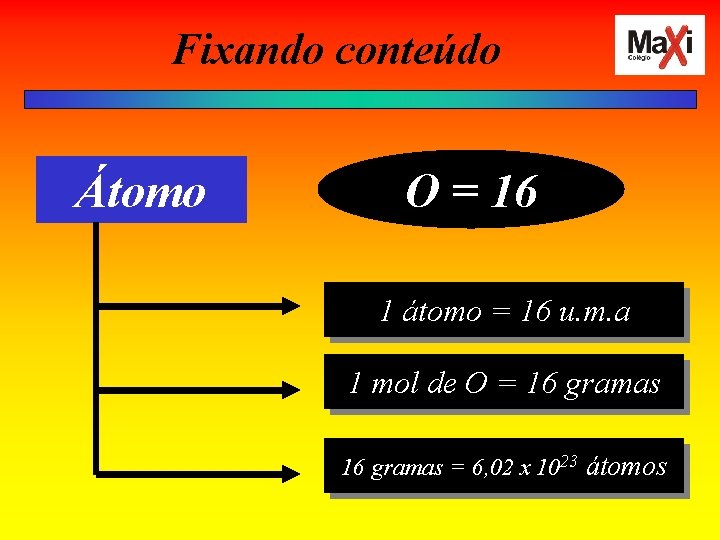
Fixando conteúdo Átomo O = 16 1 átomo = 16 u. m. a 1 mol de O = 16 gramas = 6, 02 x 1023 átomos

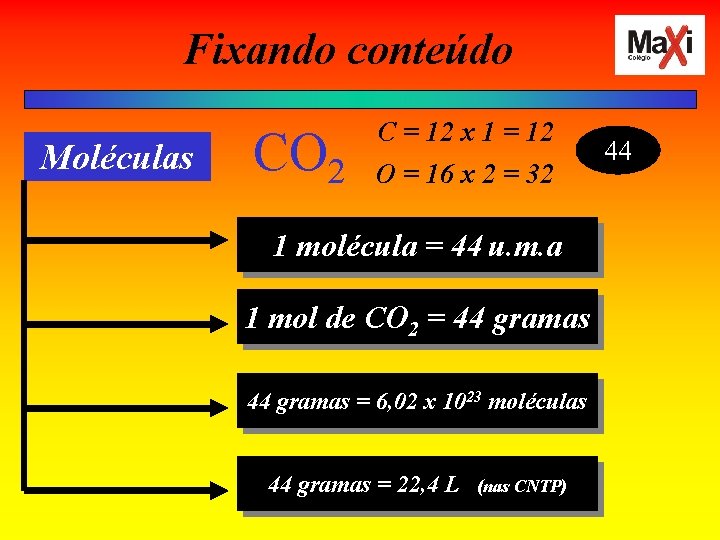
Fixando conteúdo Moléculas CO 2 C = 12 x 1 = 12 O = 16 x 2 = 32 1 molécula = 44 u. m. a 1 mol de CO 2 = 44 gramas = 6, 02 x 1023 moléculas 44 gramas = 22, 4 L (nas CNTP) 44

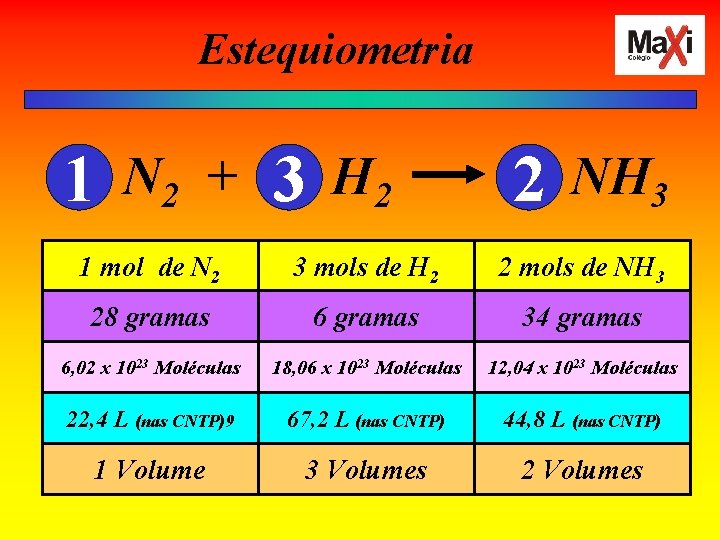
Estequiometria 1 N 2 + 3 H 2 2 NH 3 1 mol de N 2 3 mols de H 2 2 mols de NH 3 28 gramas 6 gramas 34 gramas 6, 02 x 1023 Moléculas 18, 06 x 1023 Moléculas 12, 04 x 1023 Moléculas 22, 4 L (nas CNTP)9 67, 2 L (nas CNTP) 44, 8 L (nas CNTP) 1 Volume 3 Volumes 2 Volumes

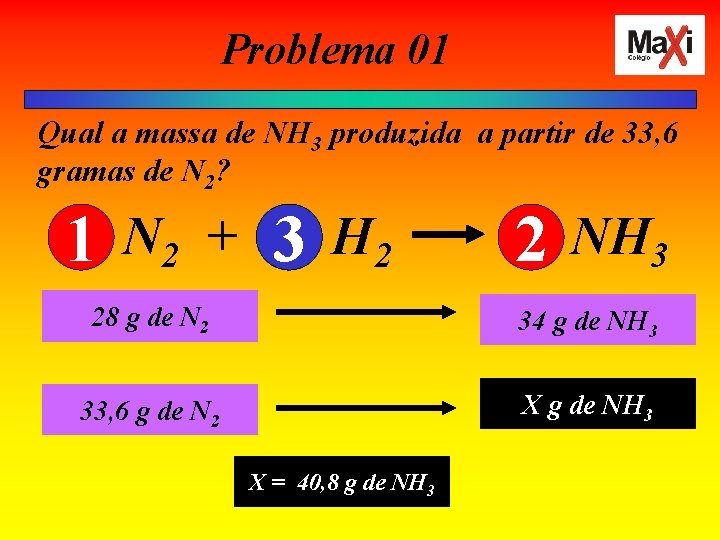
Problema 01 Qual a massa de NH 3 produzida a partir de 33, 6 gramas de N 2? 1 N 2 + 3 H 2 2 NH 3 28 g de N 2 34 g de NH 3 33, 6 g de N 2 X g de NH 3 X = 40, 8 g de NH 3

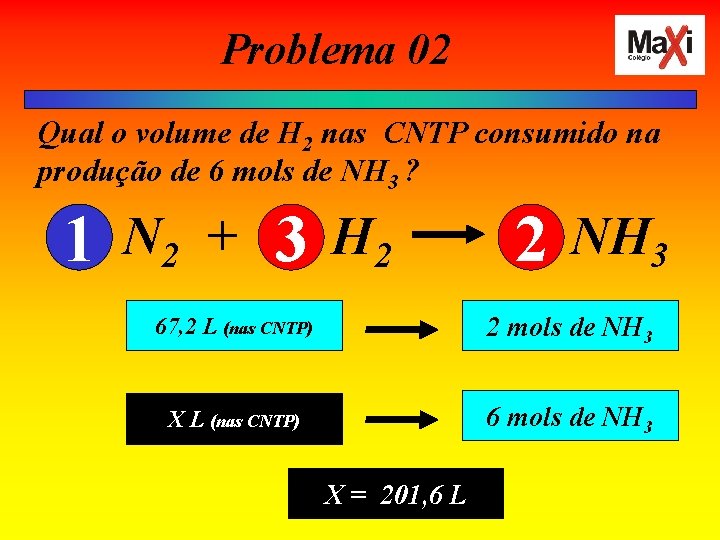
Problema 02 Qual o volume de H 2 nas CNTP consumido na produção de 6 mols de NH 3 ? 1 N 2 + 3 H 2 2 NH 3 67, 2 L (nas CNTP) 2 mols de NH 3 X L (nas CNTP) 6 mols de NH 3 X = 201, 6 L

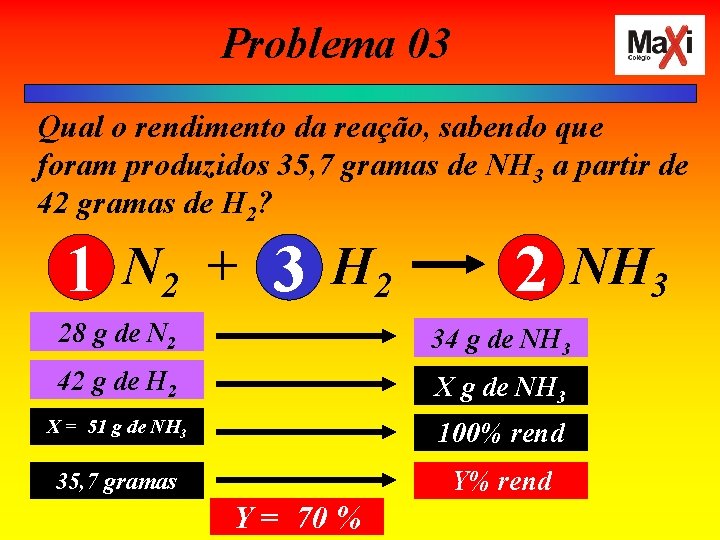
Problema 03 Qual o rendimento da reação, sabendo que foram produzidos 35, 7 gramas de NH 3 a partir de 42 gramas de H 2? 1 N 2 + 3 H 2 2 NH 3 28 g de N 2 34 g de NH 3 42 g de H 2 X g de NH 3 X = 51 g de NH 3 100% rend 35, 7 gramas Y% rend Y = 70 %

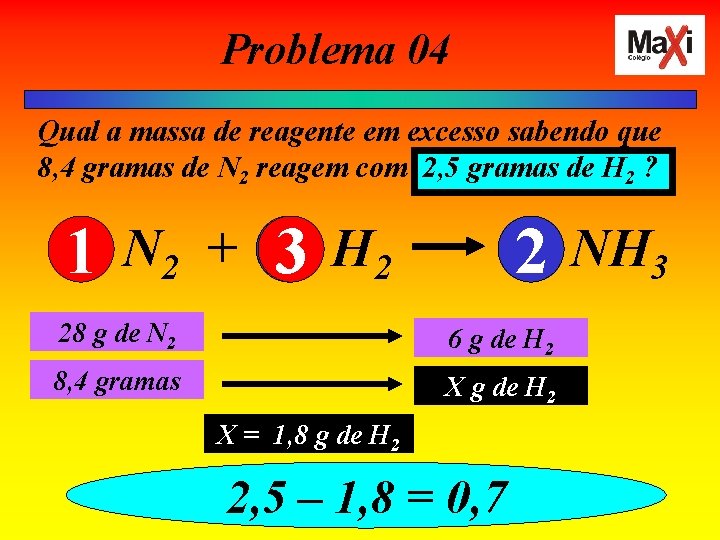
Problema 04 Qual a massa de reagente em excesso sabendo que 8, 4 gramas de N 2 reagem com 2, 5 gramas de H 2 ? 1 N 2 + 3 H 2 2 NH 3 28 g de N 2 6 g de H 2 8, 4 gramas X g de H 2 X = 1, 8 g de H 2 2, 5 – 1, 8 = 0, 7

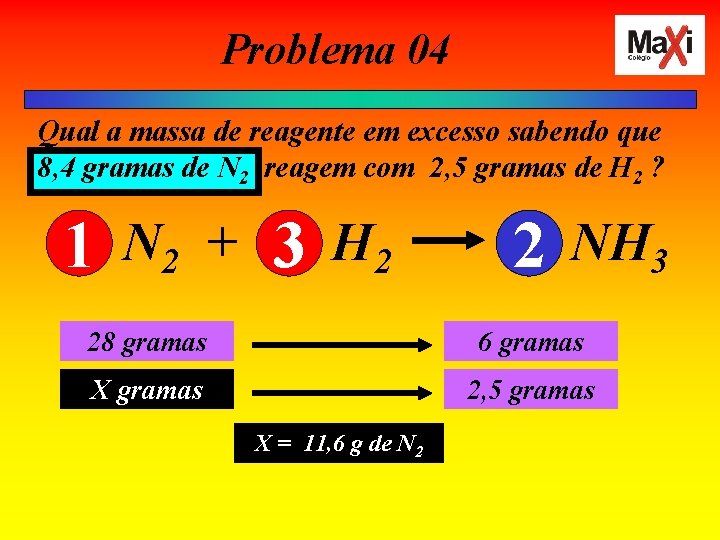
Problema 04 Qual a massa de reagente em excesso sabendo que 8, 4 gramas de N 2 reagem com 2, 5 gramas de H 2 ? 1 N 2 + 3 H 2 2 NH 3 28 gramas 6 gramas X gramas 2, 5 gramas X = 11, 6 g de N 2

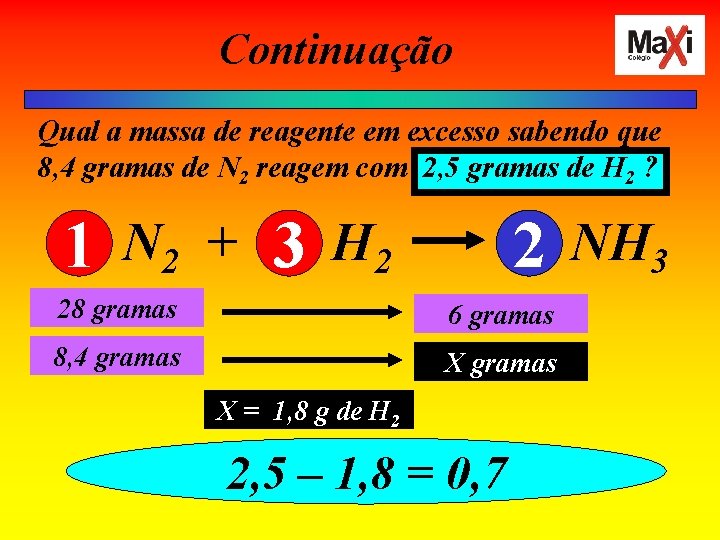
Continuação Qual a massa de reagente em excesso sabendo que 8, 4 gramas de N 2 reagem com 2, 5 gramas de H 2 ? 1 N 2 + 3 H 2 2 NH 3 28 gramas 6 gramas 8, 4 gramas X = 1, 8 g de H 2 2, 5 – 1, 8 = 0, 7

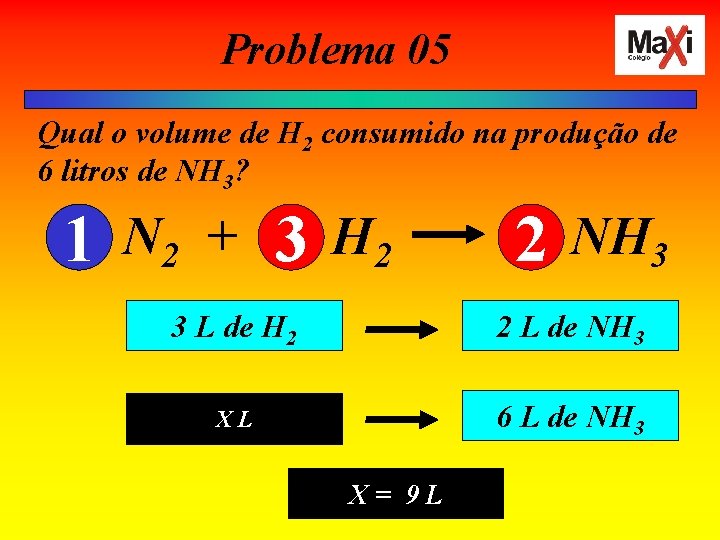
Problema 05 Qual o volume de H 2 consumido na produção de 6 litros de NH 3? 1 N 2 + 3 H 2 2 NH 3 3 L de H 2 2 L de NH 3 XL 6 L de NH 3 X= 9 L
 Massas merengadas
Massas merengadas Resumol
Resumol Chuvas anticiclonais
Chuvas anticiclonais Historia geral e do brasil jose alves de freitas neto
Historia geral e do brasil jose alves de freitas neto Modelo de gerbner
Modelo de gerbner Governo geral objetivo
Governo geral objetivo Progressão geométrica formula
Progressão geométrica formula Ginastica geral 4 ano
Ginastica geral 4 ano Termo geral do binomio
Termo geral do binomio Geografia geral
Geografia geral Número atomico
Número atomico Objetivo geral e especifico
Objetivo geral e especifico Funções trigonométricas inversas
Funções trigonométricas inversas Objetivo geral
Objetivo geral Haleto organico
Haleto organico Resistência orgânica geral
Resistência orgânica geral