Potentiodynamik Keine stationren Prozesse konstantes Potential konstante Reaktionsgeschwindigkeiten










- Slides: 23

Potentiodynamik Keine stationären Prozesse (konstantes Potential – konstante Reaktionsgeschwindigkeiten) mehr: Potentialsprungmethoden zyklische Voltammetrie Polarographie Gemeinsame Eigenschaften: Vorhandensein und Ausnutzung von Transportprozessen Gesteuerte Potentialveränderung, Geschwindigkeit vergleichbar bzw. größer als die der Transportvorgänge Zusammenspiel von der Kinetiken von Durchtrittsreaktion und Diffusion FU Berlin Constanze Donner / Ludwig Pohlmann 2014 1

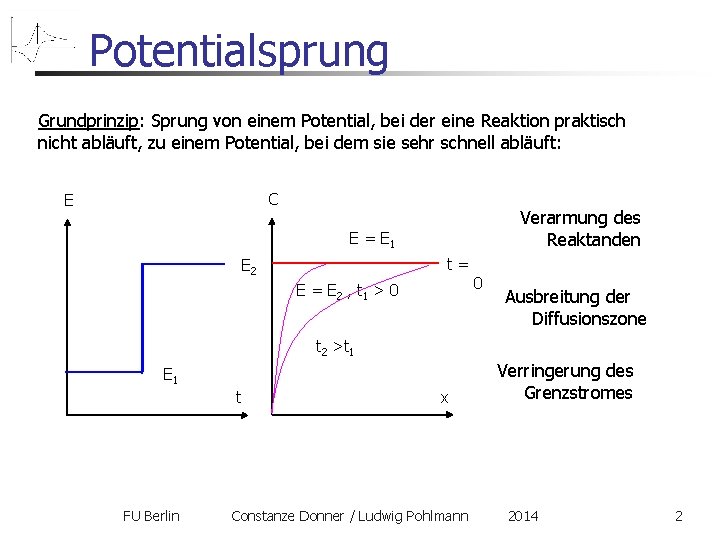
Potentialsprung Grundprinzip: Sprung von einem Potential, bei der eine Reaktion praktisch nicht abläuft, zu einem Potential, bei dem sie sehr schnell abläuft: C E Verarmung des Reaktanden E = E 1 E 2 E = E 2 , t 1 > 0 t = 0 Ausbreitung der Diffusionszone t 2 >t 1 E 1 t x Verringerung des Grenzstromes FU Berlin Constanze Donner / Ludwig Pohlmann 2014 2

Potentialsprung Die Zeitabhängigkeit der Stromdichte lässt sich durch Lösen der Diffusionsgleichung bestimmen und führt zur so genannten Cottrell. Gleichung: Linearität der Auftragung i gegen 1/ t Bestimmung des Diffusionskoeffizienten möglich die effektive Dicke der Diffusionsschicht wächst mit der Quadratwurzel der Zeit: FU Berlin Constanze Donner / Ludwig Pohlmann 2014 3

Potentialsprung Frederick Gardner Cottrell (1877 -1948) Oakland, Kalifornien Studium in Berlin bei van‘t Hoff und in Leipzig bei Ostwald Professur in Chemie an der University of California, Berkeley Seine Gleichung: F. G. Cottrell, Z. Physik. Chem. , (1902), 42, 385). Erfinder des Elektrofilters FU Berlin Constanze Donner / Ludwig Pohlmann 2014 4

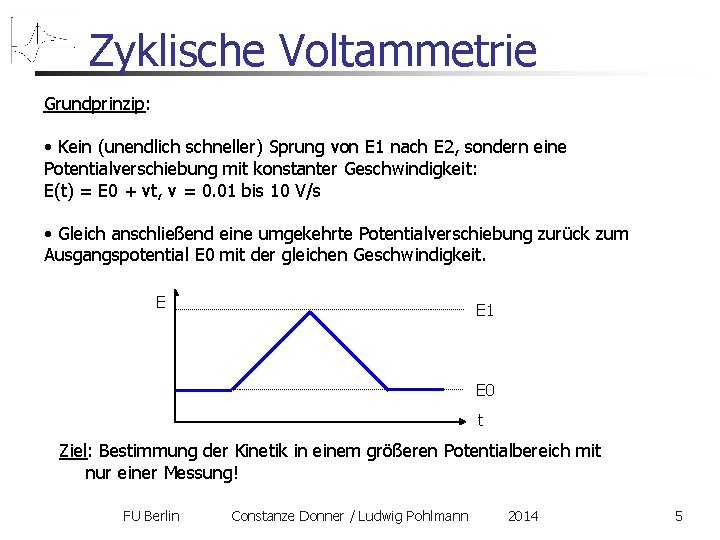
Zyklische Voltammetrie Grundprinzip: • Kein (unendlich schneller) Sprung von E 1 nach E 2, sondern eine Potentialverschiebung mit konstanter Geschwindigkeit: E(t) = E 0 + vt, v = 0. 01 bis 10 V/s • Gleich anschließend eine umgekehrte Potentialverschiebung zurück zum Ausgangspotential E 0 mit der gleichen Geschwindigkeit. E E 1 E 0 t Ziel: Bestimmung der Kinetik in einem größeren Potentialbereich mit nur einer Messung! FU Berlin Constanze Donner / Ludwig Pohlmann 2014 5

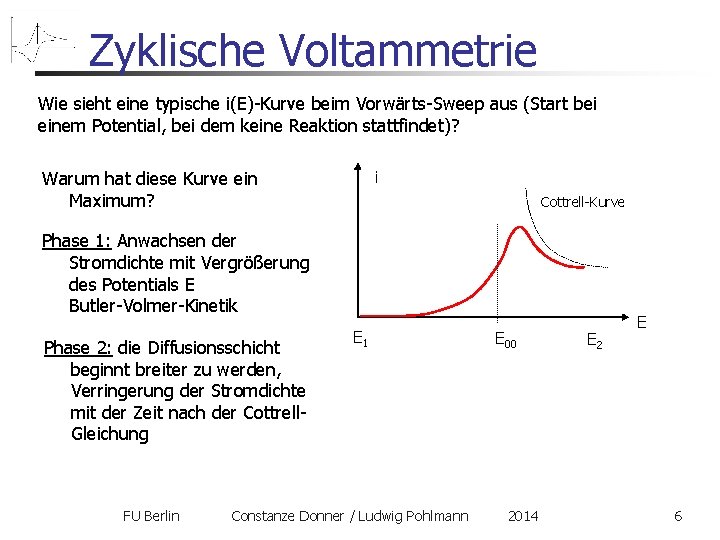
Zyklische Voltammetrie Wie sieht eine typische i(E)-Kurve beim Vorwärts-Sweep aus (Start bei einem Potential, bei dem keine Reaktion stattfindet)? i Warum hat diese Kurve ein Maximum? Cottrell-Kurve Phase 1: Anwachsen der Stromdichte mit Vergrößerung des Potentials E Butler-Volmer-Kinetik Phase 2: die Diffusionsschicht beginnt breiter zu werden, Verringerung der Stromdichte mit der Zeit nach der Cottrell. Gleichung E 1 E 00 FU Berlin Constanze Donner / Ludwig Pohlmann 2014 E 2 E 6

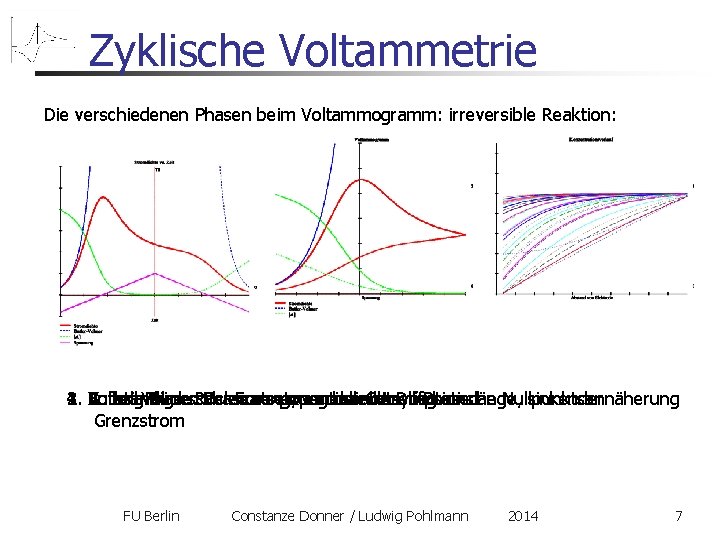
Zyklische Voltammetrie Die verschiedenen Phasen beim Voltammogramm: irreversible Reaktion: 3. Anfang Rückscan: Fortsetzung der Cotrell-Phase 1. Butler-Volmer-Phase: exponentieller Anstieg 4. Vollständiger Rückscan: exponentiell-asymptotische Nullpunktsannäherung 2. Cotrell-Phase: Verarmung, wachsende Diffusionslänge, sinkender Grenzstrom FU Berlin Constanze Donner / Ludwig Pohlmann 2014 7

Zyklische Voltammetrie Movies: I vs. Zeit I vs. Potential FU Berlin Constanze Donner / Ludwig Pohlmann 2014 8

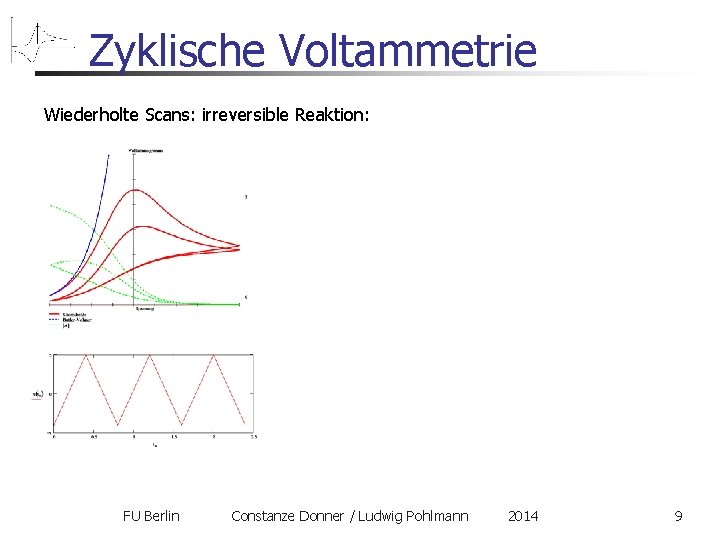
Zyklische Voltammetrie Wiederholte Scans: irreversible Reaktion: FU Berlin Constanze Donner / Ludwig Pohlmann 2014 9

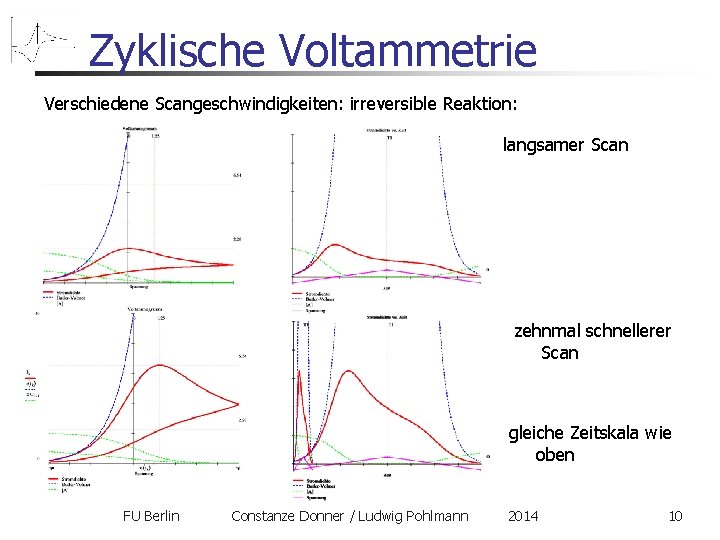
Zyklische Voltammetrie Verschiedene Scangeschwindigkeiten: irreversible Reaktion: langsamer Scan zehnmal schnellerer Scan gleiche Zeitskala wie oben FU Berlin Constanze Donner / Ludwig Pohlmann 2014 10

Zyklische Voltammetrie Verschiedene Scangeschwindigkeiten: irreversible Reaktion: 1. Warum steigt die Peakhöhe mit der Geschwindigkeit? Butler-Volmer-Phase: gleiche Ladungsmenge wird in kürzerer Zeit umgesetzt: höhere Stromdichte! 2. Warum verschiebt sich die Peaklage mit der Geschwindigkeit nach Rechts? Cottrell-Phase: durch die höhere Scangeschwindigkeit werden höhere Potentiale erreicht, ehe diffusive Verarmung greifen kann FU Berlin Constanze Donner / Ludwig Pohlmann 2014 11

Zyklische Voltammetrie Reversible Reaktion: Nernst-Kinetik: es existiert ein Quasi-Nernst-Gleichgewicht an der Elektrodenoberfläche Unterschied zum echten Gleichgewicht: die Oberflächenkonzentrationen sind nicht die Volumenkonzentrationen Charakteristikum: es existiert ein versetzt symmetrischer negativer Peak im Rückscan FU Berlin Constanze Donner / Ludwig Pohlmann 2014 12

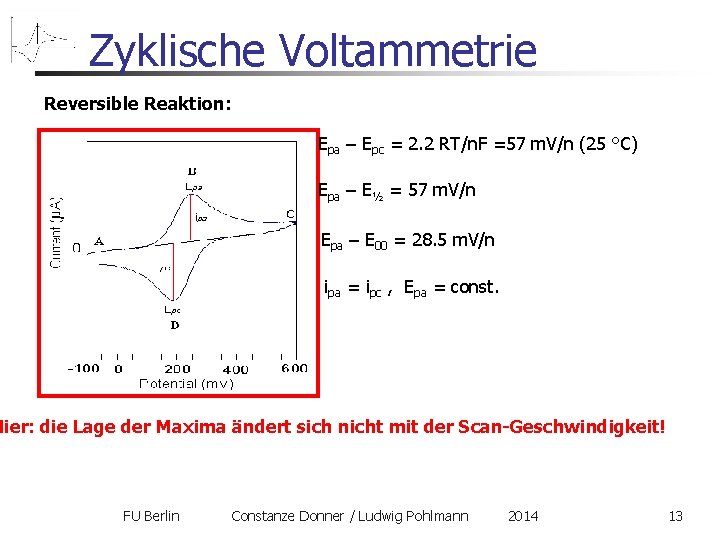
Zyklische Voltammetrie Reversible Reaktion: Epa – Epc = 2. 2 RT/n. F =57 m. V/n (25 °C) Epa – E½ = 57 m. V/n Epa – E 00 = 28. 5 m. V/n ipa = ipc , Epa = const. Hier: die Lage der Maxima ändert sich nicht mit der Scan-Geschwindigkeit! FU Berlin Constanze Donner / Ludwig Pohlmann 2014 13

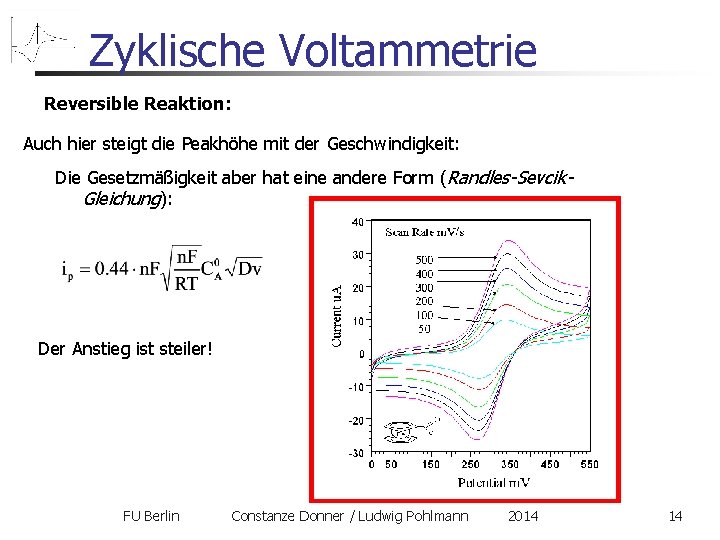
Zyklische Voltammetrie Reversible Reaktion: Auch hier steigt die Peakhöhe mit der Geschwindigkeit: Die Gesetzmäßigkeit aber hat eine andere Form (Randles-Sevcik. Gleichung): Der Anstieg ist steiler! FU Berlin Constanze Donner / Ludwig Pohlmann 2014 14

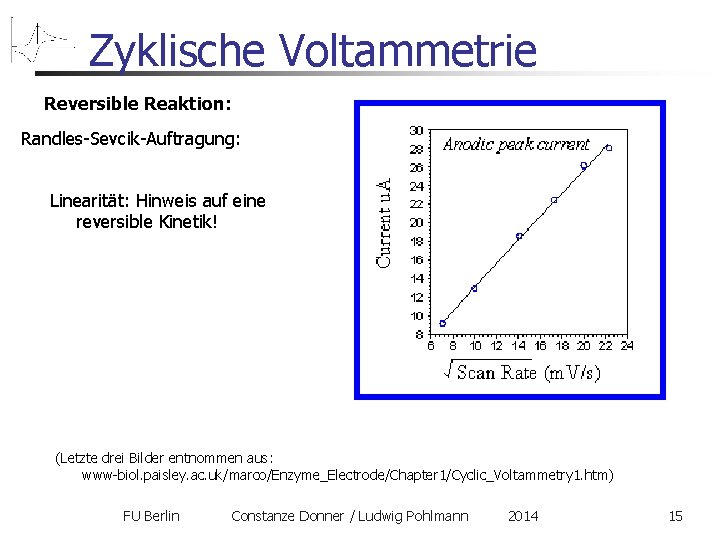
Zyklische Voltammetrie Reversible Reaktion: Randles-Sevcik-Auftragung: Linearität: Hinweis auf eine reversible Kinetik! (Letzte drei Bilder entnommen aus: www-biol. paisley. ac. uk/marco/Enzyme_Electrode/Chapter 1/Cyclic_Voltammetry 1. htm) FU Berlin Constanze Donner / Ludwig Pohlmann 2014 15

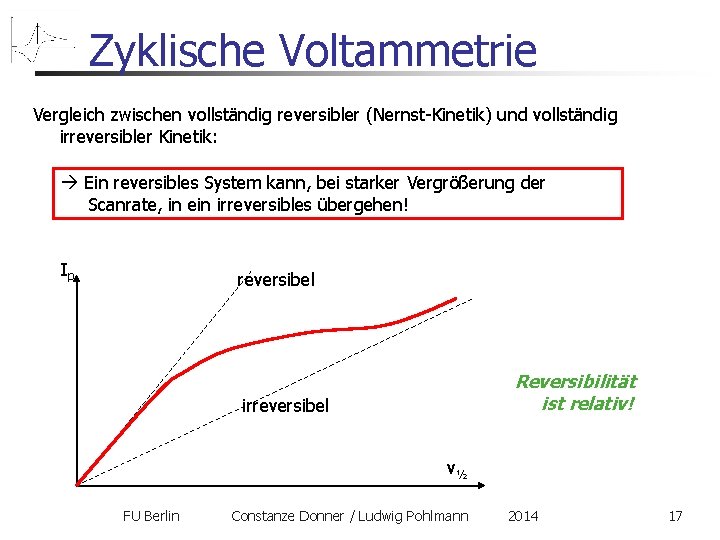
Zyklische Voltammetrie Vergleich zwischen vollständig reversibler (Nernst-Kinetik) und vollständig irreversibler Kinetik (Southampton Group): reversibel irreversibel Kein Rückpeak Epa = const. FU Berlin Constanze Donner / Ludwig Pohlmann 2014 16

Zyklische Voltammetrie Vergleich zwischen vollständig reversibler (Nernst-Kinetik) und vollständig irreversibler Kinetik: Ein reversibles System kann, bei starker Vergrößerung der Scanrate, in ein irreversibles übergehen! Ip reversibel Reversibilität ist relativ! irreversibel v½ FU Berlin Constanze Donner / Ludwig Pohlmann 2014 17

Zyklische Voltammetrie Geschichte: John Edward Brough Randles (1912 -1998) , A. Sevcik 1947 Randles-Sevcik-Gleichung: J. E. B. Randles, Trans. Faraday Soc. 44 (1948) 327. A. Sevcik, Collect. Czech. Chem. Commun. 13 (1948) 349. R. S. Nicholson, L. Shain, Anal. Chem. 36 (1964) 706. R. N. Adams: Electrochemistry at Solid Electrodes, New York 1971. A. J. Bard, L. Faulkner: Electrochemical Methods, New York 1980. FU Berlin Constanze Donner / Ludwig Pohlmann 2014 18

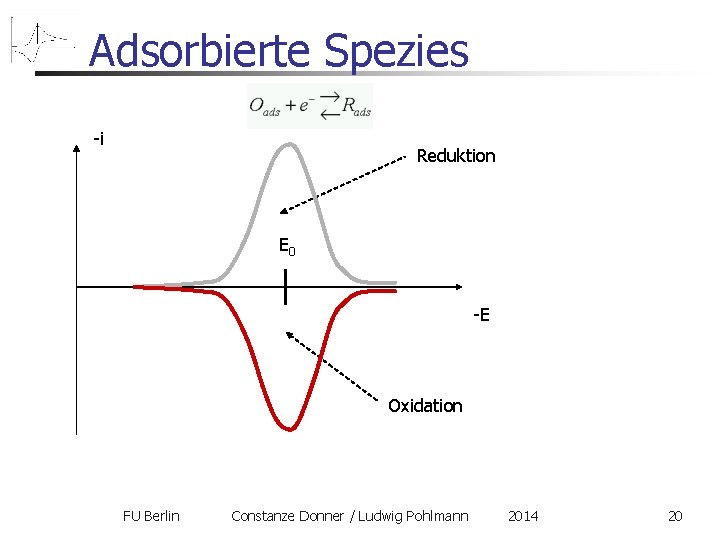
Adsorbierte Spezies Einfachster Fall: nur die adsorbierten Zustände sind elektroaktiv Folgerungen: Diffusion spielt keine Rolle die Peaks verschieben sich nicht mit der Scanrate Hin- und Rückpeak an der gleichen Stelle Peakhöhe proportional zur Scangeschwindigkeit (nicht zur Wurzel!) Ursache des Stromabfalle ist hier nicht die Diffusion, sondern die endliche Stoffmenge des Adsorbates! Ladung Q unter einem Peak Bedeckungsgrad FU Berlin Constanze Donner / Ludwig Pohlmann 2014 19

Adsorbierte Spezies -i Reduktion E 0 -E Oxidation FU Berlin Constanze Donner / Ludwig Pohlmann 2014 20

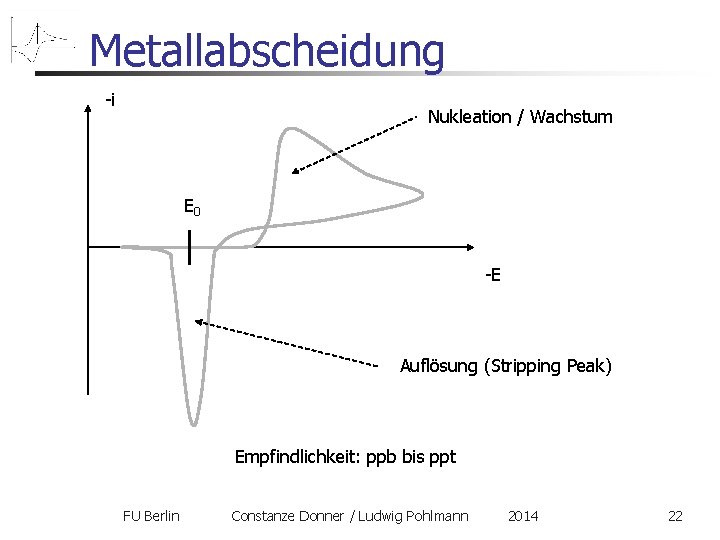
Metallabscheidung auf einem anderen, inertem Material, z. B. Blei auf Kohle Hinscan: ähnlich einem normalen Reduktionsvorgang, allerdings: - Späterer Einsatz - Steilerer Anstieg Ursache: Nukleationshemmung Rückscan: sehr scharf (und hoch) und symmetrisch. „Stripping Peak“ Ursache: das aufzulösende Metall ist schon an der Oberfläche und muss nicht erst herandiffundieren FU Berlin Constanze Donner / Ludwig Pohlmann 2014 21

Metallabscheidung -i Nukleation / Wachstum E 0 -E Auflösung (Stripping Peak) Empfindlichkeit: ppb bis ppt FU Berlin Constanze Donner / Ludwig Pohlmann 2014 22

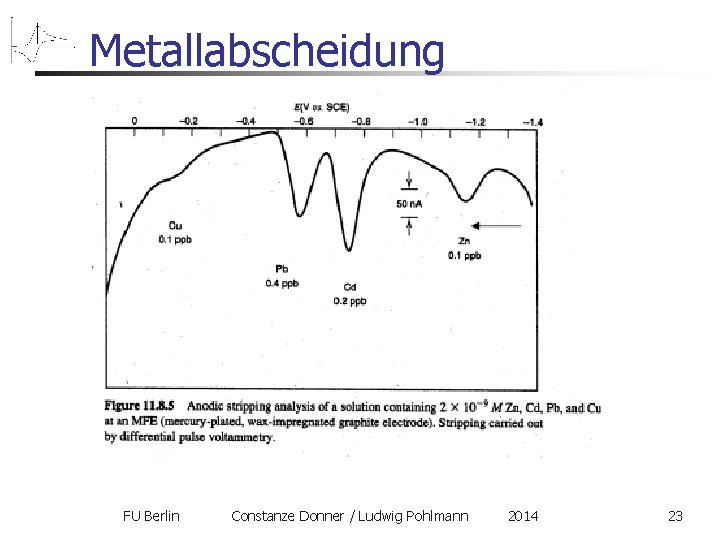
Metallabscheidung FU Berlin Constanze Donner / Ludwig Pohlmann 2014 23
 Stochastische prozesse zusammenfassung
Stochastische prozesse zusammenfassung Affigierung
Affigierung Rydberg konstante
Rydberg konstante ölfleckversuch avogadro konstante
ölfleckversuch avogadro konstante Prozessarbeit dynamische prozesse
Prozessarbeit dynamische prozesse Elektrolyse kupfersulfat platinelektroden
Elektrolyse kupfersulfat platinelektroden Hukov zakon
Hukov zakon Konstanta ravnoteze
Konstanta ravnoteze Gleichnis kornbauer
Gleichnis kornbauer Keine problem ne demek
Keine problem ne demek Die schlesischen weber interpretation
Die schlesischen weber interpretation Warum sind wale keine fische
Warum sind wale keine fische Passwortgeschützte buchstabensuppe
Passwortgeschützte buchstabensuppe Alle ehemaligen kanzler bringen sonntags keine semmeln mit
Alle ehemaligen kanzler bringen sonntags keine semmeln mit Funmail2
Funmail2 Kein keine keinen keiner
Kein keine keinen keiner Dativ neutrum artikel
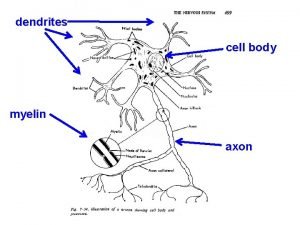
Dativ neutrum artikel Action potential resting potential
Action potential resting potential Equipotential lines
Equipotential lines Describe characteristics
Describe characteristics Electrical potential energy
Electrical potential energy Sources of biopotential
Sources of biopotential Water potential definition
Water potential definition Potential unit
Potential unit