Nuevos frmacos a qu nos enfrentamos Mecanismo de






















- Slides: 38


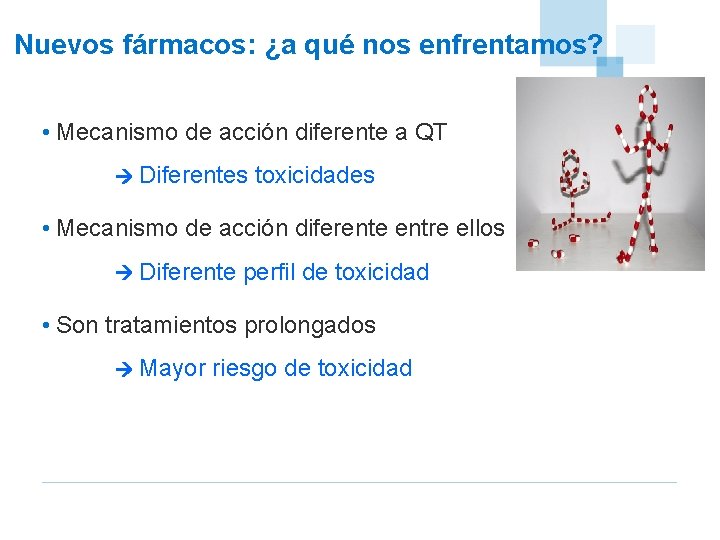
Nuevos fármacos: ¿a qué nos enfrentamos? • Mecanismo de acción diferente a QT Diferentes toxicidades • Mecanismo de acción diferente entre ellos Diferente perfil de toxicidad • Son tratamientos prolongados Mayor riesgo de toxicidad

¿Ha mejorado el manejo del CCRm en la práctica clínica diaria? • Debido a la amplia disponibilidad de sunitinib para el CCRm, la experiencia con el tratamiento con TKI ha aumentado de forma espectacular en los últimos años • Un mejor manejo de los efectos secundarios • ¿El mejor manejo del tratamiento nos lleva a mejores resultados?

Durante estos años hemos aprendido que. . . 1. La duración del tratamiento es importante 2. La dosis es importante 3. Tanto duración como dosis dependen de un manejo adecuado del tratamiento

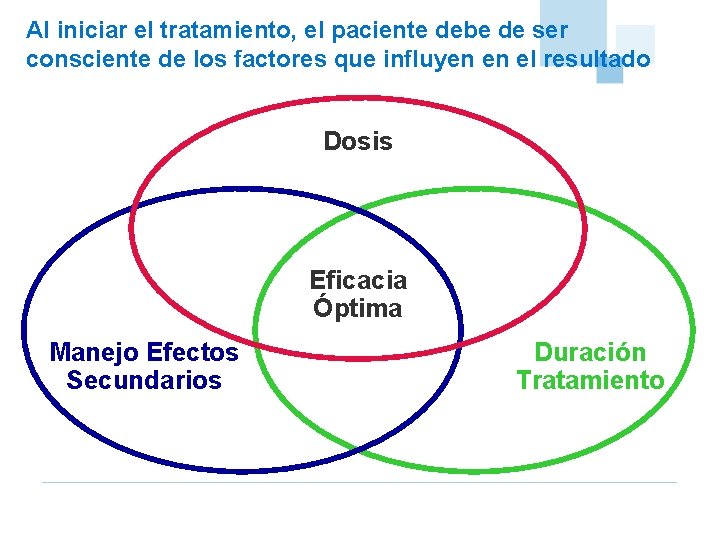
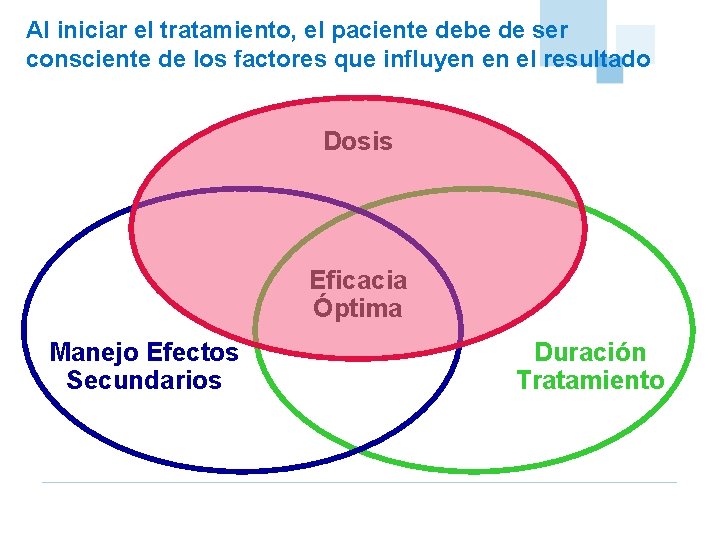
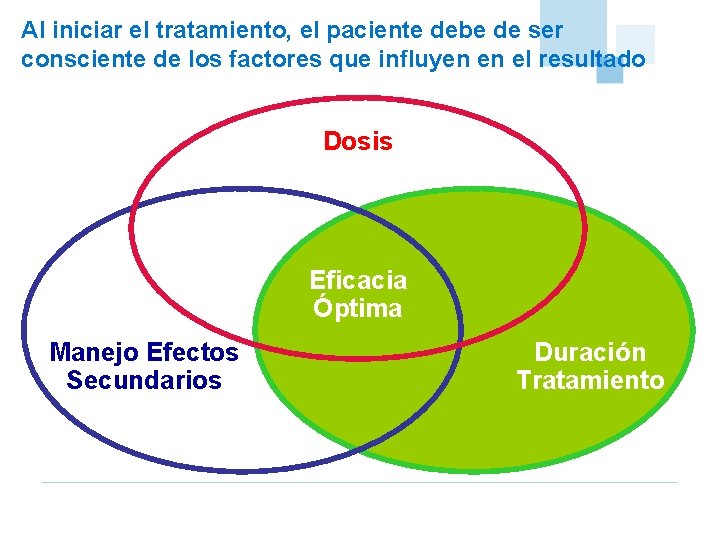
Al iniciar el tratamiento, el paciente debe de ser consciente de los factores que influyen en el resultado Dosis Eficacia Óptima Manejo Efectos Secundarios Duración Tratamiento

Al iniciar el tratamiento, el paciente debe de ser consciente de los factores que influyen en el resultado Dosis Eficacia Óptima Manejo Efectos Secundarios Duración Tratamiento

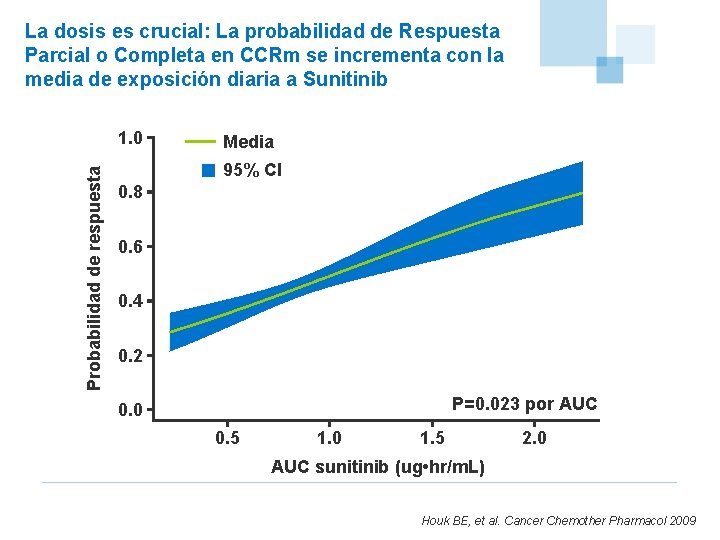
La dosis es crucial: La probabilidad de Respuesta Parcial o Completa en CCRm se incrementa con la media de exposición diaria a Sunitinib Probabilidad de respuesta 1. 0 Media 95% CI 0. 8 0. 6 0. 4 0. 2 P=0. 023 por AUC 0. 0 0. 5 1. 0 1. 5 2. 0 AUC sunitinib (ug • hr/m. L) Houk BE, et al. Cancer Chemother Pharmacol 2009

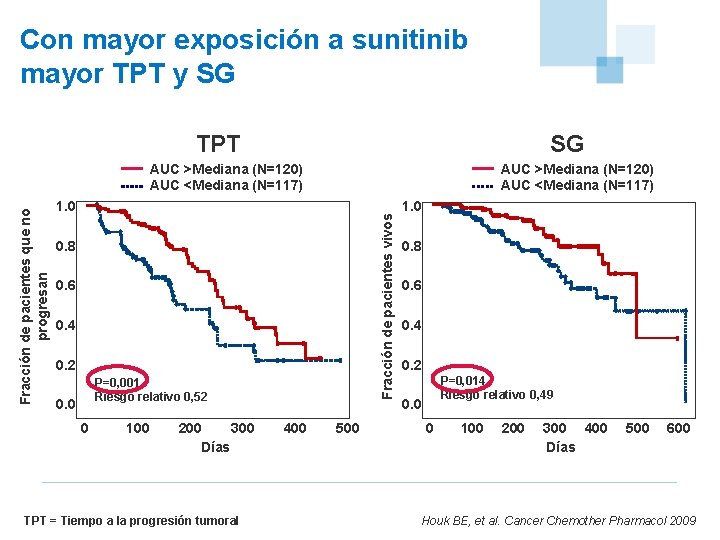
Con mayor exposición a sunitinib mayor TPT y SG TPT SG AUC >Mediana (N=120) AUC <Mediana (N=117) 1. 0 Fracción de pacientes vivos Fracción de pacientes que no progresan AUC >Mediana (N=120) AUC <Mediana (N=117) 0. 8 0. 6 0. 4 0. 2 P=0. 001 P=0, 001 Relative risk 0. 52 Riesgo relativo 0, 52 0. 0 0 100 200 300 Días TPT = Tiempo a la progresión tumoral 400 500 1. 0 0. 8 0. 6 0. 4 0. 2 P=0. 014 P=0, 014 Riesgo 0, 49 Riesgorelativo 0. 49 0. 0 0 100 200 300 400 Días 500 600 Houk BE, et al. Cancer Chemother Pharmacol 2009

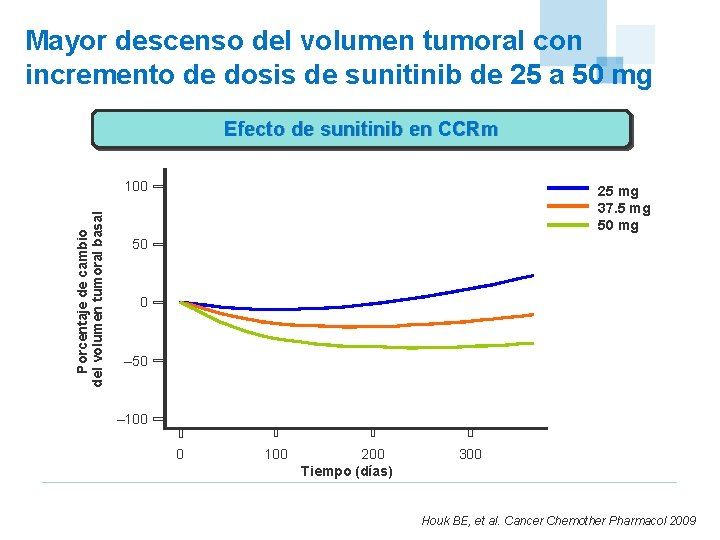
Mayor descenso del volumen tumoral con incremento de dosis de sunitinib de 25 a 50 mg Efecto de sunitinib en CCRm Porcentaje de cambio del volumen tumoral basal 100 25 mg 37. 5 mg 50 0 – 50 – 100 0 100 200 Tiempo (días) 300 Houk BE, et al. Cancer Chemother Pharmacol 2009

Mayor exposición a pazopanib se asocia con mejora SLP, RR • Se valoraron los pacientes tratados en el estudio fase 2 • Se evaluó la relación entre SLP y la concentración plasmática en la semanas 4 y 12 • 225 pacientes en el estudio – Datos farmacocinéticos 205 a 4 semanas y de 185 a las 12 semanas • Cpmin>20, 6 mg/dl vs Cpmin ≤ 20, 6 mg/dl – SLP mediana de 49, 4 s vs a 20, 3 s – RR 45% vs 18% Suttle B et al ASCO 2010

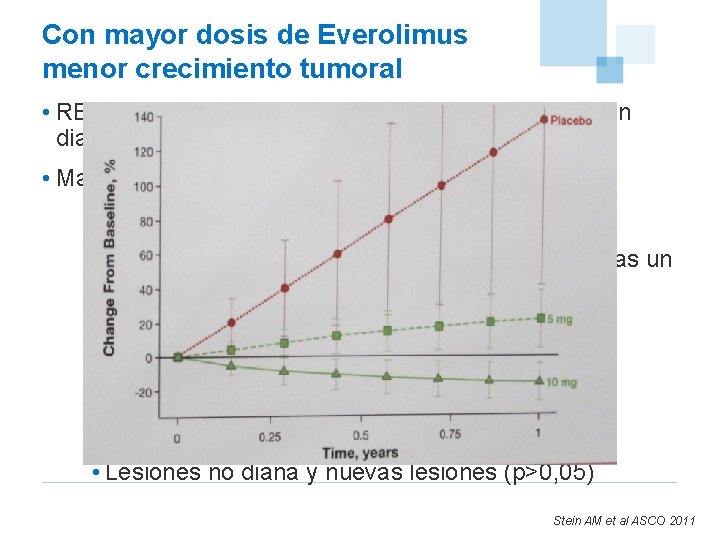
Con mayor dosis de Everolimus menor crecimiento tumoral • RECORD-1 efecto dosis en el crecimiento de la lesión diana, las lesiones no diana, y nuevas metástasis. • Mayor efecto a dosis de 10 mg que a 5 mg • En lesiones diana (P <. 0001) –El modelo predice tras 1 año de dosis continuas un cambio en la suma de los diámetros de las lesiones diana » 142. 1% ± 98. 3% con placebo » 22. 4% ± 17. 2% con 5 -mg » (− 15. 7%) ± 11. 5% con 10 -mg • Lesiones no diana y nuevas lesiones (p>0, 05) Stein AM et al ASCO 2011

Tratamiento concomitante con inhibidores/inductores de CYP 3 A 4 • Co-administración de inhibidores potentes de CYP 3 A 4 puede incrementar las concentraciones en plasma de fármaco se ha de valorar reducción de dosis –Ketoconazol –Diltiazem –Verapamilo –Eritromicina

Administración concomitante de inhibidores/inductores de CYP 3 A 4 • Co-administración de inductores potentes de CYP 3 A 4 puede disminuir las concentraciones en plasma del fármaco y se ha de valorar el incremento de la dosis –Rifampicina –Carbamazepina –Fenobarbital –Dexametasona

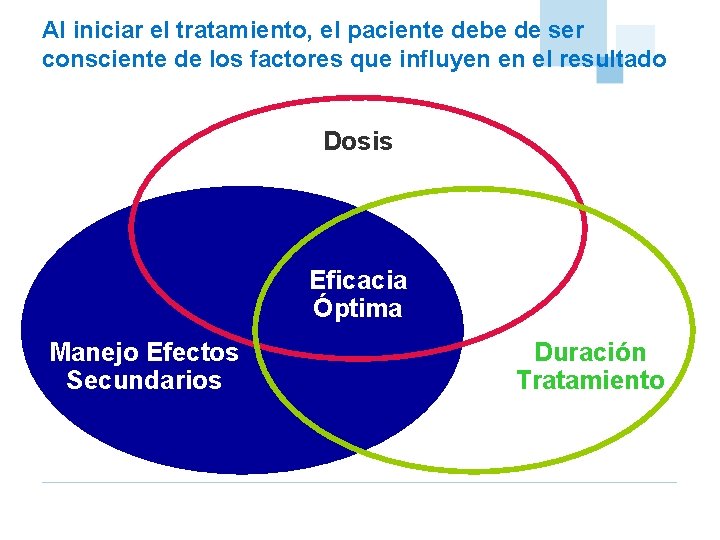
Al iniciar el tratamiento, el paciente debe de ser consciente de los factores que influyen en el resultado Dosis Eficacia Óptima Manejo Efectos Secundarios Duración Tratamiento

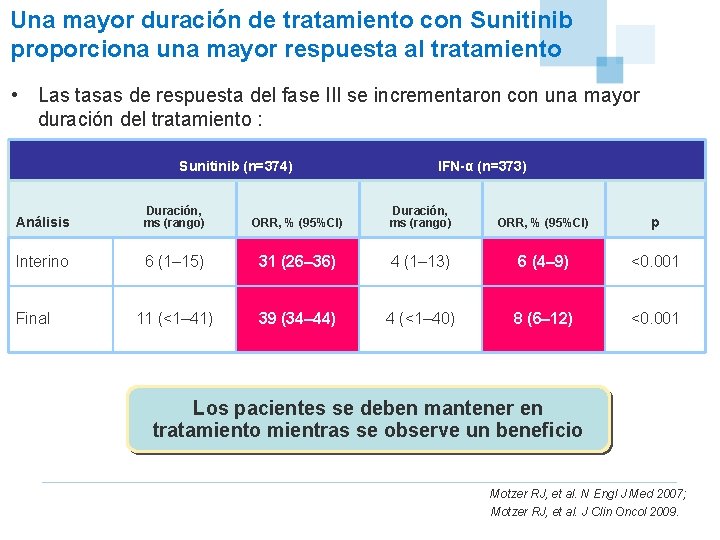
Una mayor duración de tratamiento con Sunitinib proporciona una mayor respuesta al tratamiento • Las tasas de respuesta del fase III se incrementaron con una mayor duración del tratamiento : Sunitinib (n=374) IFN-α (n=373) Análisis Duración, ms (rango) ORR, % (95%CI) p Interino 6 (1– 15) 31 (26– 36) 4 (1– 13) 6 (4– 9) <0. 001 11 (<1– 41) 39 (34– 44) 4 (<1– 40) 8 (6– 12) <0. 001 Final Los pacientes se deben mantener en tratamiento mientras se observe un beneficio Motzer RJ, et al. N Engl J Med 2007; Motzer RJ, et al. J Clin Oncol 2009.

Al iniciar el tratamiento, el paciente debe de ser consciente de los factores que influyen en el resultado Dosis Eficacia Óptima Manejo Efectos Secundarios Duración Tratamiento

¿Cómo pueden ser evitadas las reducciones de dosis y la interrupción de tratamientos? • Con un manejo preventivo y adecuado de los efectos secundarios lo que incluye: – Educación al paciente • Información sobre los efectos secundarios expectativas de eficacia del tratamiento y – Soporte intensivo durante los 2 -3 primeros meses – Medidas profilácticas – Manejo adecuado de los efectos secundarios cuando ocurren – Algunas toxicidades no pueden privar al paciente de los tratamientos diana más beneficiosos

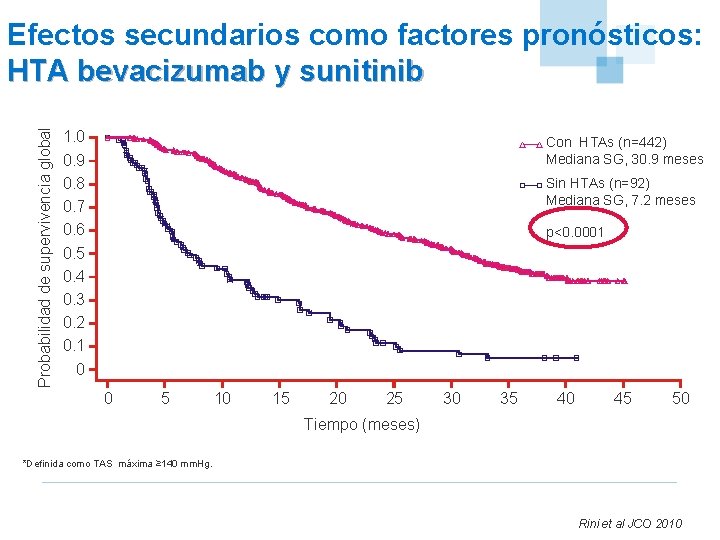
Probabilidad de supervivencia global Efectos secundarios como factores pronósticos: HTA bevacizumab y sunitinib 1. 0 0. 9 0. 8 0. 7 0. 6 0. 5 0. 4 0. 3 0. 2 0. 1 0 Con HTAs (n=442) Mediana SG, 30. 9 meses Sin HTAs (n=92) Mediana SG, 7. 2 meses p<0. 0001 0 5 10 15 20 25 30 35 40 45 50 Tiempo (meses) *Definida como TAS máxima ≥ 140 mm. Hg. Rini et al JCO 2010

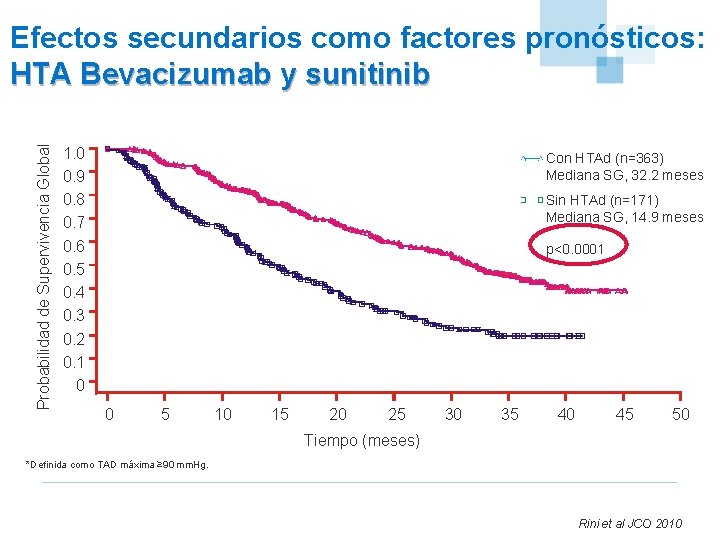
Probabilidad de Supervivencia Global Efectos secundarios como factores pronósticos: HTA Bevacizumab y sunitinib 1. 0 0. 9 0. 8 0. 7 0. 6 0. 5 0. 4 0. 3 0. 2 0. 1 0 Con HTAd (n=363) Mediana SG, 32. 2 meses Sin HTAd (n=171) Mediana SG, 14. 9 meses p<0. 0001 0 5 10 15 20 25 30 35 40 45 50 Tiempo (meses) *Definida como TAD máxima ≥ 90 mm. Hg. Rini et al JCO 2010

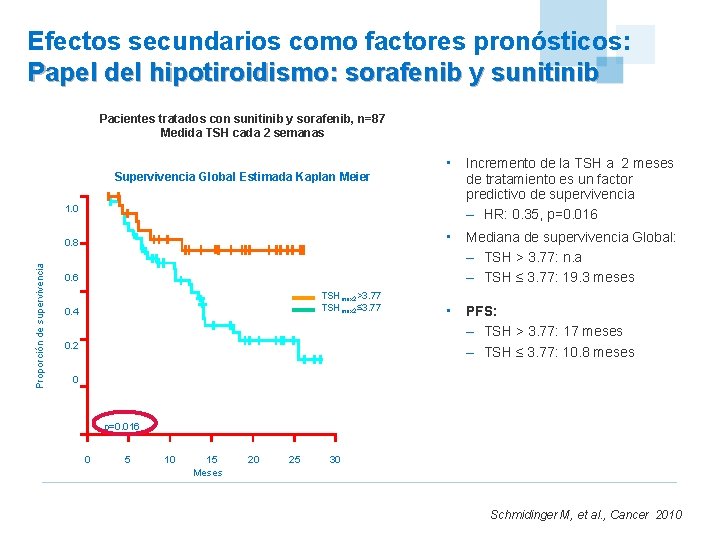
Efectos secundarios como factores pronósticos: Papel del hipotiroidismo: sorafenib y sunitinib Pacientes tratados con sunitinib y sorafenib, n=87 Medida TSH cada 2 semanas Supervivencia Global Estimada Kaplan Meier 1. 0 • Mediana de supervivencia Global: – TSH > 3. 77: n. a – TSH ≤ 3. 77: 19. 3 meses 0. 8 Proporción de supervivencia • Incremento de la TSH a 2 meses de tratamiento es un factor predictivo de supervivencia – HR: 0. 35, p=0. 016 0. 6 TSHmax 2>3. 77 TSHmax 2≤ 3. 77 0. 4 0. 2 • PFS: – TSH > 3. 77: 17 meses – TSH ≤ 3. 77: 10. 8 meses 0 p=0. 016 0 5 10 15 Meses 20 25 30 Schmidinger M, et al. , Cancer 2010

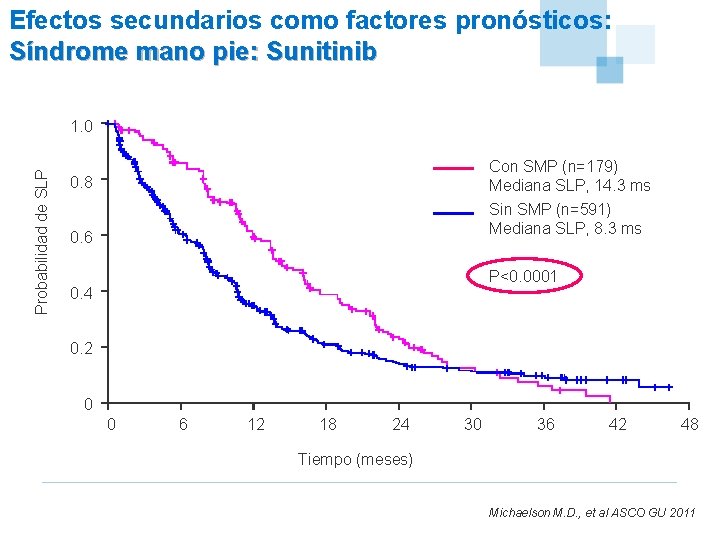
Efectos secundarios como factores pronósticos: Síndrome mano pie: Sunitinib Probabilidad de SLP 1. 0 Con SMP (n=179) Mediana SLP, 14. 3 ms 0. 8 Sin SMP (n=591) Mediana SLP, 8. 3 ms 0. 6 P<0. 0001 0. 4 0. 2 0 0 6 12 18 24 30 36 42 48 Tiempo (meses) Michaelson M. D. , et al ASCO GU 2011

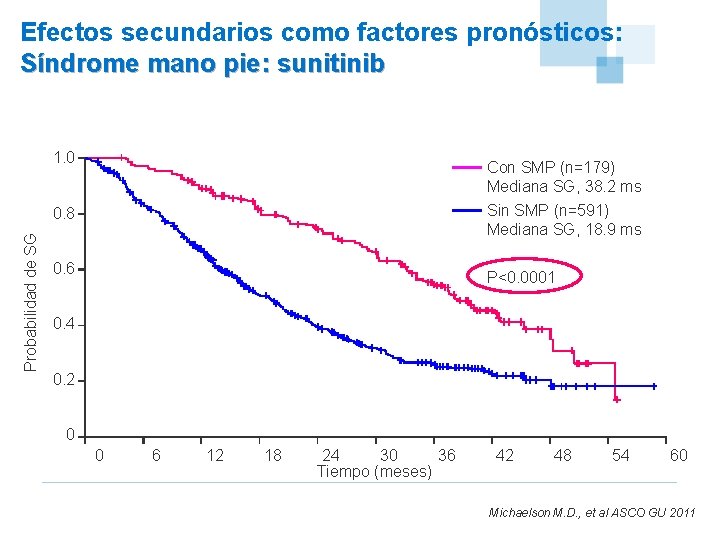
Efectos secundarios como factores pronósticos: Síndrome mano pie: sunitinib 1. 0 Con SMP (n=179) Mediana SG, 38. 2 ms Sin SMP (n=591) Mediana SG, 18. 9 ms Probabilidad de SG 0. 8 0. 6 P<0. 0001 0. 4 0. 2 0 0 6 12 18 24 30 36 Tiempo (meses) 42 48 54 60 Michaelson M. D. , et al ASCO GU 2011

Efectos secundarios como factores pronósticos: Neumonitis: Everolimus, Temsirolimus • 44 pacientes Dana-Farber Cancer Institute y Beth Israel Deaconess Medical Center – 21 tratados con temsirolimus – 23 tratados con everolimus • Resultados pacientes con neumonitis vs pacientes sin neumonitis (p=. 005) – Enfermedad Estable 86% vs 43% – Progesión de enfermedad 7% vs 53% – Media cambio tamaño lesiones dianas RECIST (-2. 9%) vs (+4. 13%) Dabydeen et al ASCO 2011

¿Cómo conseguir el beneficio óptimo en CCRm? Iniciar el tratamiento a las dosis óptimas Continuar con el tratamiento mientras se observe beneficio clínico Mantener la dosis óptima apropiada Realizar profilaxis adecuada y ofrecer el tratamiento óptimo para los efectos secundarios

¿Podemos ayudar a conseguir este beneficio óptimo?

SOGUG: Guías de manejo nuevos fármacos • Posología • Efectos secundarios más frecuentes – Frecuencia – Medidas preventivas y controles – Tratamiento – Recomendaciones de disminución de dosis o interrupción del tratamiento • Interacciones con otros fármacos • Manejo en situaciones especiales – Cirugía – Radioterapia – Diálisis – Insuficiencia hepática

Estudio observacional • Objetivo general – Evaluar el efecto de la implantación de la guía en el manejo de los efectos secundarios de los fármacos y en la elección de los tratamientos concomitantes, y la repercusión de éstos sobre la modificación de las dosis o interrupciones del tratamiento

Estudio observacional • Objetivos específicos – Comparar cumplimiento/adhesión de recomendaciones antes y después de la implantación (manejo efectos secundarios y elección tratamientos concomitantes) – Valorar si el cumplimiento de las recomendaciones implica una disminución en la modificación de dosis del tratamiento y en las interrupciones del mismo – Estimar las tasas de cumplimiento y las tasas de modificación/interrupción de tratamiento por hospital y evaluar su variabilidad – Analizar si el cumplimiento de las recomendaciones de la guía difiere según el tipo de hospital y evaluar si el efecto de la implantación de la guía depende de éste

Estudio observacional • Metodología – Diseño observacional transversal – Se valorará el manejo de los pacientes en dos periodos de tiempo • El año previo al inicio de la implantación de la guía • El año posterior a la implantación de la guía

Estudio observacional • Metodología – Criterios de inclusión • Pacientes con CCRm que hayan recibido tratamiento con fármacos antidiana en el año previo a la implantación de las guías • Pacientes con CCRm que inicien tratamiento con fármacos antidiana durante el año siguiente a la implantación de las guías • Capacidad de otorgar el consentimiento informado

Estudio observacional • Metodología – Tamaño muestral • Participación de 32 centros • 10 pacientes por hospital y año • N 272 pacientes al año (544 pacientes en total) • Potencia del 90% para detectar cambio significativo del 10% – Se recogerán los datos de historia clínica – Se realizará supervisión de revisor independiente

Estudio observacional: estado actual • Clasificado por la AEMPS como EPA-OD • Dictamen favorable CEIC de Navarra • Previsto inicio en septiembre 2011

¿Por qué participar?

Asistencial Interés Científico Práctico




 Frmacos
Frmacos Anticolinergicos
Anticolinergicos Procineticos
Procineticos Xxxi domingo do tempo comum ano b
Xxxi domingo do tempo comum ano b Quando chega o verao nos humanos nos sentimos
Quando chega o verao nos humanos nos sentimos En que nos parecemos
En que nos parecemos Nenhum de nós sozinho é tão bom quanto todos nós juntos
Nenhum de nós sozinho é tão bom quanto todos nós juntos Cantique arme nos bras
Cantique arme nos bras Dai nos, senhor, esses dons, essa luz e nos veremos
Dai nos, senhor, esses dons, essa luz e nos veremos Deus se compadeça de nós e nos dê a sua benção
Deus se compadeça de nós e nos dê a sua benção Quando chega o verao nos humanos nos sentimos
Quando chega o verao nos humanos nos sentimos Nous annonçons le roi
Nous annonçons le roi Inhibidores de betalactamasas
Inhibidores de betalactamasas Cuentos nuevos
Cuentos nuevos Etapas de desarrollo de nuevos productos
Etapas de desarrollo de nuevos productos Nuevos ambientes de aprendizaje
Nuevos ambientes de aprendizaje Nuevos paradigmas educativos
Nuevos paradigmas educativos Productos de no buscados
Productos de no buscados Nuevos grados
Nuevos grados El paucar que tipo de texto es
El paucar que tipo de texto es Paradigmas y modelos educativos
Paradigmas y modelos educativos Ella lleva una sudadera cuando hace frío.
Ella lleva una sudadera cuando hace frío. Unos verbos
Unos verbos Edad de cobre bronce y hierro
Edad de cobre bronce y hierro Nuevos anticonvulsivantes
Nuevos anticonvulsivantes Nuevos retos nuevas oportunidades
Nuevos retos nuevas oportunidades Inhibidores de betalactamasas
Inhibidores de betalactamasas Los nuevos paradigmas
Los nuevos paradigmas Odres nuevos vino nuevo
Odres nuevos vino nuevo Cambios culturales
Cambios culturales Nuevos paradigmas educativos
Nuevos paradigmas educativos Nuevos comienzos en la biblia
Nuevos comienzos en la biblia Metformina mecanismo de accion
Metformina mecanismo de accion Para que sirve bactroban
Para que sirve bactroban Mecanismo de ação dos betabloqueadores
Mecanismo de ação dos betabloqueadores Imagen de azitromicina
Imagen de azitromicina Alfametildopa iqb
Alfametildopa iqb Prostaciclina mecanismo de accion
Prostaciclina mecanismo de accion Tionamidas
Tionamidas