MSZAKI KMIA ELADSOK GPSZMRNK HALLGATKNAK 3 KMIAI EGYENSLY




















- Slides: 27

MŰSZAKI KÉMIA ELŐADÁSOK GÉPÉSZMÉRNÖK HALLGATÓKNAK 3. KÉMIAI EGYENSÚLY Dr. Bajnóczy Gábor BME Kémiai és Környezeti Folyamatmérnöki Tanszék

AZ ELŐADÁS ANYAGA, KÉPEK, RAJZOK KIZÁRÓLAG OKTATÁSI CÉLRA, KORLÁTOZOTT HOZZÁFÉRÉSSEL HASZNÁLHATÓK ! INTERNETRE KORLÁTLAN HOZZÁFÉRÉSSEL FELTENNI TILOS !

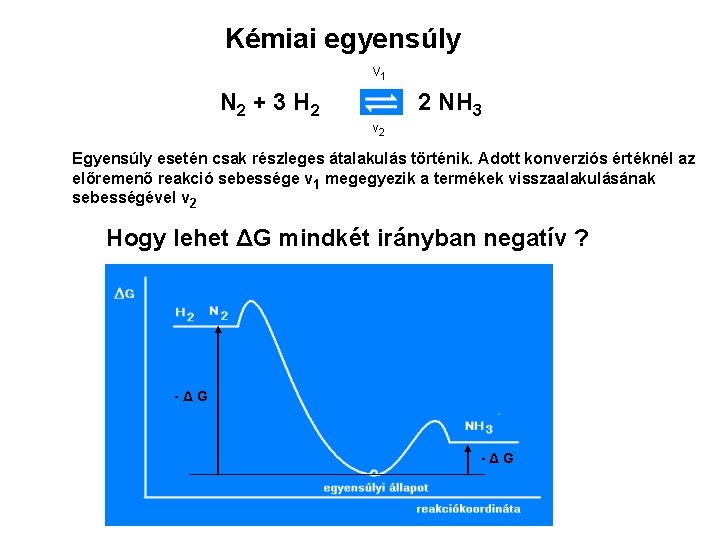
Kémiai egyensúly V 1 N 2 + 3 H 2 2 NH 3 v 2 Egyensúly esetén csak részleges átalakulás történik. Adott konverziós értéknél az előremenő reakció sebessége v 1 megegyezik a termékek visszaalakulásának sebességével v 2 Hogy lehet ΔG mindkét irányban negatív ? -ΔG

Kémiai egyensúly jellemzése Egyensúlyi reakció általános felírása a. A + b. B c. C + d. D [C]c [D]d K = ▬▬▬▬▬ [A]a [B]b Ha K értéke nagy a reakció termékei keletkeznek Ha K értéke kicsi alig képződik reakció termék [A] ; [B] ; [C] ; [D] : egyensúlyi koncentrációk a, b, c, d : sztöchiometriai együtthatók K : dimenziómentes szám, amelyhez mindig tartozik egyensúlyi egyenlet (adott hőmérsékleten, adott nyomáson) Kp, t

A szabadentalpia és az egyensúlyi állandó kapcsolata A standard szabadentalpia változás egy teljesen végbemenő reakciónál : ΔG 0 Ha nem játszódik le teljesen : ΔG Kettő közötti kapcsolat: ΔG = ΔG 0 + RTln. Q Q: reakcióhányados, definicíója megegyezik K-val, de egyensúlyi helyett tetszőleges koncentrációk szerepelhetnek Egyensúly esetén: Q = K és ΔG = 0 tehát 0 = ΔG 0 + RTln. K ΔG 0 = ▬ RTln. K

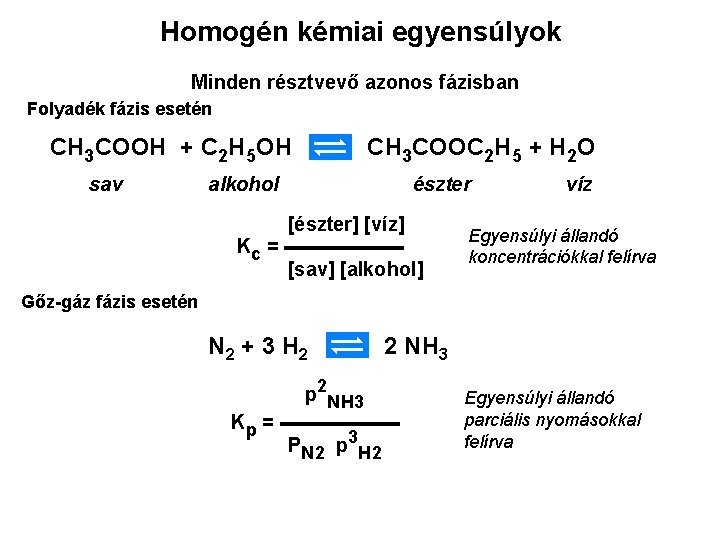
Homogén kémiai egyensúlyok Minden résztvevő azonos fázisban Folyadék fázis esetén CH 3 COOH + C 2 H 5 OH sav CH 3 COOC 2 H 5 + H 2 O alkohol észter [észter] [víz] Kc = ▬▬▬▬▬▬ [sav] [alkohol] víz Egyensúlyi állandó koncentrációkkal felírva Gőz-gáz fázis esetén N 2 + 3 H 2 2 NH 3 p 2 NH 3 Kp = ▬▬▬▬▬▬ PN 2 p 3 H 2 Egyensúlyi állandó parciális nyomásokkal felírva

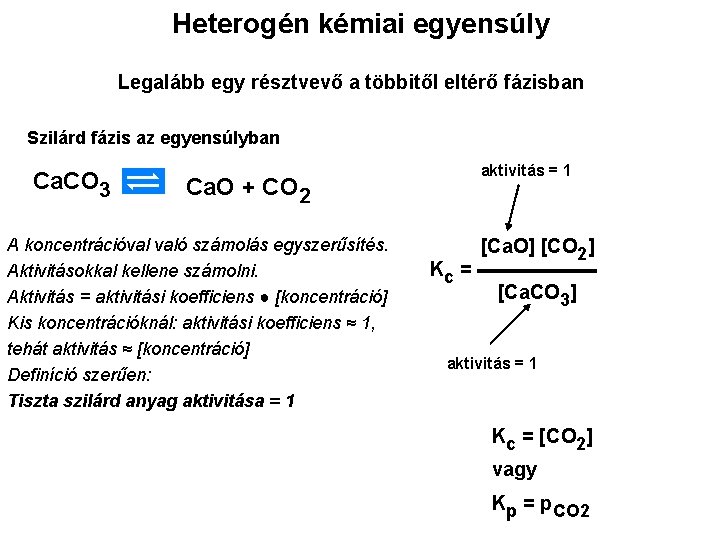
Heterogén kémiai egyensúly Legalább egy résztvevő a többitől eltérő fázisban Szilárd fázis az egyensúlyban Ca. CO 3 Ca. O + CO 2 A koncentrációval való számolás egyszerűsítés. Aktivitásokkal kellene számolni. Aktivitás = aktivitási koefficiens ● [koncentráció] Kis koncentrációknál: aktivitási koefficiens ≈ 1, tehát aktivitás ≈ [koncentráció] Definíció szerűen: Tiszta szilárd anyag aktivitása = 1 aktivitás = 1 [Ca. O] [CO 2] Kc = ▬▬▬▬▬▬ [Ca. CO 3] aktivitás = 1 Kc = [CO 2] vagy Kp = p. CO 2

Az egyensúly eltolási lehetőségei Koncentráció változtatás az egyensúlyi rendszerben sav + alkohol észter + víz [észter] [víz] Kc = ▬▬▬▬▬▬ [sav] [alkohol] Egyensúlyi állandó koncentrációkkal felírva Az egyensúlyi állandó kis szám, így kevés termék keletkezik ! Hogyan lehetne megnövelni a termék (észter) mennyiségét ? 1. Az egyensúlyi koncentrációhoz képest megnövelem a kiindulási anyag valamelyikét. K = állandó miatt a rendszer a termék képződése irányába mozdul el mindaddig amíg K el nem éri az eredeti, állapotjelzőknek megfelelő értékét. 2. A termék egyikét folyamatosan elvonom a rendszerből.

Az egyensúly eltolás lehetőségei Nyomás változtatás az egyensúlyi rendszerben N 2 + 3 H 2 1 térf. 3 térf. 2 NH 3 2 térf. Nyomás növeléssel a termék irányába tolható az egyensúly. Az egyensúlyi rendszer mindig kitér külső behatás esetén Csak akkor hatásos, ha térfogat változás történik a reakció során Hőmérséklet változás hatása az egyensúlyi rendszerre Exoterm reakciók: növekvő hőmérséklet hatására a kiinduló termékek irányába tolódik el az egyensúly. Endotherm reakciók : növekvő hőmérséklet hatására a termékek irányába tolódik el az egyensúly

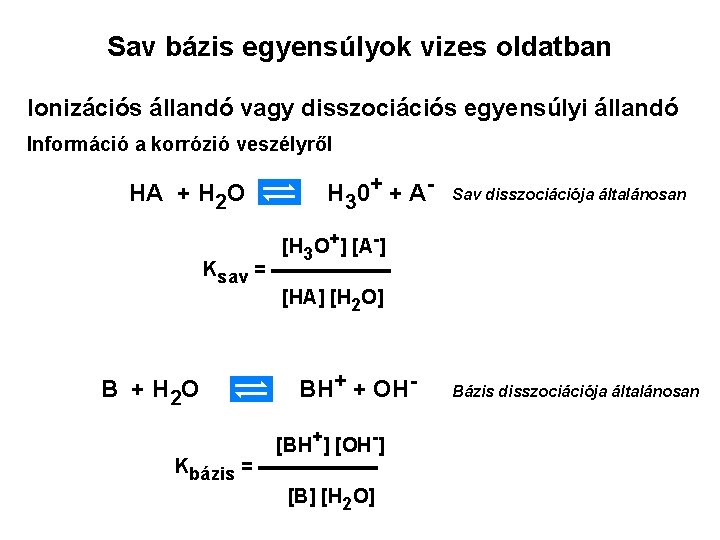
Sav bázis egyensúlyok vizes oldatban Ionizációs állandó vagy disszociációs egyensúlyi állandó Információ a korrózió veszélyről HA + H 2 O H 30+ + A - Sav disszociációja általánosan [H 3 O+] [A-] Ksav = ▬▬▬▬▬▬ [HA] [H 2 O] B + H 2 O BH+ + OH- [BH+] [OH-] Kbázis = ▬▬▬▬▬▬ [B] [H 2 O] Bázis disszociációja általánosan

Sav bázis egyensúlyok vizes oldatban Ksav = Ks és Kbázis = Kb gyakran olyan kis szám, hogy a negatív logaritmusát adjuk meg p. Ks = - log Ks Sav Sósav Kénsav Salétromsav Triklórecetsav Kénessav Ecetsav Szénsav Ks és p. Kb = - log Kb p. Ks ∞ ∞ ∞ 3, 0*10 -1 1, 6*10 -2 1, 8*10 -5 4, 3*10 -7 Erős savak 0, 52 1, 79 4, 75 6, 37 Gyenge savak Nagyobb disszociációs állandó azaz kisebb p. Ks nagyobb korrózió veszély

Savbázis egyensúlyok Bázis Kb Nátrium-hidroxid ∞ Lítium-hidroxid ∞ Kálium-hidroxid ∞ Etilamin 6, 5*10 -4 Ammónia 1, 8*10 -5 Piridin 1, 8*10 -9 p. Kb Erős bázisok 3, 19 4, 74 4, 75 Gyenge bázisok Nagyobb disszociációs állandó azaz kisebb p. Ks nagyobb korrózió veszély alumínumra. A vas a bázisokkal szemben ellenálló.

Víz disszociációja és a p. H fogalma A H 2 O H+ + OH- reakció ΔG 0 értéke 79, 83 k. J/mol A ΔG 0 = - RTln. Kc alapján Kc = 10 -14 [H+] [OH-] Kvíz = ▬▬▬▬▬▬ = 10 -14 [H 2 O] Az elbomlás mértéke elhanyagolható, tiszta anyag aktivitása = 1 Kvíz = [H+] [OH-] = 10 -14 p. H = - lg[H+] és p. OH = -lg[OH-] p. H + p. OH = 14 0 ≤ p. H < 7 savas tartomány, savas jelleg a p. H csökkenésével nő p. H = 7 semleges oldat 7 < p. H ≤ 14 lúgos tartomány, lúgos jelleg nő a p. H növekedésével

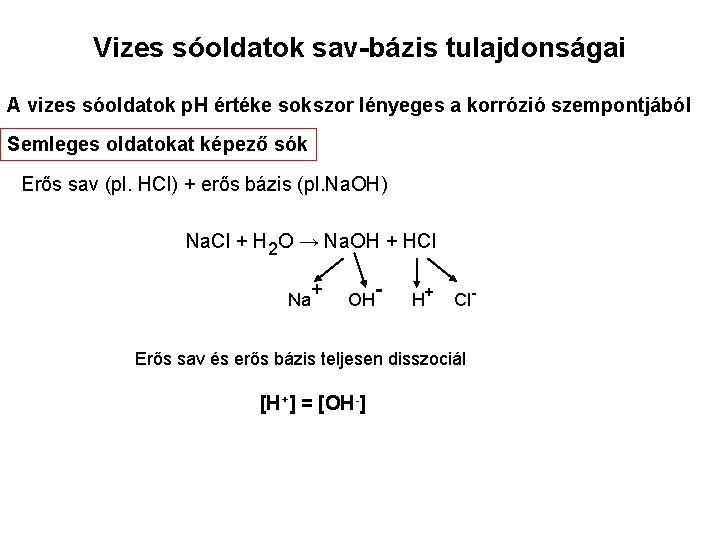
Vizes sóoldatok sav-bázis tulajdonságai A vizes sóoldatok p. H értéke sokszor lényeges a korrózió szempontjából Semleges oldatokat képező sók Erős sav (pl. HCl) + erős bázis (pl. Na. OH) Na. Cl + H 2 O → Na. OH + HCl Na + OH - H+ Cl- Erős sav és erős bázis teljesen disszociál [H+] = [OH-]

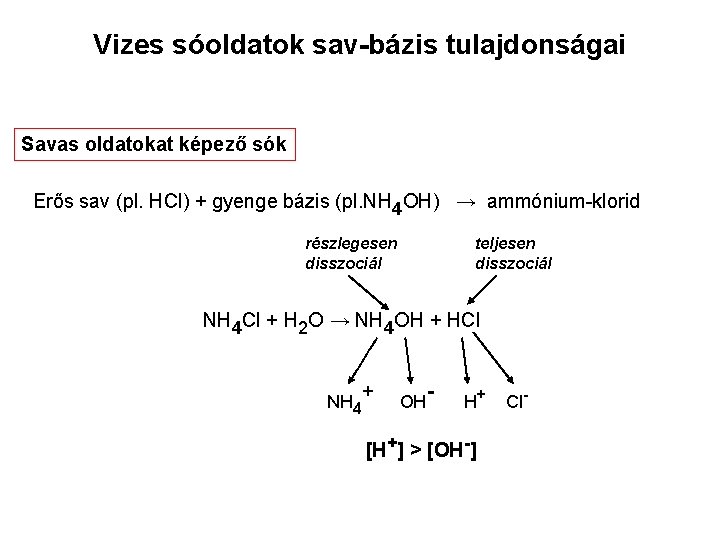
Vizes sóoldatok sav-bázis tulajdonságai Savas oldatokat képező sók Erős sav (pl. HCl) + gyenge bázis (pl. NH 4 OH) → ammónium-klorid részlegesen disszociál teljesen disszociál NH 4 Cl + H 2 O → NH 4 OH + HCl NH 4 + OH - H+ [H+] > [OH-] Cl-

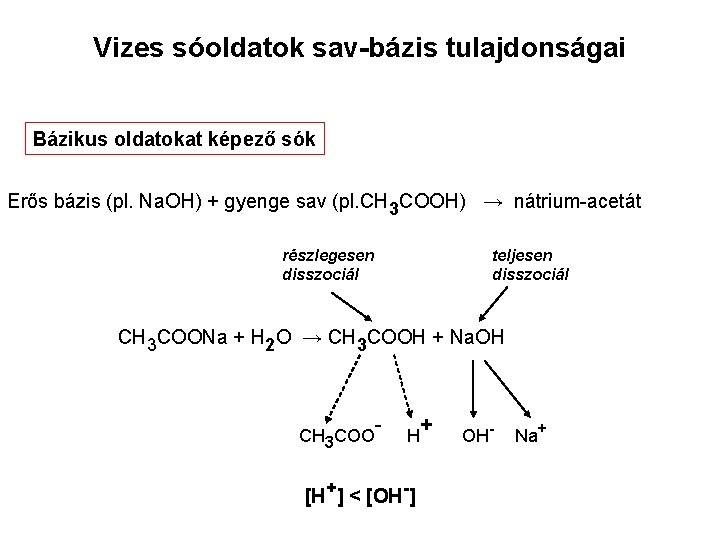
Vizes sóoldatok sav-bázis tulajdonságai Bázikus oldatokat képező sók Erős bázis (pl. Na. OH) + gyenge sav (pl. CH 3 COOH) → nátrium-acetát részlegesen disszociál teljesen disszociál CH 3 COONa + H 2 O → CH 3 COOH + Na. OH CH 3 COO - H [H+] < [OH-] + OH- Na+

Savas eső, savas szennyvíz hatása a vízi élővilágra Természetes vizek hidrokarbonát egyensúlya HCO 3 - + H+ CO 2 + H 2 O A savas eső és a savas szennyvíz [H+] ion többletet juttat az egyensúlyi rendszerbe, amely eltolódik a szén-dioxid képződés irányába A halak megfulladnak

Sav-bázis indikátorok működése Hindikátor: egy gyenge sav Hindikátor + H 2 O piros színű molekuláris forma indikátor- + H 3 O+ sárga színű ionos forma Sav hozzáadására az egyensúly balra tolódik: piros lesz az oldat Lúg hozzáadására a (a lúg elfogyasztja a H 3 O+ ionokat) az egyensúly jobbra tolódik : az oldat sárga lesz Semleges állapotban narancs színű az oldat

Számítási gyakorlatok

1. Homogén egyensúlyi állandó számítása Az alábbi reakcióegyenlettel felírt egyensúlyi folyamat vizsgálatánál 230 °C-on a következő egyensúlyi koncentrációkat mérték: [NO] = 0, 0524 mol/dm 3 [O 2] = 0, 127 mol/dm 3 [NO 2] = 15, 5 mol/dm 3] 2 NO (g) + O 2 2 NO 2 (g) Számítsuk ki az egyensúlyi állandót ! Kc = [NO 2]2 [NO]2 [O 2] (15, 5)2 = (0, 0524)2 (0, 127) = 6, 89*105 Mindegyik kiindulási adat három értékes jeggyel volt megadva, így az eredmény is három értékes jeggyel adható meg.

2. Erős sav vizes oldatának p. H értéke Számítsuk ki a 0, 01 mol/dm 3 koncentrációjú vizes sósav oldat p. H értékét ! A sósav erős sav, vízben teljesen disszociál HCl → H+ 1 mol → 1 mol egy mol sósavból 1 mol H+ ion képződik 0, 01 mol → 0, 01 mol az 1 dm 3 –ben lévő 0, 01 mol sósavból arányosan kevesebb, azaz 0, 01 mol H+ ion képződik + Cl- A p. H a hidrogénion-koncentráció negatív előjelű logaritmusa, így p. H = - lg [0, 01] = 2, 0 Logaritmus képzése esetén a kiindulási adat értékes jegyeinek száma megegyezik a logaritmus számban a tizedes vessző utáni számjegyek számával.

3. Erős sav vizes oldatának p. H értéke Számítsuk ki a 0, 05 mol/dm 3 koncentrációjú vizes kénsav oldat p. H értékét ! A kénsav erős sav, vízben teljesen disszociál H 2 SO 4 1 mol 0, 05 mol → → → 2 H+ 2 mol 0, 1 mol + SO 4 - egy mol kénsavból 2 mol H+ ion képződik az 1 dm 3 –ben lévő 0, 05 mol kénsavból arányosan kevesebb, azaz 0, 1 mol H+ ion képződik A p. H a hidrogénion-koncentráció negatív előjelű logaritmusa, így p. H = - lg [0, 1] = 1, 0

4. Erős bázis vizes oldatának p. H értéke Számítsuk ki a 0, 01 mol/dm 3 koncentrációjú vizes kálium-hidroxid oldat p. H értékét ! A lúgos oldatban a p. H-t csak közvetetten tudjuk kiszámítani. Először a p. OH-t majd a 14 = p. H +p. OH összefüggésből a p. H-t számítjuk ki. K+ → 1 mol → 0, 01 mol + OH- KOH egy mol kálium-hidroxidból 1 mol OHion képződik az 1 dm 3 –ben lévő 0, 01 mol kálium-hidroxidból arányosan kevesebb, azaz 0, 01 mol OH- ion képződik p. OH = - lg [OH- ] = - lg [0, 01] = 2, 0 A p. H + p. OH = 14 összefüggésből p. H = 12

5. Gyenge sav vizes oldatának p. H értéke A 1, 0*10 -2 mol/dm 3 ecetsav vizes oldatában az ecetsav molekulák 4, 2 %-a disszociál. Számítsuk ki a disszociációs egyensúlyi állandót és a p. H-t. 1 dm 3 oldatban CH 3 COOH kiindulási állapot 0, 010 mol egyensúlyi állapot H+ + CH 3 COO- 0 mol (0, 010 – 0, 010*0, 042) mol 0, 010*0, 042 mol Egyensúlyi állapotban az 1 dm 3 -ben lévő 0, 010 mol ecetsav molekula 4, 2%-a elbomlik, így a megmaradó mennyiség (0, 010 – 0, 010*0, 042) mol. A reakcióegyenletből azt látjuk, hogy 1 mol ecetsavból 1 mol H+ ion és egy mol CH 3 COO- (acetátion) képződhet, tehát az elbomlott 0, 010*0, 042 mol ecetsavból ugyanennyi mol hidrogénion és acetátion képződik, azaz a H+ ionkoncentráció 4, 2*10 -4 mol/dm 3 Kc = [H+] [CH 3 COO- ] [CH 3 COOH] = Az oldat p. H értéke ( 4, 2*10 – 4 )*(4, 2*10 – 4 ) 9, 58*10 – 3 = 1, 84*10 - 5 = 1, 8*10 -5 p. H = - lg [ 4, 2*10 – 4 ] = 3, 38 = 3, 4

6 a. Adott p. H-ju víz előállítása Számítsa ki, hogy 2, 0 m 3 p. H = 3, 0 –as víz előállításához mennyi sósav (moltömeg: 36, 5), illetve mennyi késav (moltömeg: 98) szükséges ! Sósav szükséglet: A p. H = 3, 0 azt jelenti, hogy a víz hidrogénion koncentrációja 0, 0010 mol/dm 3. Mivel a sósav esetén 1 mol sósavból 1 mol hidrogénion lesz, így az oldat minden dm 3 -e 0, 0010 mol sósavat kell, hogy tartalmazzon. 2, 0 m 3 = 2, 0*103 dm 3 tehát a sósav szükséglet 2, 0*103*0, 0010 = 2, 0 mol sósav Tömegben kifejezve: 2, 0 mol * 36, 5 = 73 g Kénsav szükséglet: A p. H = 3, 0 azt jelenti, hogy a víz hidrogénion koncentrációja 0, 0010 mol/dm 3. Mivel a kénsav esetén 1 mol kénsavból 2 mol hidrogénion lesz, így az oldat minden dm 3 -e 0, 0010 / 2, 0 = 0, 00050 mol kénsavat kell, hogy tartalmazzon. 2, 0 m 3 = 2, 0*103 dm 3 tehát a kénsav szükséglet 2, 0*103*0, 00050 = 1, 0 mol kénsav Tömegben kifejezve: 1, 0 mol * 98 = 98 g

6 b. Adott p. H-ju víz előállítása Számítsa ki, hogy 2, 0 m 3 p. H = 12, 0 –es víz elkészítéséhez hány kg nátrium-hidroxid (moltömeg: 40, 0) szükséges ! A p. H + p. OH = 14 összefüggés alapján p. OH = 14 – 12, 0 = 2 A p. OH = 2 azt jelenti, hogy a víz hidroxidion koncentrációja 1*10 -2 mol/dm 3. 2, 0 m 3 esetén az OH – ionok mennyisége 2, 0*103 dm 3 * 1*10 -2 mol/dm 3 = 2*101 mol A nátrium-hidroxid lévén erős bázis, teljesen disszociál, azaz 1 mol Na. OH-ból 1 mol OH– ion képződik. Na. OH → Na+ + OH- 2*101 mol hidroxidion képződéséhez 2*101 mol nátrium-hidroxid, azaz 2*101 * 40, 0 = 8*102 g, azaz 0, 80 kg nátrium-hidroxid szükséges.

7. Savas szennyvíz semlegesítése Számítsa ki, hogy 10, 0 m 3 p. H=2, 0 szennyvíz semlegesítéséhez hány kg 5, 0 tömeg % nátrium-kloridot és 5, 0 tömeg % vizet tartalmazó technikai minőségű nátrium-hidroxid szükséges ! Na. OH moltömege: 40, 0 p. H = 2, 0 jelentése, a szennyvíz hidrogénion koncentrációja 0, 010 mol/dm 3. 10, 0 m 3 szennyvíz hidrogénion tartalma 1, 00*104 dm 3 * 0, 010 mol/dm 3 = 1, 0*102 mol Közömbösítési reakció: H+ + OH- = H 2 O 1, 0 mol + 1, 0 mol Tehát a szükséges OH- ion mennyisége szintén 1, 0*102 mol. A nátrium-hidroxid erős bázis teljesen disszociál: Na. OH = Na+ + OH 1 mol Tehát 1, 0*102 mol OH- ion 1, 0*102 mol nátrium-hidroxid disszociálása során képződik. 1, 0*102 mol Na. OH = 1, 0*102 * 40, 0 = 4, 0*103 g A nátrium hidroxid azonban 5, 0+5, 0 = 10, 0 % inaktív szennyezést tartalmaz, ezért a szükséges mennyiség 4, 0*103 g / 0, 900 = 4, 44 kg ≈ 4, 4 kg