MSZAKI KMIA ELADSOK GPSZMRNK HALLGATKNAK 2 REAKCIKINETIKA Dr




![Reakciósebesség Időegység alatt bekövetkező koncentráció változás: Monomolekuláris reakcióknál v = k [A] Bimolekuláris reakcióknál Reakciósebesség Időegység alatt bekövetkező koncentráció változás: Monomolekuláris reakcióknál v = k [A] Bimolekuláris reakcióknál](https://slidetodoc.com/presentation_image_h/a3d409a34d24799ca3a2780f6606f00b/image-6.jpg)






- Slides: 18

MŰSZAKI KÉMIA ELŐADÁSOK GÉPÉSZMÉRNÖK HALLGATÓKNAK 2. REAKCIÓKINETIKA Dr. Bajnóczy Gábor BME Kémiai és Környezeti Folyamatmérnöki Tanszék

AZ ELŐADÁS ANYAGA, KÉPEK, RAJZOK KIZÁRÓLAG OKTATÁSI CÉLRA, KORLÁTOZOTT HOZZÁFÉRÉSSEL HASZNÁLHATÓK ! INTERNETRE KORLÁTLAN HOZZÁFÉRÉSSEL FELTENNI TILOS !

Reakciókinetika Mitől függ a reakciósebesség és hogyan tudjuk befolyásolni ? C 6 H 12 O 6 + 6 O 2 = 6 CO 2 1 mol ● -910 k. J/mol + 6 mol ● - 394 k. J/mol 6 H 2 O (g) ΔG 0 = -3182 k. J 6 mol ● -288 k. J/mol Ezek szerint a szőlőcukornak el kellene égni szobahőmérsékleten ! Igen, de nem ég el, mivel a folyamat kinetikailag gátolt A termodinamika csak a lehetőséget adja meg. Az utat nekünk kell megtalálni !

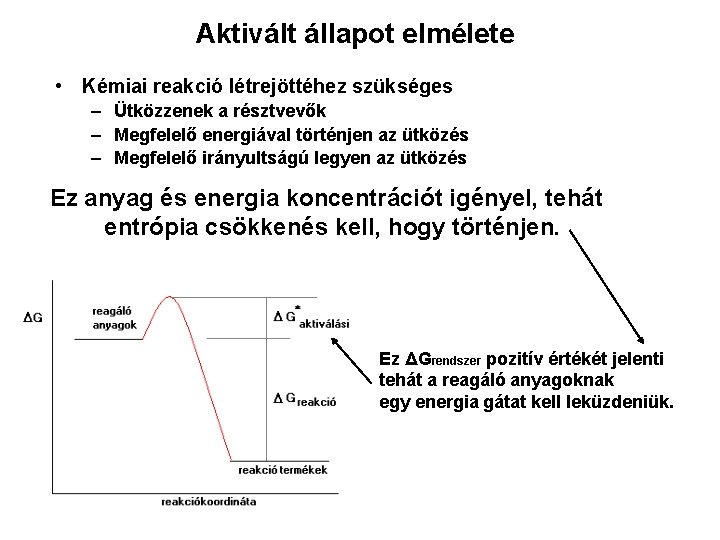
Aktivált állapot elmélete • Kémiai reakció létrejöttéhez szükséges – Ütközzenek a résztvevők – Megfelelő energiával történjen az ütközés – Megfelelő irányultságú legyen az ütközés Ez anyag és energia koncentrációt igényel, tehát entrópia csökkenés kell, hogy történjen. Ez ΔGrendszer pozitív értékét jelenti tehát a reagáló anyagoknak egy energia gátat kell leküzdeniük.

Reakciók molekularitása • Monomolekuláris reakciók A ----- termékek • Bimolekuláris reakciók A + A ----- termékek • A + B ----- termékek • Trimolekuláris reakciók • • A + A ----- termékek A + B ----- termékek A + C + B ----- termékek Ezt a három típust nevezzük elemi reakcióknak Tovább nem folytatható, mivel nincs gyakorlati valószínűsége, hogy négy molekula egyidejűleg hatásosan ütközzön.
![Reakciósebesség Időegység alatt bekövetkező koncentráció változás Monomolekuláris reakcióknál v k A Bimolekuláris reakcióknál Reakciósebesség Időegység alatt bekövetkező koncentráció változás: Monomolekuláris reakcióknál v = k [A] Bimolekuláris reakcióknál](https://slidetodoc.com/presentation_image_h/a3d409a34d24799ca3a2780f6606f00b/image-6.jpg)
Reakciósebesség Időegység alatt bekövetkező koncentráció változás: Monomolekuláris reakcióknál v = k [A] Bimolekuláris reakcióknál v = k [A] 2 vagy v = k [A][B] Trimolekuláris reakcióknál v = k[A]3 vagy v = k[A][B]2 …. k = reakciósebességi állandó v : pillanatnyi reakciósebesség Elemi reakcióknál a sebességi egyenlet felírható a reakcióegyenletből

Összetett reakciók reakciósebessége 2 A +4 B + 5 C = E+6 D ▼ v = k [A]a ● [B]b ● [C]c a, b, c : kitevők tetszőleges számok, részrendek, a reakció részrendjei csak kísérletileg határozhatók meg a+b+c = a reakció rendűsége, bruttó rendje v = k [A]4 ● [B]-1, 2 ● [C]0 Ennél a reakciónál [A] koncentrációjának növelése robbanáshoz vezethet [B] koncentrációjának növelésével a reakció lassulását lehet elérni, [C] koncentrációja nem befolyásolja a reakciósebességet

Kémiai reakciók hőmérséklet függése Növekvő hőmérséklet a reakciósebesség növekedését eredményezi A szobahőmérsékleten lejátszódó reakciók sebessége 1, 5 -3 szorosára nő, ha a hőfokot 10 °C-al megemeljük Reakciósebesség hőmérséklet függése (Arrhenius féle empírikus egyenlet) A reakciók gyorsítására T növelése nem mindig megfelelő pl. az energia igény miatt Katalizátor alkalmazásával viszont gyorsíthatjuk a reakciót hőmérséklet emelés nélkül

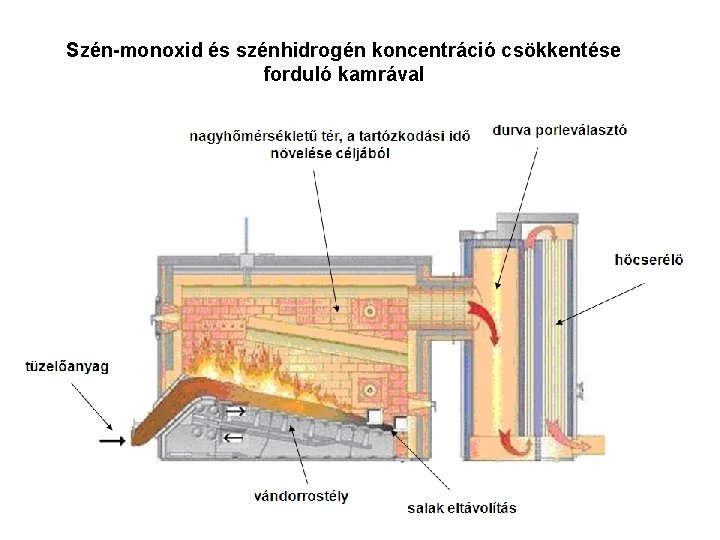
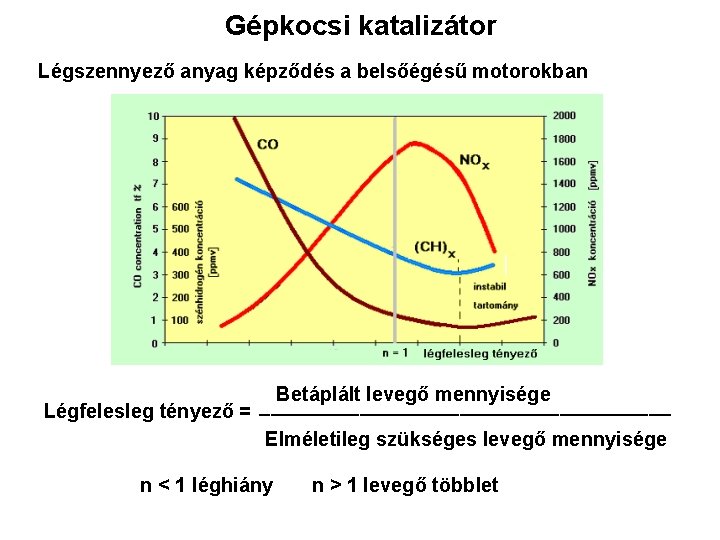
Légszennyező anyagok képződése a belsőégésű motorokban Szén - monoxid C +O 2 = CO 2 2 C +O 2 = 2 CO 2 v 1 v 2 V 1 >> V 2 Ha nincs elegendő oxigén vagy kicsi tartózkodási idő sok lesz a füstgáz szén-monoxid tartalma Nitrogén-oxid N 2 +O 2 = 2 NO Endoterm reakció, ezért n = 1 -nél képződési maximum Szénhidrogének Cx. Hy +O 2 -- > CO 2 + H 2 O Cx. Hy +O 2 --- > szénváz + H 2 O szénváz + O 2 --- > CO majd CO 2 Ha nincs elegendő oxigén vagy kicsi tartózkodási idő sok lesz a füstgáz szénhidrogén tartalma

Szén-monoxid és szénhidrogén koncentráció csökkentése forduló kamrával

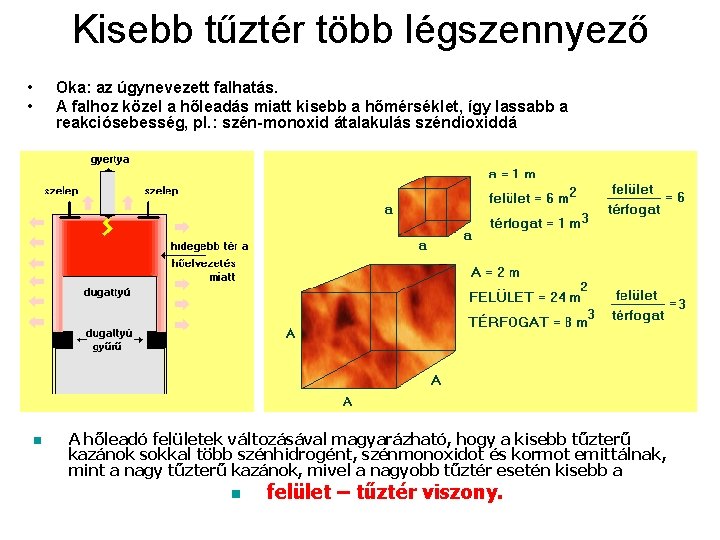
Kisebb tűztér több légszennyező • • n Oka: az úgynevezett falhatás. A falhoz közel a hőleadás miatt kisebb a hőmérséklet, így lassabb a reakciósebesség, pl. : szén-monoxid átalakulás széndioxiddá A hőleadó felületek változásával magyarázható, hogy a kisebb tűzterű kazánok sokkal több szénhidrogént, szénmonoxidot és kormot emittálnak, mint a nagyfal tűzterű a nagyobb tűztér esetén kisebb Hidegebb lassítjakazánok, az oxidációmivel sebességét és a dugattyú hamarabb tolja aki a gázelegyet ebből a térrészből, mint – a teljes elégéshez szükséges idő. n felület tűztér viszony.

Gépkocsi katalizátor Légszennyező anyag képződés a belsőégésű motorokban Betáplált levegő mennyisége ___________________ Légfelesleg tényező = Elméletileg szükséges levegő mennyisége n < 1 léghiány n > 1 levegő többlet

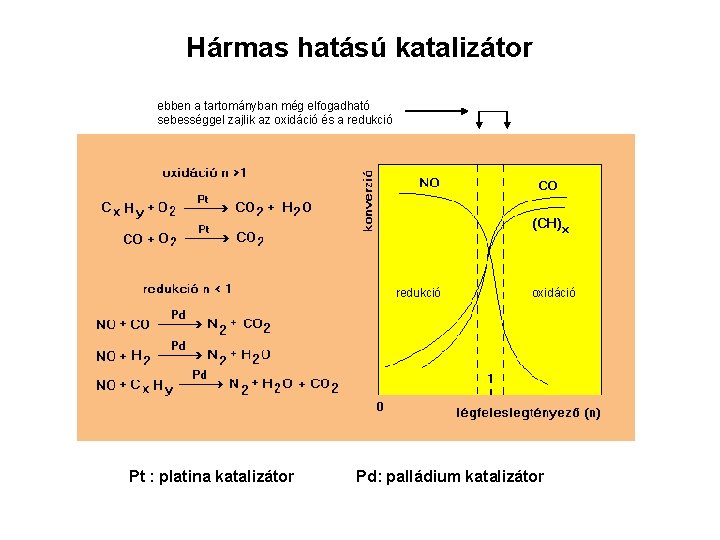
Hármas hatású katalizátor ebben a tartományban még elfogadható sebességgel zajlik az oxidáció és a redukció Pt : platina katalizátor oxidáció Pd: palládium katalizátor

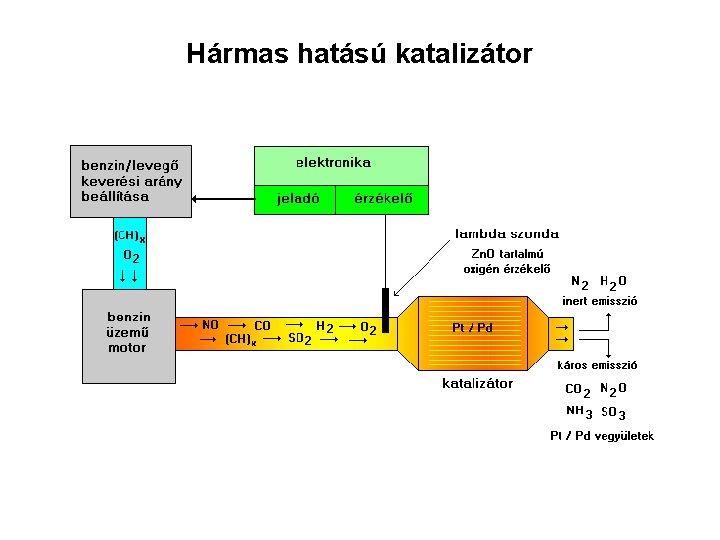
Hármas hatású katalizátor

Hármas hatású katalizátor A keramiatest csöveinek belső falára viszik fel a katalizátort.

Példa az igen gyors kémiai reakciókra Légzsák: 2 Na. N 3 = 2 Na + 3 N 2 a fém nátrium gyúlékony ! 10 Na + 2 KNO 3 = K 2 O + 5 Na 2 O + N 2 a Na 2 O és K 2 O vakságot okoz K 2 O + Na 2 O + Si. O 2 ------ > alkáli - szilikátok nem veszélyes Tehát a légzsákot a - nátrium - azid, - kálium - nitrát, - szilicium – dioxid keverékéből elektromos gyújtás hatására beinduló kémiai reakció során képződő nitrogén fújja fel

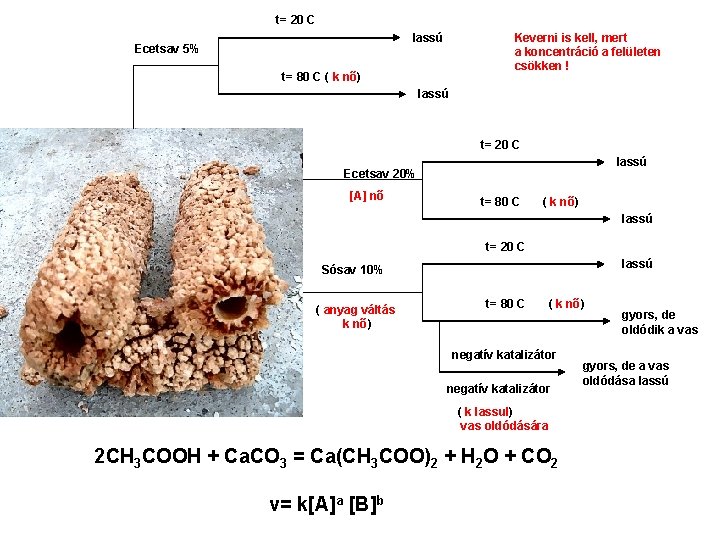
t= 20 C lassú Ecetsav 5% Keverni is kell, mert a koncentráció a felületen csökken ! t= 80 C ( k nő) lassú t= 20 C lassú Ecetsav 20% [A] nő t= 80 C ( k nő) lassú t= 20 C lassú Sósav 10% ( anyag váltás k nő) t= 80 C ( k nő) negatív katalizátor ( k lassul) vas oldódására 2 CH 3 COOH + Ca. CO 3 = Ca(CH 3 COO)2 + H 2 O + CO 2 v= k[A]a [B]b gyors, de oldódik a vas gyors, de a vas oldódása lassú

Homeopátiás gyógyszerek ? Elve: A hatóanyagot olyan mértékben kell hígítani pl. : vízzel, hogy a kész „gyógyszerben” már csak néhány molekula vagy annyi se legyen. A vízmolekulák majd emlékeznek !!? ? a hatóanyagra és így fejtik ki gyógyító hatásukat. v = k [A]a ● [B]b ● [C]c Ha [A] azaz a hatóanyag koncentrációja tart a nullához a „v” reakciósebesség, azaz a gyógyulásért felelős kémiai reakció sebessége is tart a nullához. A készítmény hatóanyaga: 0, 01 ml Anas Barbariae hepatis et cordis extractum 200 K 1 g pelletben műanyag tartályonként. 200 K (Korsakov hígítás) = 10400 hígítás 1 K = 102 hígítás