Fizikai kmia 2 Reakcikinetika Szmolsi gyakorlat tkzsi elmlet






















- Slides: 27

Fizikai kémia 2 – Reakciókinetika Számolási gyakorlat Ütközési elmélet Nyomásfüggő reakciók 4. gyakorlat

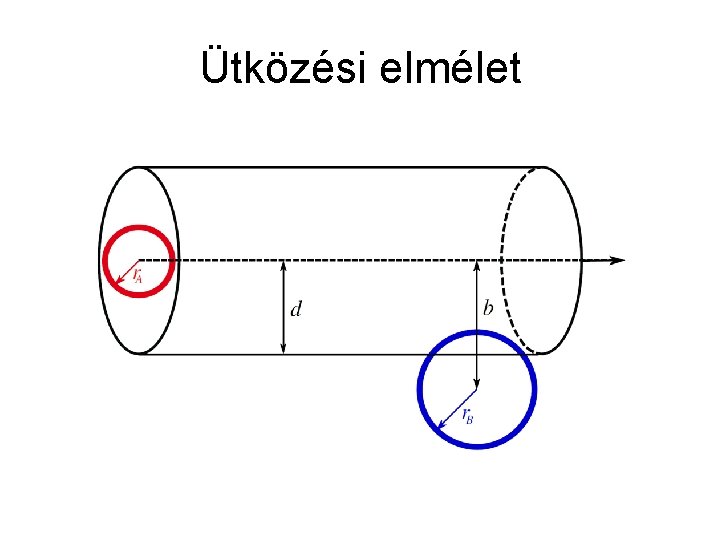
Ütközési elmélet

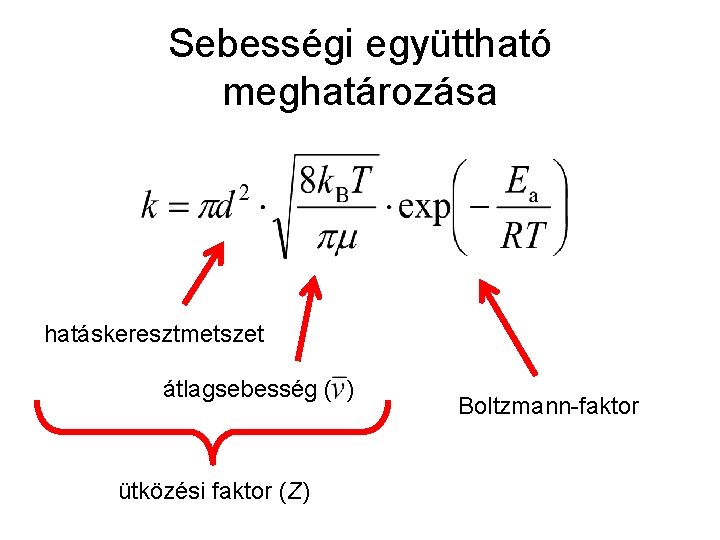
Ütközési elmélet • Feltétel: merev gömbök ütközése • Sebességi együttható számítása: • • • k: sebességi együttható d: gömbszerű részecskék (A és B) sugarának összege T: hőmérséklet μ: redukált tömeg Ea: aktiválási energia

Sebességi együttható meghatározása hatáskeresztmetszet átlagsebesség ( ) ütközési faktor (Z) Boltzmann-faktor

Ütközések száma • Az ütközések száma: • NA: az A részecskék száma egységnyi térfogatban

Ütközési elmélet • 1. feladat: a) Számítsuk ki az A és B molekulák közötti ütközések számát, ha mind az A, mind a B molekula parciális nyomása 100 torr 300 K hőmérsékleten, az A molekula átmérője 0, 3 nm, a B molekuláé 0, 4 nm, a részecskék átlagos sebessége pedig 5∙ 102 m/s ezen a hőmérsékleten. b) A ütközések hányad része történik elegendő energiával ahhoz, hogy végbemenjen a reakció az adott hőmérsékleten, ha az aktiválási energia 40 k. J/mol? c) Határozzuk meg a reakció sebességi együtthatóját!

Ütközési elmélet • 1. feladat: a) Számítsuk ki A és B molekula között az ütközések számát, ha mind az A, mind a B parciális nyomása 100 torr 300 K hőmérsékleten, az A molekula átmérője 0, 3 nm, B molekuláé 0, 4 nm, a részecskék átlagos sebessége pedig 5∙ 102 m/s ezen a hőmérsékleten.

Ütközési elmélet • 1. feladat: a)

Ütközési elmélet • 1. feladat: b) A ütközések hányad része történik elegendő energiával ahhoz, hogy végbemenjen a reakció az adott hőmérsékleten, ha az aktiválási energia 40 k. J/mol?

Ütközési elmélet • 1. feladat: c) Határozzuk meg a reakció sebességi együtthatóját!

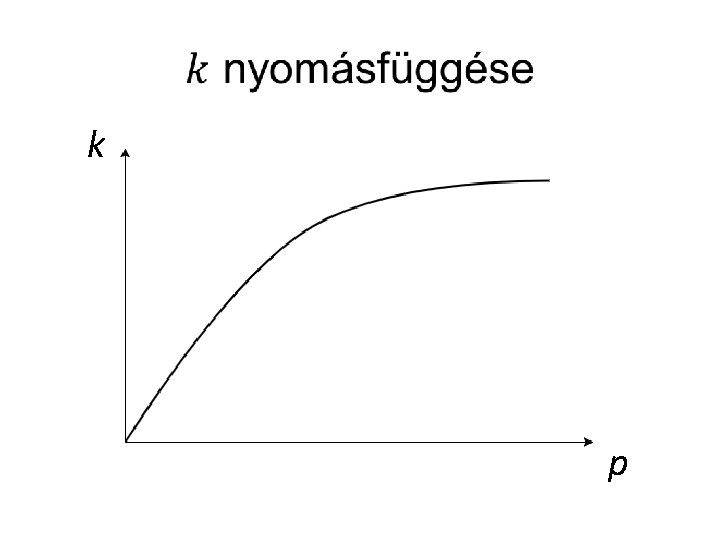
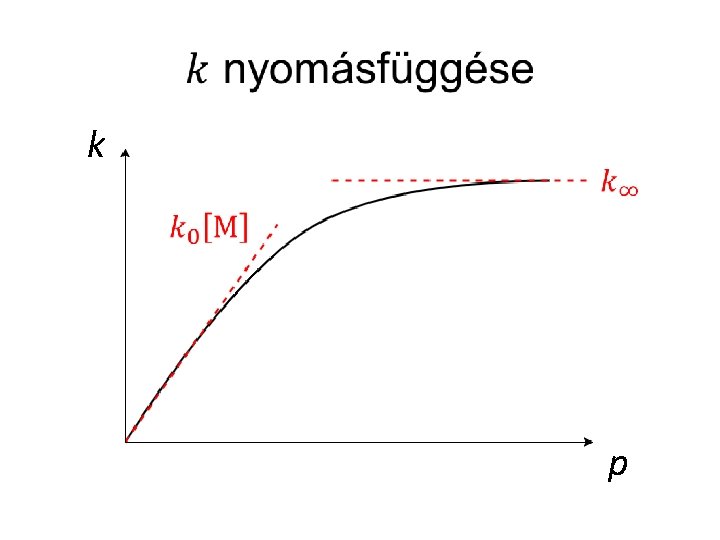
Nyomásfüggő reakciók •

k p

k p

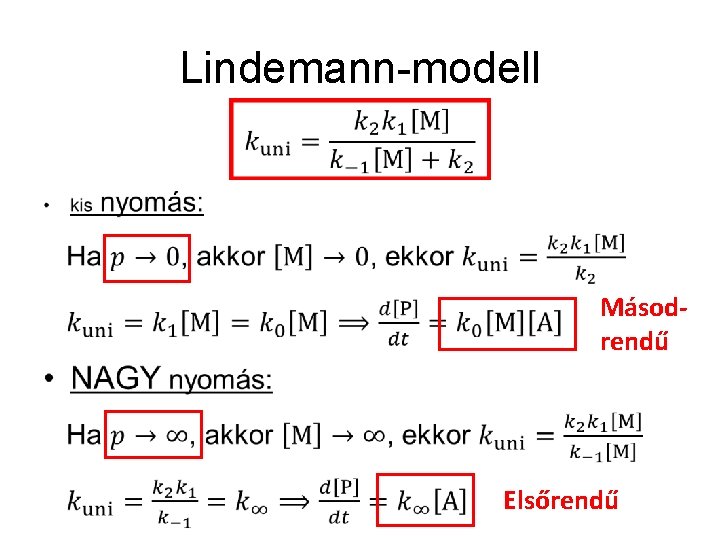
Lindemann-modell •

Lindemann-modell •

Lindemann-modell •

Lindemann-modell • Másodrendű Elsőrendű

Lindemann-modell • Ahol , a redukált nyomás

Lindemann-modell •

Lindemann-modell •

Lindemann-modell •

Lindemann-modell • Harmadrendű Másodrendű

Lindemann-modell • Ahol , a redukált nyomás

Nyomásfüggő reakciók • 2. Feladat Metilgyökök vizsgáljuk: rekombinációjának sebességi együtthatóját CH 3 + CH 3 (+ M) → C 2 H 6 (+ M) Mekkora a fenti bimolekulás reakció sebességi együtthatója a Lindemann-modell szerint 800 K hőmérsékleten és 5 k. Pa nyomáson, amennyiben ismertek a reakció 0 és végtelen nagy nyomásra extrapolált sebességi együtthatóinak a kiterjesztett Arrhenius-egyenlet alapján megadott paraméterei? A 0 = 1, 27∙ 1041 cm 6 mol− 2 s− 1; n 0 = − 7, 00; E 0 = 2, 76 k. J mol− 1 A∞ = 1, 81∙ 1013 cm 3 mol− 1 s− 1; n∞ = 0; E∞ = 0 k. J mol− 1

Nyomásfüggő reakciók •

Nyomásfüggő reakciók •

Köszönöm a figyelmet!
 Koacervátum
Koacervátum Pascal idézetek
Pascal idézetek Alma mater
Alma mater Fizikai evolúció
Fizikai evolúció Indexikus jel
Indexikus jel Erő mértéke rejtvény
Erő mértéke rejtvény Fizikai felmérő rendőrség 2021
Fizikai felmérő rendőrség 2021 Fizikai jelek
Fizikai jelek Fizikai változás fogalma
Fizikai változás fogalma Repülés fizikai alapjai
Repülés fizikai alapjai Atkins fizikai kémia
Atkins fizikai kémia Oe bgk szakmai gyakorlat
Oe bgk szakmai gyakorlat De ik szakmai gyakorlat
De ik szakmai gyakorlat Sket gyakorlat
Sket gyakorlat Pte ktk szakmai gyakorlat helyek
Pte ktk szakmai gyakorlat helyek Szte gtk karrier iroda
Szte gtk karrier iroda Eke gyker
Eke gyker Sze szakmai gyakorlat
Sze szakmai gyakorlat