MSZAKI KMIA ELADSOK GPSZMRNK HALLGATKNAK 5 Korrzi Dr





















- Slides: 36

MŰSZAKI KÉMIA ELŐADÁSOK GÉPÉSZMÉRNÖK HALLGATÓKNAK 5. Korrózió Dr. Bajnóczy Gábor BME Kémiai és Környezeti Folyamatmérnöki Tanszék

AZ ELŐADÁS ANYAGA, KÉPEK, RAJZOK KIZÁRÓLAG OKTATÁSI CÉLRA, KORLÁTOZOTT HOZZÁFÉRÉSSEL HASZNÁLHATÓK ! INTERNETRE KORLÁTLAN HOZZÁFÉRÉSSEL FELTENNI TILOS !

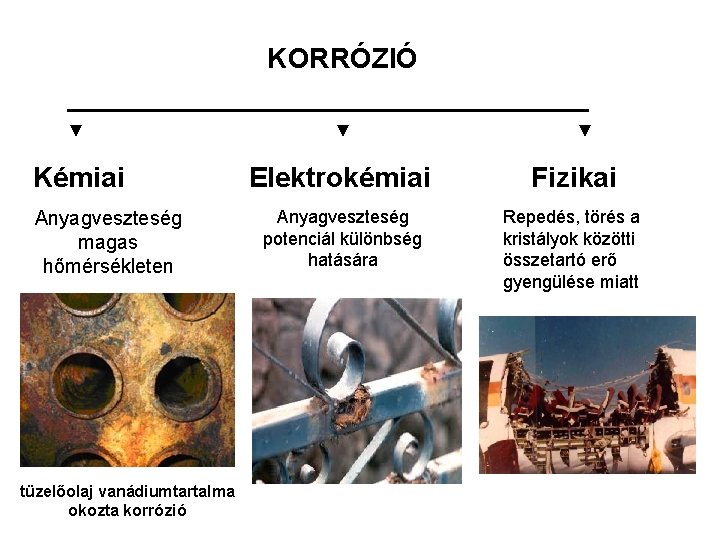
KORRÓZIÓ ▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬ ▼ ▼ ▼ Kémiai Anyagveszteség magas hőmérsékleten tüzelőolaj vanádiumtartalma okozta korrózió Elektrokémiai Fizikai Anyagveszteség potenciál különbség hatására Repedés, törés a kristályok közötti összetartó erő gyengülése miatt

KÉMIAI KORRÓZIÓ Nagy hőmérsékleten játszódik le. Előfordulás: kazánok tűztere, hőcserélőben a füstgáz oldalon. Megjelenés: általában egyenletes 1. Védőoxidréteg leoldódása: a. szulfát korrózió A tüzelőolaj nátrium-klorid és kéntartalma esetén 2 Na. Cl + SO 2 + H 2 O = Na 2 SO 4 + Cl 2 a hőcserélő tűztér felöli oldalán kondenzálódó folyékony nátrium-szulfát (op. : 884 °C) feloldja a vas, vasötvözet felületi védőoxid rétegét. (A nátrium-szulfát olvadáspontja alatti hőmérsékleten az ötvöző elemekkel képződő alacsony olvadáspontú eutektikumok - pl. Na 2 SO 4 -Co. SO 4 op: 565°C - oldják le a védőoxid réteget. ) A tűztér hőmérsékletén lejátszódó reakció Na 2 SO 4 + 2 C = Na 2 S + 2 CO 2 során képződő szulfid a vassal és az ötvöző fémekkel, alumínium, króm szulfidokat képez. A szulfidtartalmú felületi rétegen nem tud védőoxid réteg képződni.

KÉMIAI KORRÓZIÓ 1. Védőoxidréteg leoldódása: b. vanádium korrózió • olajtüzelésnél az olaj vanádium és nátrium tartalmából viszonylag alacsony olvadáspontú vegyületek képződhetnek, amelyek leoldják az egyébként magas hőmérsékleten képződő védő vas-oxid réteget. • • • Na. VO 3 V 2 O 3 Na. VO 3. Na 2 O. 3 V 2 O 5 Na 2 O. 6 V 2 O 5 op: 630 °C op: 690 °C op. 480 °C legkorrozívabb 593 °C - 816 °C A króm, nikkel, kobalt tartalmú vas ötvözetek ellenállóbbak, mert oxidjaik kevésbé oldhatók a vanadát olvadékokban.

KÉMIAI KORRÓZIÓ Tüzelőolaj nátrium és vanádium tartalma okozta korrózió http: //www. powermag. com/

KÉMIAI KORRÓZIÓ 2. Sósav és klór okozta korrózió: Kőolajalapú energiahordozó nátrium-klorid tartalma már 250 – 350 o. C-on sósavképződést eredményezhet a füstgázban. Na. Cl + H 2 O <=> HCl + Na. OH Na. Cl + CO 2 + H 2 O <=> Na 2 CO 3 + 2 HCl A nátrium-hidroxid, nátrium-karbonát a hőcserélő csövein kondenzálódhatnak. A sósav a légfelesleg oxigéntartalma miatt tovább oxidálódik. 4 HCl (gáz) + O 2 (gáz) 2 Cl 2 (gáz) + 2 H 2 O (gőz) lassú folyamat (Deacon reakció) Fe + Cl 2 = Fe. Cl 2 2 Fe. Cl 2 + 3/2 O 2 = Fe 2 O 3 + 2 Cl 2

FELÜLETI RÉTEGEK A CSŐFALON AZ OLAJTÜZELÉSNÉL

Nagy hőmérsékletű hidrogén korrózió dekarbonizáció P > A nagynyomású hidrogén a fémbe diffundálva a vas-karbid szén tartartalmával reakcióba lép és metán gáz képződik, amely feszültséget ébreszt -> törés

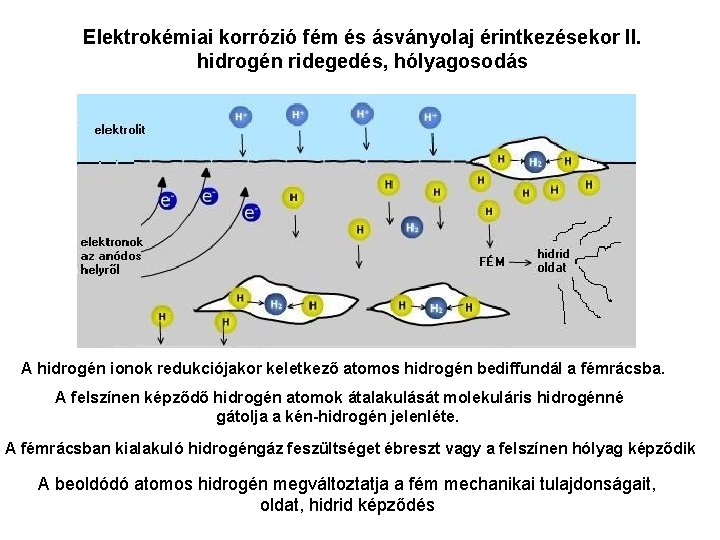
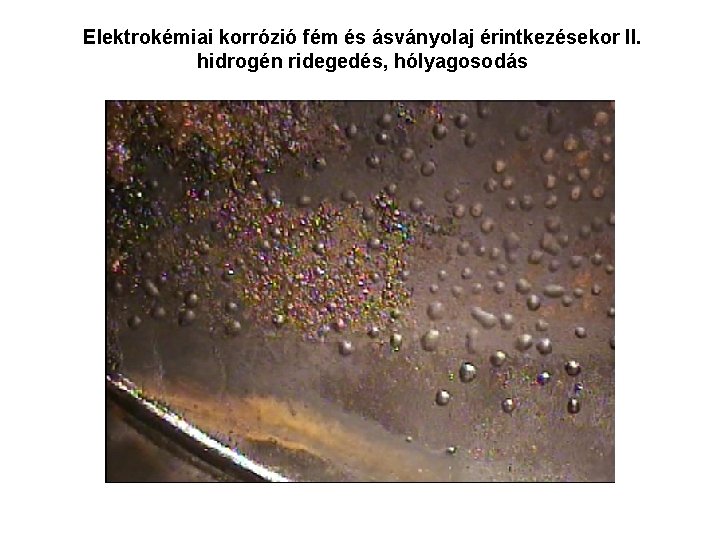
Elektrokémiai korrózió fém és ásványolaj érintkezésekor II. hidrogén ridegedés, hólyagosodás A hidrogén ionok redukciójakor keletkező atomos hidrogén bediffundál a fémrácsba. A felszínen képződő hidrogén atomok átalakulását molekuláris hidrogénné gátolja a kén-hidrogén jelenléte. A fémrácsban kialakuló hidrogéngáz feszültséget ébreszt vagy a felszínen hólyag képződik A beoldódó atomos hidrogén megváltoztatja a fém mechanikai tulajdonságait, oldat, hidrid képződés

Elektrokémiai korrózió fém és ásványolaj érintkezésekor II. hidrogén ridegedés, hólyagosodás

Elektrokémiai korrózió szükséges és elégséges feltételei I. • Legyen két különböző potenciálú hely egymással fémes összeköttetésben. ΔE = (E 10 – RT 1/n. F*lnc 1) – (E 20 – RT 2/n. F*lnc 2) • Két különböző fém ( E 10 és E 20 ) • Különböző koncentráció (c 1 és c 2 ) • Különböző hőmérséklet ( T 1 és T 2 ) • Azonos fém eltérő kristályszerkezettel (pl. hajlításnál rácstorzulás)

Elektrokémiai korrózió szükséges és elégséges feltételei II. – A két különböző potenciálú helyet kösse össze jól vezető elektrolit • Olvadékban mozgásképes ionok • Vizes oldatban nagy mozgékonyságú ionok

Elektrokémiai korrózió szükséges és elégséges feltételei III. – Redukciós (elektron felvevő) folyamat lehetősége, depolarizátor jelenléte • 2 H+ + 2 e – = H 2 • O 2 + 2 H 2 O + 4 e– = 4 OH– • Cl 2 + 2 e- = 2 Cl– A gépészmérnöki gyakorlatban a hidrogénion, az oldott oxigén és bizonyos helyeken ( pl. víztisztítás ) az elemi klór jelenléte okozza a korróziót

Két fém érintkezésekor miért mindig a negatívabb potenciálú fém korrodálódik ? - ΔG = Ecella*n*F + 0, 4 Mindig a nagyobb mértékű ΔG csökkenés valósul meg, ezért korrodál a réz helyett a vas 0, 47 V 1, 25 V

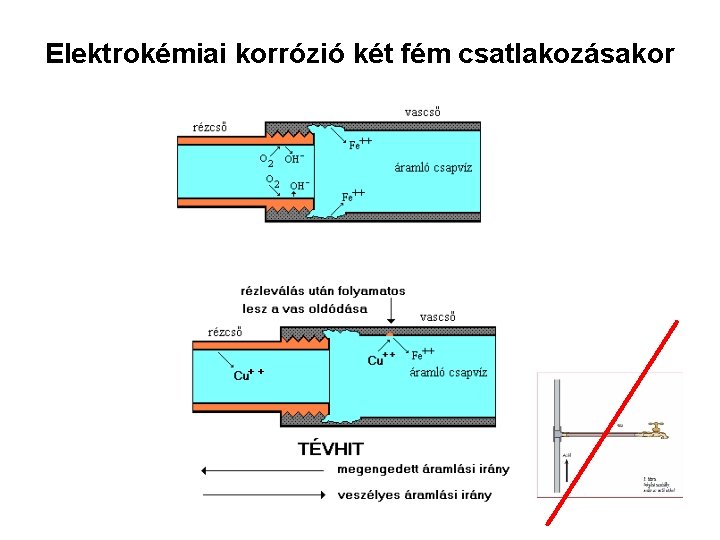
Elektrokémiai korrózió két fém csatlakozásakor ++

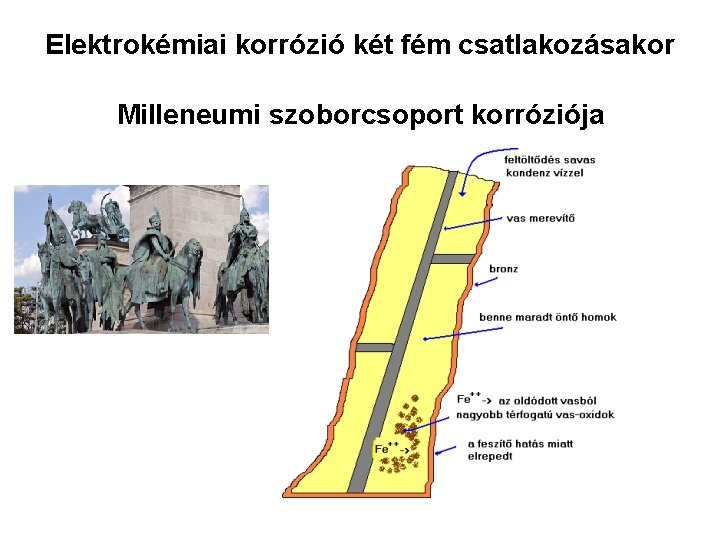
Elektrokémiai korrózió két fém csatlakozásakor Milleneumi szoborcsoport korróziója

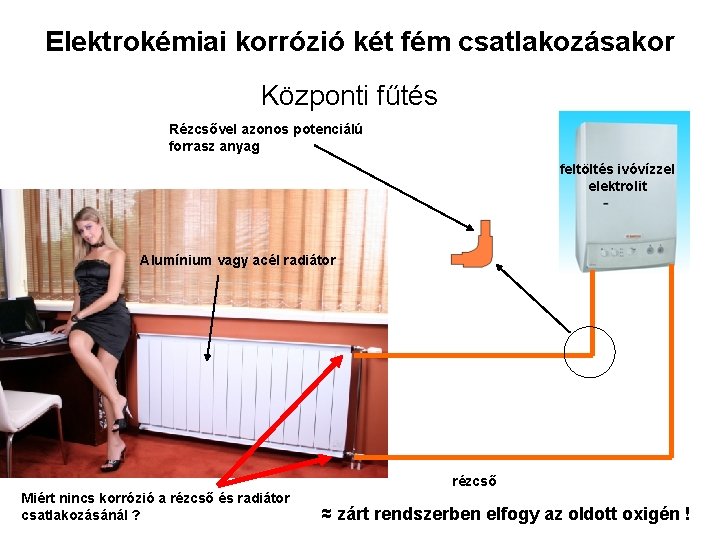
Elektrokémiai korrózió két fém csatlakozásakor Központi fűtés Rézcsővel azonos potenciálú forrasz anyag feltöltés ivóvízzel elektrolit Alumínium vagy acél radiátor rézcső Miért nincs korrózió a rézcső és radiátor csatlakozásánál ? ≈ zárt rendszerben elfogy az oldott oxigén !

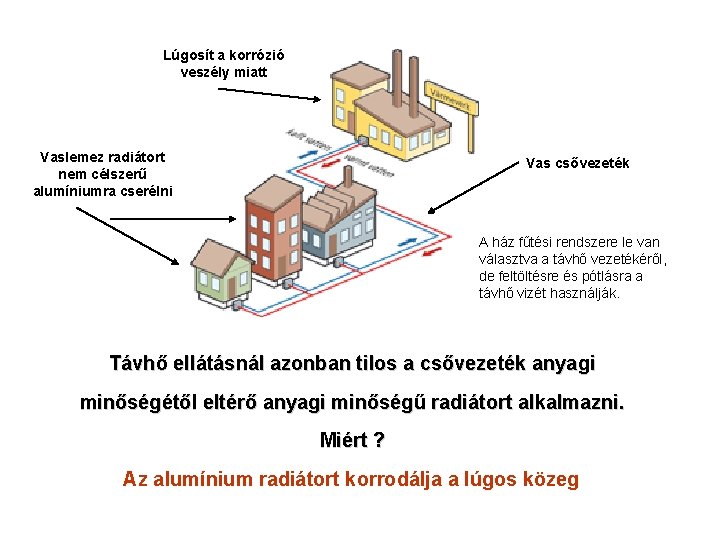
Lúgosít a korrózió veszély miatt Vaslemez radiátort nem célszerű alumíniumra cserélni Vas csővezeték A ház fűtési rendszere le van választva a távhő vezetékéről, de feltöltésre és pótlásra a távhő vizét használják. Távhő ellátásnál azonban tilos a csővezeték anyagi minőségétől eltérő anyagi minőségű radiátort alkalmazni. Miért ? Az alumínium radiátort korrodálja a lúgos közeg

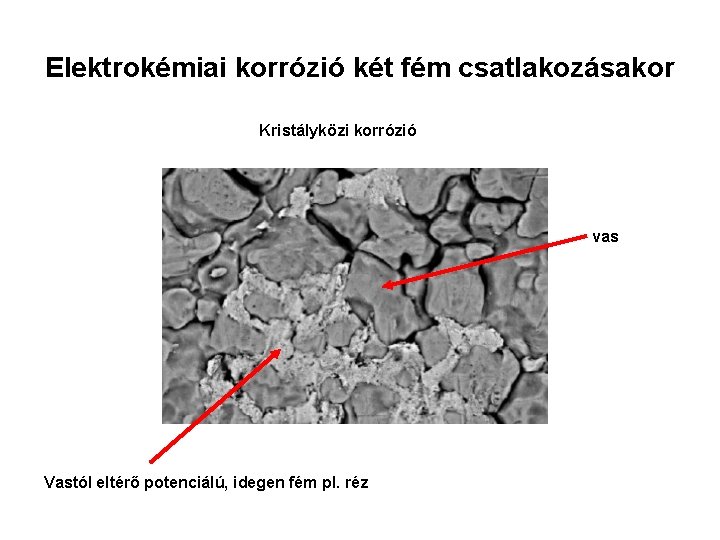
Elektrokémiai korrózió két fém csatlakozásakor Kristályközi korrózió vas Vastól eltérő potenciálú, idegen fém pl. réz

Ötvözetek korróziója Amennyiben nem jön létre az ötvöző anyagokból új vegyület a szilárd fázisban két alkotó érintkezik egymással mikroméretekben. Az öntött vas jelentős mennyiségű grafitot tartalmaz. A grafitváz és a vas között jelentős potenciálkülönbség van (vas a negatívabb ), így a vas megfelelő környezetben folyamatosan távozik a szerkezeti anyagból. A grafit az egyik legpozitívabb potenciálú szerkezeti anyag. Grafit potenciálja tengervízben telített kalomel elektródhoz képest: : + (0, 3 - 0, 2) V Vas potenciálja tengervízben telített kalomel elektródhoz képest : - (0, 6 – 0, 7) V

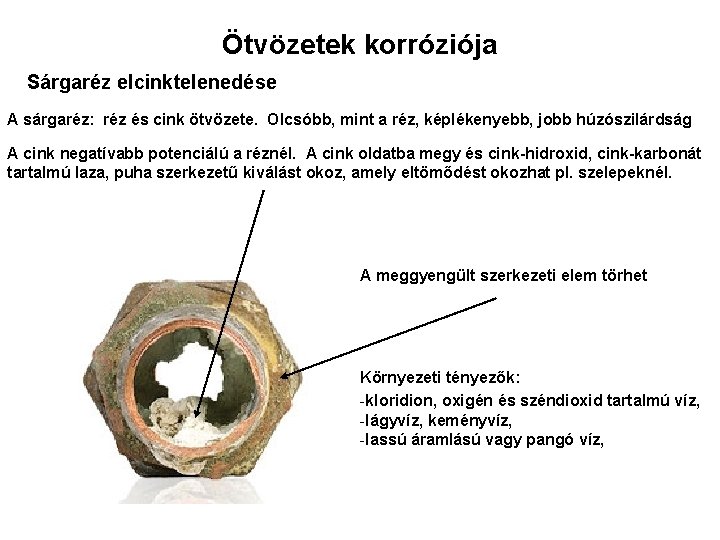
Ötvözetek korróziója Sárgaréz elcinktelenedése A sárgaréz: réz és cink ötvözete. Olcsóbb, mint a réz, képlékenyebb, jobb húzószilárdság A cink negatívabb potenciálú a réznél. A cink oldatba megy és cink-hidroxid, cink-karbonát tartalmú laza, puha szerkezetű kiválást okoz, amely eltömődést okozhat pl. szelepeknél. A meggyengült szerkezeti elem törhet Környezeti tényezők: -kloridion, oxigén és széndioxid tartalmú víz, -lágyvíz, keményvíz, -lassú áramlású vagy pangó víz,

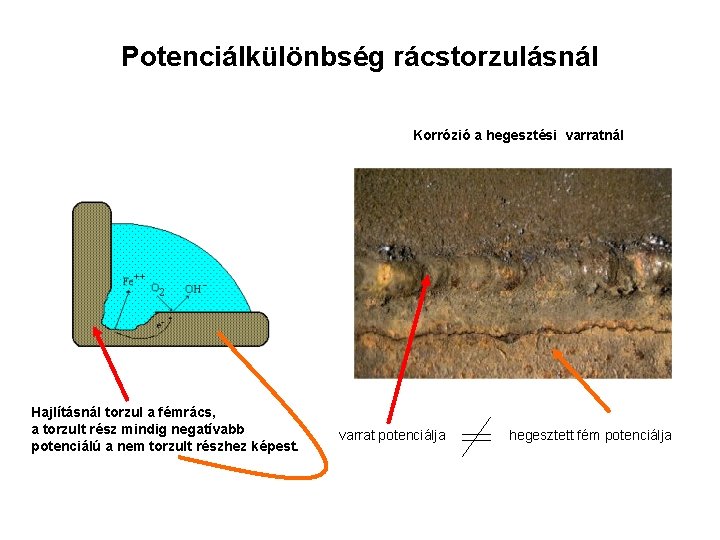
Potenciálkülönbség rácstorzulásnál Korrózió a hegesztési varratnál Hajlításnál torzul a fémrács, a torzult rész mindig negatívabb potenciálú a nem torzult részhez képest. varrat potenciálja hegesztett fém potenciálja

Potenciálkülönbség rácstorzulásnál Termo olaj kazán kilyukadt betéte

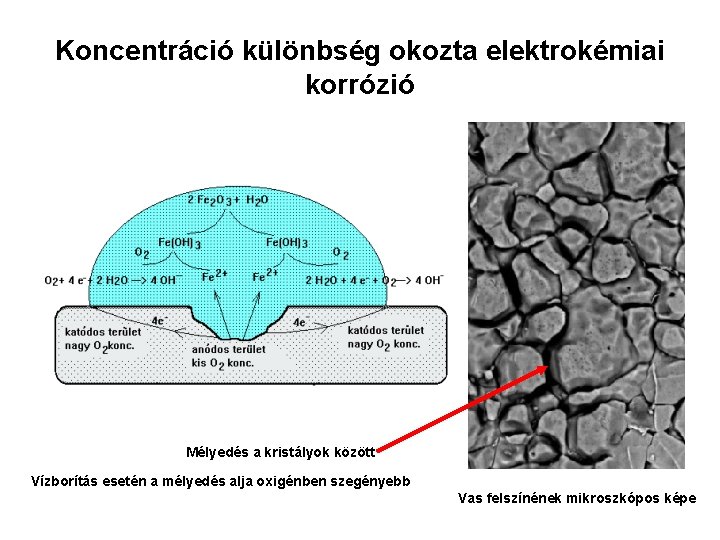
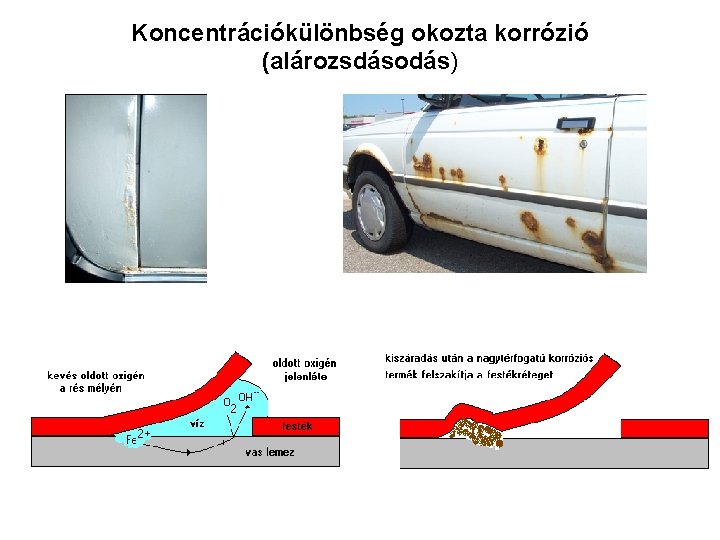
Koncentráció különbség okozta elektrokémiai korrózió Mélyedés a kristályok között Vízborítás esetén a mélyedés alja oxigénben szegényebb Vas felszínének mikroszkópos képe

Koncentrációkülönbség okozta korrózió (alározsdásodás)

Kloridionok okozta korrózió Az előző folyamat jelentősen felgyorsul klorid ionok jelenlétében (réskorrózió, crevice)

Biológiai korrózió Biológiai folyamat által előidézett elektrokémiai korrózió Szulfátredukáló baktériumok: oxigénmentes környezetben a katódon képződő hidrogént használják fel szulfát redukcióra 8 Hadszorbeált + SO 42 - → S 2 - + 4 H 2 O A katódon adszorbeálódott hidrogént, amely fékezi a korróziót eltávolítja, így a korrózió gyorsul A képződő szulfid megtámadja fémet és laza fém-szulfidot képez Fűtőolaj tartály kilyukadt fala. Gyakori korróziót okoz az olajiparban.

Biológiai korrózió A kénbaktérium oxigén tartalmú környezetben szulfid-iont kénsavvá tud oxidálni kénbaktérium telepek a falon betoncső Csatorna csövek korróziója Korrózió a földgáz vezetéken A csőben van víz és hidrogén-szulfid, amelyet a kénbaktérium kénsavvá oxidál. A képződő sav miatt lyukad ki a cső.

Biológiai korrózió Nyálka képzők, algák, kagylók: Főleg hűtővízkörben szaporodnak el. Ahol megtelepednek oxigén hiányos réteget hoznak létre a fedett és nem fedett fémfelületek között Biológiai folyamat által előidézett elektrokémiai korrózió

Kóboráram okozta korrózió

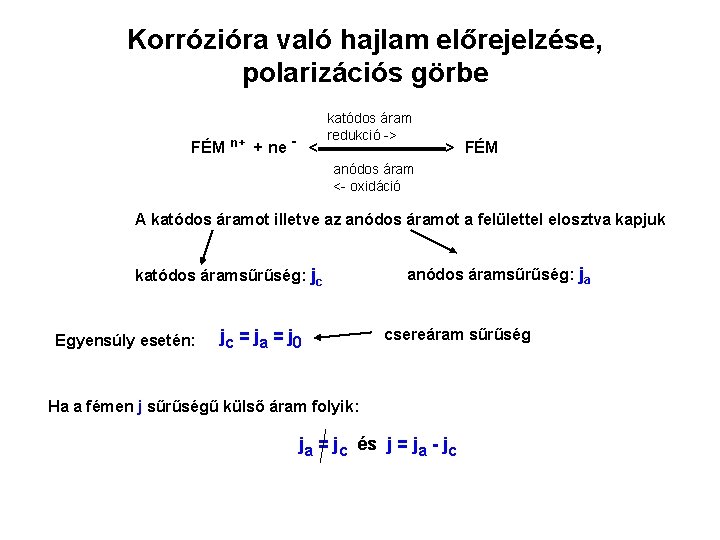
Korrózióra való hajlam előrejelzése, polarizációs görbe katódos áram redukció -> FÉM n+ + ne - <▬▬▬▬> FÉM anódos áram <- oxidáció A katódos áramot illetve az anódos áramot a felülettel elosztva kapjuk katódos áramsűrűség: jc Egyensúly esetén: jc = j a = j 0 anódos áramsűrűség: ja csereáram sűrűség Ha a fémen j sűrűségű külső áram folyik: ja = jc és j = ja - jc

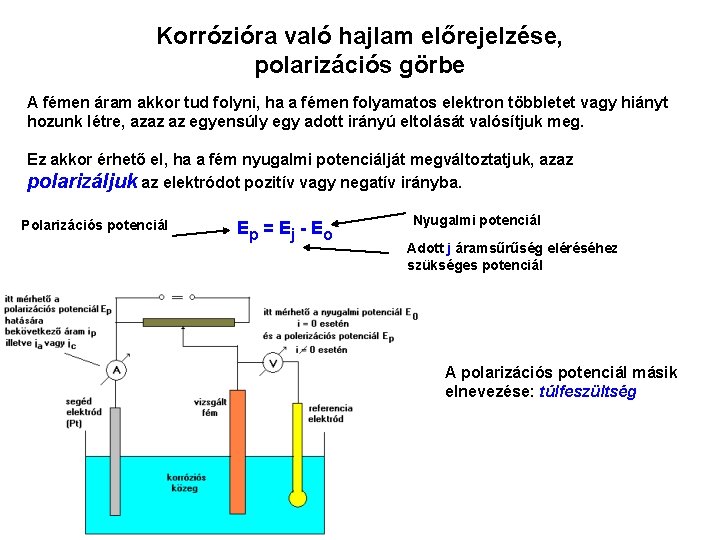
Korrózióra való hajlam előrejelzése, polarizációs görbe A fémen áram akkor tud folyni, ha a fémen folyamatos elektron többletet vagy hiányt hozunk létre, azaz az egyensúly egy adott irányú eltolását valósítjuk meg. Ez akkor érhető el, ha a fém nyugalmi potenciálját megváltoztatjuk, azaz polarizáljuk az elektródot pozitív vagy negatív irányba. Polarizációs potenciál Ep = E j - E o Nyugalmi potenciál Adott j áramsűrűség eléréséhez szükséges potenciál A polarizációs potenciál másik elnevezése: túlfeszültség

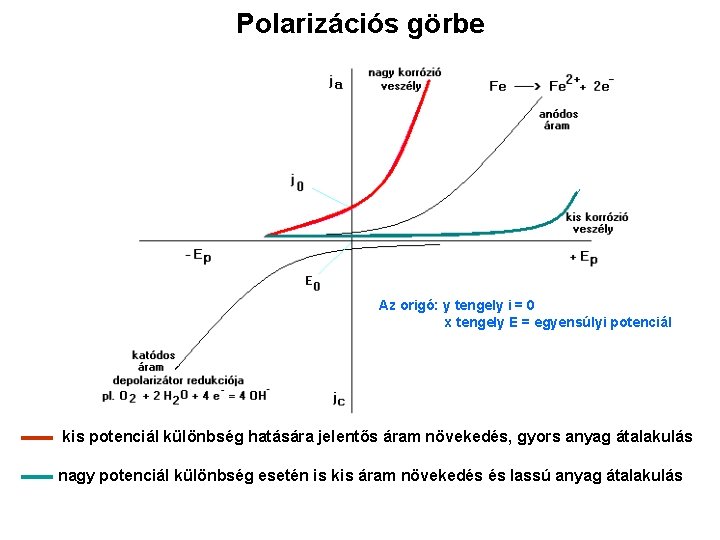
Polarizációs görbe Az origó: y tengely i = 0 x tengely E = egyensúlyi potenciál ▬▬ kis potenciál különbség hatására jelentős áram növekedés, gyors anyag átalakulás ▬▬ nagy potenciál különbség esetén is kis áram növekedés és lassú anyag átalakulás

Számítási gyakorlatok

1. Korróziósebesség számítása Egy korróziós vizsgálatnál az anódként viselkedő alumíniumon 1, 00 m. A/cm 2 áramsűrűséget mértünk. Egyenletes oldódást feltételezve mekkora a várható anyagveszteség mm/év mértékegységben ? Az alumínium sűrűsége 2, 70 g/cm 2, atomtömege 27, 0. Faraday állandó: 96500 As/mol ≈ 26, 8 Aóra/mol Az alumínium anódosan viselkedik, tehát oxidációs reakció játszódik le. Al → Al 3+ + 3 e Tételezzük fel, hogy a mért áramsűrűség 1 éven keresztül áll fenn. Az egy év alatt átáramlott töltés 1, 00 m. A * 365 nap * 24 óra/nap = 8760 m. Aó ≈ 8, 76 Aó 26, 8 Aó hatására 27, 0 / 3 = 9, 00 g alumínium oldódik fel. ( Faraday törvény ) Tehát 8, 76 Aó esetén 8, 76 Aó * 9, 00 g 26, 8 Aó = 2, 94 g Al oldódik ki 1 cm 2 felületen 1 év alatt Az anyagveszteséget kiszámíthatjuk, ha a távozott tömeget megszorozzuk az alumínium sűrűségének reciprokával. 2, 94 g cm 2 * év * 1 cm 3 2, 70 g = 1, 088 cm/év ≈ 1, 09 cm/év = 10, 9 mm/év