MSZAKI KMIA ELADSOK GPSZMRNK HALLGATKNAK 4 Elektrokmia Dr



![Vízben oldott anyagok disszociációja Elektrolitikus disszociáció KA K+ + A - [K+] [A-] Kd Vízben oldott anyagok disszociációja Elektrolitikus disszociáció KA K+ + A - [K+] [A-] Kd](https://slidetodoc.com/presentation_image_h/bcd766f264ab3b0304e439d9535b12f8/image-4.jpg)
![Vezetőképesség Elektrolitok vezetőképessége Nagyobb vezetőképesség nagyobb korrózió veszély ! vezetőképesség [Simens] keresztmetszet [cm 2] Vezetőképesség Elektrolitok vezetőképessége Nagyobb vezetőképesség nagyobb korrózió veszély ! vezetőképesség [Simens] keresztmetszet [cm 2]](https://slidetodoc.com/presentation_image_h/bcd766f264ab3b0304e439d9535b12f8/image-5.jpg)









![Lítium akkumulátor Feszültség [V] ciklus szám önkisülés [%/hó] energiasűrűség [Wh/kg] hatásfok [%] Ólom 2, Lítium akkumulátor Feszültség [V] ciklus szám önkisülés [%/hó] energiasűrűség [Wh/kg] hatásfok [%] Ólom 2,](https://slidetodoc.com/presentation_image_h/bcd766f264ab3b0304e439d9535b12f8/image-22.jpg)





- Slides: 27

MŰSZAKI KÉMIA ELŐADÁSOK GÉPÉSZMÉRNÖK HALLGATÓKNAK 4. Elektrokémia Dr. Bajnóczy Gábor BME Kémiai és Környezeti Folyamatmérnöki Tanszék

AZ ELŐADÁS ANYAGA, KÉPEK, RAJZOK KIZÁRÓLAG OKTATÁSI CÉLRA, KORLÁTOZOTT HOZZÁFÉRÉSSEL HASZNÁLHATÓK ! INTERNETRE KORLÁTLAN HOZZÁFÉRÉSSEL FELTENNI TILOS !

Elektromos vezetők felosztása Elektronvezetők (elsőrendű vezetők, fémek): -áramvezetés az elektronok mozgásával, -ellenállásuk a hőmérséklet növelésével nő. Ionvezetők (másodrendű vezetők, elektrolitok): -pozitív vagy negatív töltésű ionok szállítják az áramot, -ellenállásuk a hőmérséklet növelésével csökken, -az áramvezetés a közegben nem jár kémiai változással de fémes vezetőbe történő átlépéskor kémiai változás történik,
![Vízben oldott anyagok disszociációja Elektrolitikus disszociáció KA K A K A Kd Vízben oldott anyagok disszociációja Elektrolitikus disszociáció KA K+ + A - [K+] [A-] Kd](https://slidetodoc.com/presentation_image_h/bcd766f264ab3b0304e439d9535b12f8/image-4.jpg)
Vízben oldott anyagok disszociációja Elektrolitikus disszociáció KA K+ + A - [K+] [A-] Kd = ▬▬▬▬ [KA] disszociációs egyensúlyi állandó Kd >1 erős elektrolitok (kénsav, sósav, nátrium-hidroxid, … 10 -3 < Kd < 1 középerős elektrolitok (kénessav, kálcium-hidroxid, . . Kd < 10 -3 gyenge elektrolitok (tejsav, ecetsav, bórsav, …
![Vezetőképesség Elektrolitok vezetőképessége Nagyobb vezetőképesség nagyobb korrózió veszély vezetőképesség Simens keresztmetszet cm 2 Vezetőképesség Elektrolitok vezetőképessége Nagyobb vezetőképesség nagyobb korrózió veszély ! vezetőképesség [Simens] keresztmetszet [cm 2]](https://slidetodoc.com/presentation_image_h/bcd766f264ab3b0304e439d9535b12f8/image-5.jpg)
Vezetőképesség Elektrolitok vezetőképessége Nagyobb vezetőképesség nagyobb korrózió veszély ! vezetőképesség [Simens] keresztmetszet [cm 2] ellenállás [Ω] vezető hossza [cm] fajlagos vezetőképesség [Simens cm-1]

Vasúti felüljárók villamosított vonalakon Villamos felsővezetékek védelme bottal való érintéstől, vizelettől (elektrolit !!!)

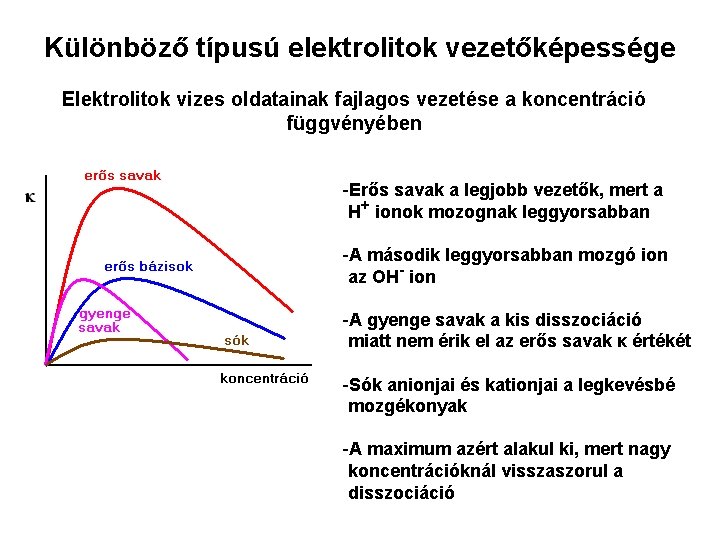
Különböző típusú elektrolitok vezetőképessége Elektrolitok vizes oldatainak fajlagos vezetése a koncentráció függvényében -Erős savak a legjobb vezetők, mert a H+ ionok mozognak leggyorsabban -A második leggyorsabban mozgó ion az OH- ion -A gyenge savak a kis disszociáció miatt nem érik el az erős savak κ értékét -Sók anionjai és kationjai a legkevésbé mozgékonyak -A maximum azért alakul ki, mert nagy koncentrációknál visszaszorul a disszociáció

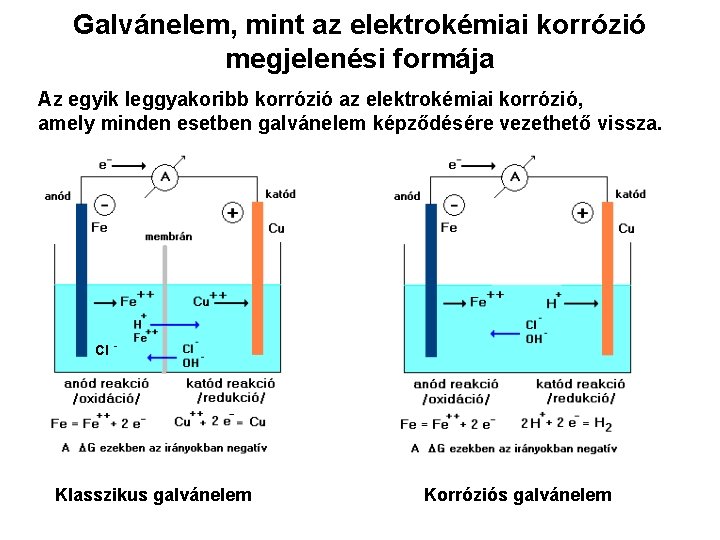
Galvánelem, mint az elektrokémiai korrózió megjelenési formája Az egyik leggyakoribb korrózió az elektrokémiai korrózió, amely minden esetben galvánelem képződésére vezethető vissza. Cl - Klasszikus galvánelem Korróziós galvánelem

Standard elektródpotenciál Az anód és a katód közötti elektronáramlást a két hely közötti szabadentalpia különbség, más szóval potenciál különbség (feszültség különbség) okozza. A potenciál különbség az anód és katód egyedi (abszolút) elektródpotenciáljainak különbségéből adódik. Az abszolút elektródpotenciál nem ismeretes, ezért használjuk a standard körülmények között mérhető, standard hidrogén elektródhoz viszonyított potenciált, amelyek táblázatos gyűjteményét a fémek (elektródfolyamatok) standard elektródpotenciáljainak nevezünk. Standard körülmények T = 25 °C, p = 1 atm ionkoncentráció = 1 [mol/dm 3] A táblázatban az elektródfolyamatokat mindig redukciós irányban írjuk fel.

Standard elektródpotenciál táblázat használata Két egyesített félcella reakció közül mindig a pozitívabb potenciálú játszódik le redukciós irányba (ahogy a táblázatban szerepel) és megfordítja a nálánál negatívabb potenciálú reakciót oxidációs irányba. A fluór minden fémet megtámad. + 0, 4 A klór csak az aranyat nem támadja meg. A vízben oldott oxigén még semleges közegben is számos fémet korrodál. A H+ ion nem bántja az aranyat, ezüstöt, rezet, de oldja a vasat, cinket, alumíniumot. Két fém érintkezésekor várhatóan a negatívabb potenciálú fém korrodál.

Szabadentalpia és a cellapotenciál kapcsolata Elektromos munka: Welektromos = Ecella * n * F n: áramló elektronok mólszáma F: Faraday-állandó Reverzibilis működéskor a galvánelem feszültsége maximális, a végzett munka is maximális (Wmax) Wmax = Ecella * n * F Elektromos energia teljes mértékben átalakítható más energiává. Wmax a szabadentalpia-változás mértéke - ΔG = Wmax = Ecella * n * F Standard állapotra: - ΔG 0 = E 0 cella * n * F (-) , mert a rendszer végez munkát

Elektródpotenciál nem standard állapotban Az elektródpotenciált befolyásoló félcella reakció egyensúlyi folyamat eredménye, tehát érvényes ΔG 0 = - RTln. K Nem egyensúlyi állapotban: ΔG = - RTln(K/Q) Q: a korábban ismert reakcióhányados Legyen t = 25 °C T=298 K ΔG = ΔG 0 + RTln. Q - Ecella *n. F = - E 0 cella * n. F + RTln. Q E = E 0 – (RT/n. F) * ln. Q / -n. F Nernst egyenlet

Nernst egyenlet fém elektródra Fémn+ + ne. E = E 0 – (RT/n. F) * ln. Q E= E 0 Fém Nernst egyenlet [Fém] Tiszta fém aktivitása = 1 – (RT/n. F) * ln ----- [Fémn+] E = E 0 + (RT/n. F) * ln [Fém n+ ] Tizes alapú logaritmusra áttérve: 2, 3*R*298/96500 = 0, 059 E = E 0 + (0, 059/n) * lg [Fém n+ ]

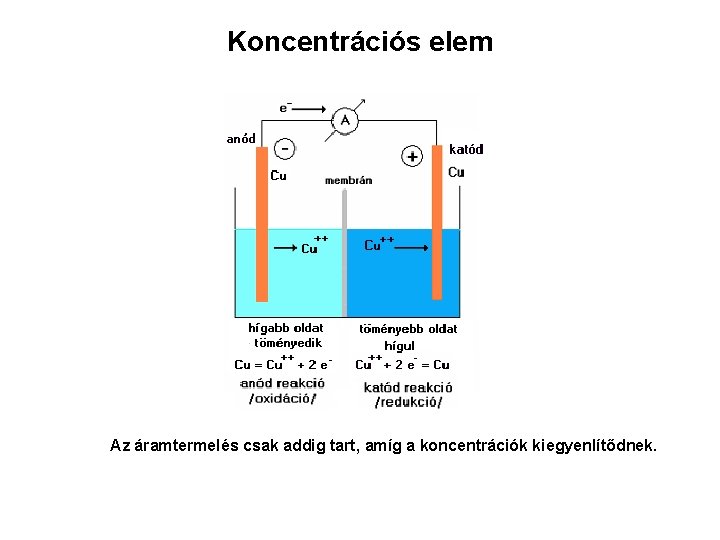
Koncentrációs elem cellafeszültsége Ugyanaz a fém de eltérő ionkoncentrációjú oldataiban Híg oldat félcellapotenciálja: Ehíg = E 0 + (RT/n. F) * ln [híg ] Tömény oldat félcellapotenciálja: Etömény = E 0 + (RT/n. F) * ln [tömény ] Cellapotenciál: mindig a pozitívabból vonjuk ki a negatívabbat (a cellapotenciál csak pozitív lehet) E tömény > E híg Ecella = E 0 + (RT/n. F) * ln [tömény ] – E 0 – (RT/n. F) * [híg] [tömény] Ecella = (RT/n. F) * ln-----[híg]

Koncentrációs elem Az áramtermelés csak addig tart, amíg a koncentrációk kiegyenlítődnek.


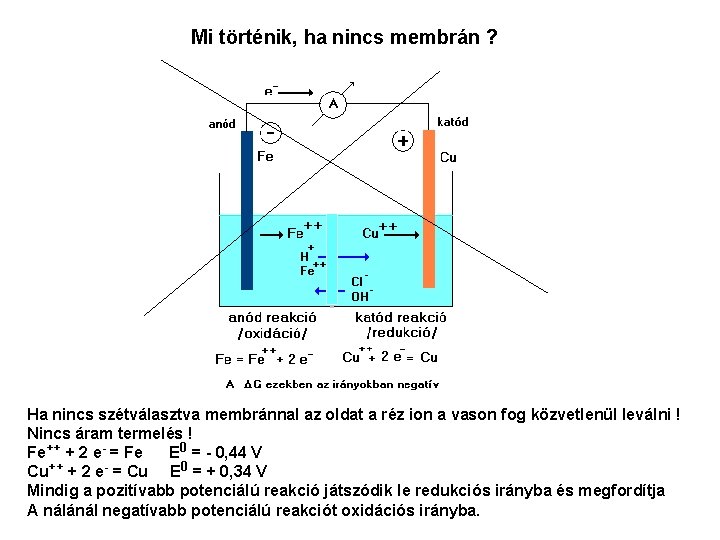
Mi történik, ha nincs membrán ? Ha nincs szétválasztva membránnal az oldat a réz ion a vason fog közvetlenül leválni ! Nincs áram termelés ! Fe++ + 2 e- = Fe E 0 = - 0, 44 V Cu++ + 2 e- = Cu E 0 = + 0, 34 V Mindig a pozitívabb potenciálú reakció játszódik le redukciós irányba és megfordítja A nálánál negatívabb potenciálú reakciót oxidációs irányba.

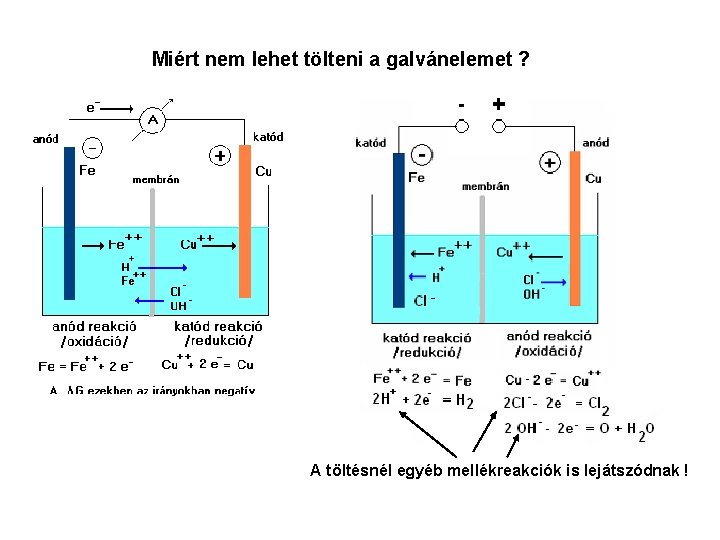
Miért nem lehet tölteni a galvánelemet ? Cl - A töltésnél egyéb mellékreakciók is lejátszódnak !

Ólomakkumulátor Negatív elektródon Pb. SO 4+ 2 e- töltés kisütés Pozitív elektródon töltés Pb. SO 4 + 2 H 2 O kisütés Pb. O 2 + 4 H+ + SO 42 - + 2 e- Pb + SO 42 -

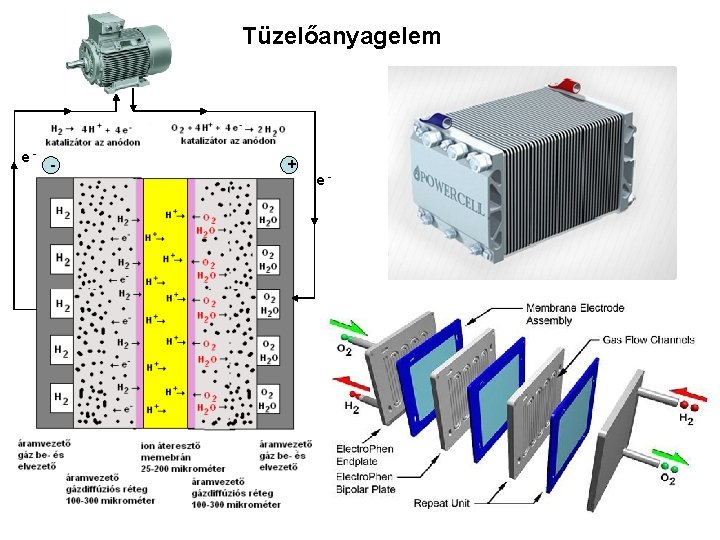
Tüzelőanyagelem e- - + e-

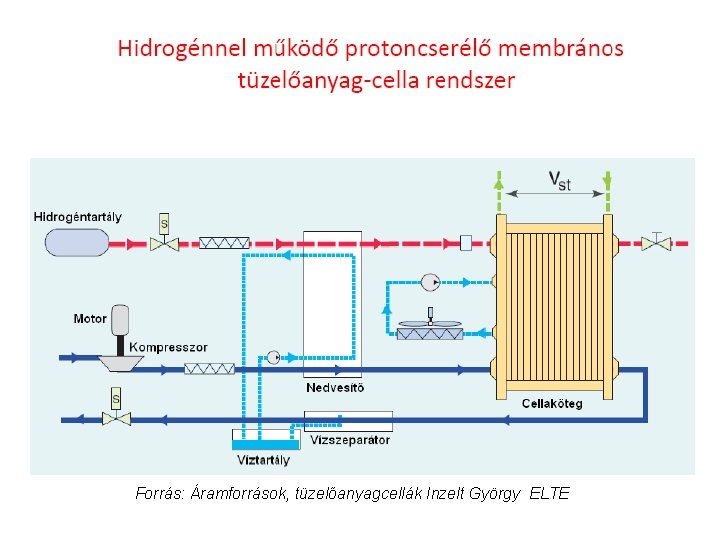
Forrás: Áramforrások, tüzelőanyagcellák Inzelt György ELTE
![Lítium akkumulátor Feszültség V ciklus szám önkisülés hó energiasűrűség Whkg hatásfok Ólom 2 Lítium akkumulátor Feszültség [V] ciklus szám önkisülés [%/hó] energiasűrűség [Wh/kg] hatásfok [%] Ólom 2,](https://slidetodoc.com/presentation_image_h/bcd766f264ab3b0304e439d9535b12f8/image-22.jpg)
Lítium akkumulátor Feszültség [V] ciklus szám önkisülés [%/hó] energiasűrűség [Wh/kg] hatásfok [%] Ólom 2, 0 500 -800 3 -4 Lítium ion 3, 7 1200 5 -10 30 -40 70 -90 160 99, 9

Számítási gyakorlatok

1. Reakcióirány meghatározása az elektródpotenciál táblázatból Határozzuk meg, hogy milyen folyamat játszódik le, ha vaslemezt 1, 0 mol/dm 3 -es rézionokat (Cu 2+ ) ionokat tartalmazó 25 °C-os vizes oldatba merítünk ! A megadott koncentráció és hőmérséklet miatt használható a standard elektródpotenciál táblázat. A két félcella reakció a táblázatból: 1. Cu 2+ + 2 e- = Cu E 0 = + 0, 34 V 2. Fe 2+ + 2 e- = Fe E 0 = - 0, 44 V Az 1. reakció elektródpotenciálja pozitívabb a 2. -nál, tehát a pozitívabb potenciálú félcella reakció redukciós irányba, Cu 2+ + 2 e- = Cu A negatívabb oxidációs irányba játszódik le. Fe = Fe 2+ + 2 e. Tehát az ilyen rendszerben a vas oldódik és a lemezre fémréz válik ki.

2. Standard cellafeszültség számítása Számítsuk ki a standard ezüst és kadmium elektródból készített galvánelem cellafeszültségét ! A félcella reakciók a táblázatból : Ag+ + e- = Ag Cd 2+ + 2 e- = Cd E 0 = + 0, 8 V E 0 = - 0, 4 V Ez a pozitívabb ez játszódik le redukciós irányba (elektronfelvétel) Ez megfordul, és oxidációs irányba játszódik le (elektronleadás) Katódreakció (redukció): 2 Ag+ + 2 e- = 2 Ag Anódreakció (oxidáció) : Cd = Cd 2+ + 2 e- Bruttóreakció : 2 Ag + + Cd = Cd 2+ + 2 Ag E 0 = + 0, 8 V E 0 = + 0, 4 V E 0 cella = + 1, 2 V

3. Elektródpotenciál számítása nem standard állapotban Mekkora a potenciálja annak az elektródnak, amelynek környezetében a cinkion koncentrációja 0, 01 mol/dm 3 ? T = 298 K (Faraday állandó: 96500 As/mol, az elektron szám változást konstansnak tekintjük. ) Zn 2+ + 2 e- = Zn táblázatból : E 0 = - 0, 76 V A Nernst egyenletet felírva: Tiszta fém aktivitása = 1 [Zn] E = E° - RT n. F ln E = E° + RT n. F ln [Zn 2+] E = - 0, 76 + [Zn 2+] R*298 2*96500 A folyamatban az elektronszám változás 2, így n = 2 ln [0, 01] R = 8, 3 Joule / (mol * K) Tizes alapú logaritmusra áttérve 2, 3 * 8, 3 * 298 / 96500 = 0, 059 E = - 0, 76 + 0, 059 2 lg [0, 01] = - 0, 819 Volt ≈ - 0, 82 Volt

4. Koncentrációs elem cellafeszültsége Számítsuk ki egy olyan galvánelemnek a cellafeszültségét, amelyben cinkelektródok helyezkednek el 0, 010 mol/dm 3 és 0, 50 mol/dm 3 cinkion tartalmú oldatban ! T = 298 K, R = 8, 3 Joule/ mol K táblázatból : Zn 2+ + 2 e- = Zn E 0 = - 0, 76 V 1. Félcella potenciálja ( c = 0, 01 mol/dm 3) E 1 = - 0, 76 + 0, 059 2 lg [0, 01] = - 0, 82 volt 2. Félcella potenciálja ( c = 0, 5 mol/dm 3) E 2 = - 0, 76 + 0, 059 2 lg [0, 5] = - 0, 77 volt A két félcella potenciálját összehasonlítva E 2 > E 1 , tehát a töményebb oldatban lévő elektródon redukció játszódik le a táblázatban felírt irányban. A negatívabb potenciálú félcellareakció oxidációs irányba fog végbemenni. katódreakció : anódreakció : bruttóreakció : Zn 2+ + 2 e - = Zn Zn = Zn 2+ + 2 e Zn 2+ + Zn = Zn 2+ + Zn E 2 = - 0, 77 volt töményebb oldat E 1 = - 0, 82 volt hígabb oldat Ecella = E 2 – E 1 = 0, 05 volt A bruttóreakció szerint minőségi változás nem történik, csak a hígabb oldat töményedik és a töményebb oldat hígul. A folyamat addig tart, amíg a koncentrációk kiegyenlítődnek.