I III IV V Reakcikinetika A kmiai egyensly





![Elsőrendű formálkinetika Sztm: A → C (a vissza-reakció elhanyagolható) Seb. e. : - d[A] Elsőrendű formálkinetika Sztm: A → C (a vissza-reakció elhanyagolható) Seb. e. : - d[A]](https://slidetodoc.com/presentation_image_h/0f98322a750cd71109c95786af823fc0/image-7.jpg)
![Másodrendű formálkinetika – a) Szt: 2 A → C (a vissza-reakció elhanyagolható) K: d[A] Másodrendű formálkinetika – a) Szt: 2 A → C (a vissza-reakció elhanyagolható) K: d[A]](https://slidetodoc.com/presentation_image_h/0f98322a750cd71109c95786af823fc0/image-8.jpg)

![Nulladrendű formálkinetika Szt: A → C (a vissza-reakció elhanyagolható) K: - d[A]/dt = k Nulladrendű formálkinetika Szt: A → C (a vissza-reakció elhanyagolható) K: - d[A]/dt = k](https://slidetodoc.com/presentation_image_h/0f98322a750cd71109c95786af823fc0/image-10.jpg)

![Párhuzamos reakciók: egyszerű rendszer (kezelése szinte magától adódik) Sztöchiom. : d[P 1]/dt = k Párhuzamos reakciók: egyszerű rendszer (kezelése szinte magától adódik) Sztöchiom. : d[P 1]/dt = k](https://slidetodoc.com/presentation_image_h/0f98322a750cd71109c95786af823fc0/image-13.jpg)



















































- Slides: 75

I. III. IV. V. Reakciókinetika A kémiai egyensúly Reakciókinetika Sav-bázis egyensúlyok Komplexek képződése Oldhatóság

Reakciókinetika 1. Reakciósebesség fogalma 2. Reakciósebesség mérése 3. Koncentráció-idő függvények 4. 1 -rendű reakció 5. 2 -rendű reakció 6. Sorozatos reakciók 7. Párhuzamos reakciók 8. Megfordítható reakciók 9. A reakciósebbesség hőmérsékletfüggése 10. Katalizis

A reakciósebesség fogalma: - anyagmennyiség-változás/idő (nyílt rendszer) vn = dn/dt egység: mol s-1 - koncentráció-változás/idő (zárt rendszerben) vc = dc/dt egység: mol dm-3 s-1 (V állandó) Egy A + B → P reakcióra konkrétan: v. A = ─ d[A]/dt ill. v. C = + d[P]/dt

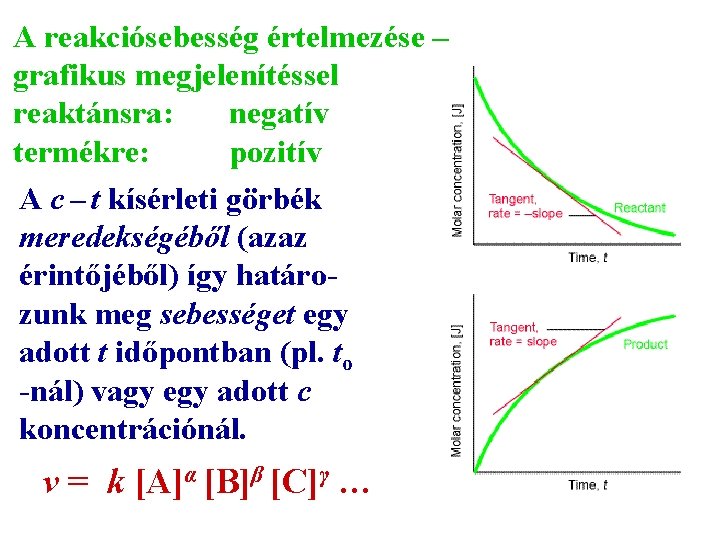
A reakciósebesség értelmezése – grafikus megjelenítéssel reaktánsra: negatív termékre: pozitív A c – t kísérleti görbék meredekségéből (azaz érintőjéből) így határo- zunk meg sebességet egy adott t időpontban (pl. to -nál) vagy egy adott c koncentrációnál. v = k [A]α [B]β [C]γ …

REAKCIÓKINETIKA A sebességmérés kísérleti módszerei kettős feladat: a reakció iniciálása és követése iniciálás: - oldatok összeöntése, keverése (s) - gyors keverési eljárások (ms) - gyors kibillentés egyensúlyból (μs, ns) relaxáció, fotolízis - dinamikus NMR (cserefolyamatoknál) követés: Szakaszos módszerek: - mintavétel, majd analízis (pl. titrálás) - koncentráció vs. idő pontokat kapunk - anyag- és időigényes módszer

Folyamatos követés: - koncentrációval arányos jel rögzítése - fontos: ne zavarja meg a reakciót! - burkoló (bruttó) adatok: p, V, T, κ, p. H*, … - egy reaktánsra szelektív adatok: Aλ, εpot, p. H, opt. forgatás, NMR, ESR jel, … - regisztrálás: konc. vs. idő görbe (néha ‖-an) – analóg vagy digitális formában ez utóbbi azonnal feldolgozható - kis anyag és idő igény, gyors értékelés - ma általános a mikroprocesszoros vezérlés, adatrögzítés és a komputeres feldolgozás Gáz- és heterogén fázis: külön technikák vannak
![Elsőrendű formálkinetika Sztm A C a visszareakció elhanyagolható Seb e dA Elsőrendű formálkinetika Sztm: A → C (a vissza-reakció elhanyagolható) Seb. e. : - d[A]](https://slidetodoc.com/presentation_image_h/0f98322a750cd71109c95786af823fc0/image-7.jpg)
Elsőrendű formálkinetika Sztm: A → C (a vissza-reakció elhanyagolható) Seb. e. : - d[A] / dt = k 1 [A] u. az: d[C] / dt = k 1 [A] Int. alak: Felezési idő: t½ = ln 2/k 1 független a kezdeti koncentrációtól
![Másodrendű formálkinetika a Szt 2 A C a visszareakció elhanyagolható K dA Másodrendű formálkinetika – a) Szt: 2 A → C (a vissza-reakció elhanyagolható) K: d[A]](https://slidetodoc.com/presentation_image_h/0f98322a750cd71109c95786af823fc0/image-8.jpg)
Másodrendű formálkinetika – a) Szt: 2 A → C (a vissza-reakció elhanyagolható) K: d[A] / dt = -k 2[A]2 u. az: d[C] / dt = k 2[A]2 Int. : [A] 1/[A] Felezési idő: t½ = 1/k 2[A]o függ a kezdeti koncentrációtól! tgα=k 2 t t

Másodrendű formálkinetika – b) Szt: A + B → C (a vissza-reakció elhanyagolható) K: d[A]/dt = -k 2 [A][B] u. az: d[C] / dt = k 2[A][B] Int. : Gyakran az x átalakult mennyiséggel számolnak: x = [A]o – [A] és [B] = [B]o – x
![Nulladrendű formálkinetika Szt A C a visszareakció elhanyagolható K dAdt k Nulladrendű formálkinetika Szt: A → C (a vissza-reakció elhanyagolható) K: - d[A]/dt = k](https://slidetodoc.com/presentation_image_h/0f98322a750cd71109c95786af823fc0/image-10.jpg)
Nulladrendű formálkinetika Szt: A → C (a vissza-reakció elhanyagolható) K: - d[A]/dt = k 0 u. az: d[C]/dt = k 0 Int. : [A] = k 0 t a sebesség állandó, nem függ a reaktáns koncentrációjától (felületi reakciók) Harmadrendű formálkinetika: Szt: 3 A → C * A + 2 B → C * A + B + C → D K: értelemszerűen felírható Int. :

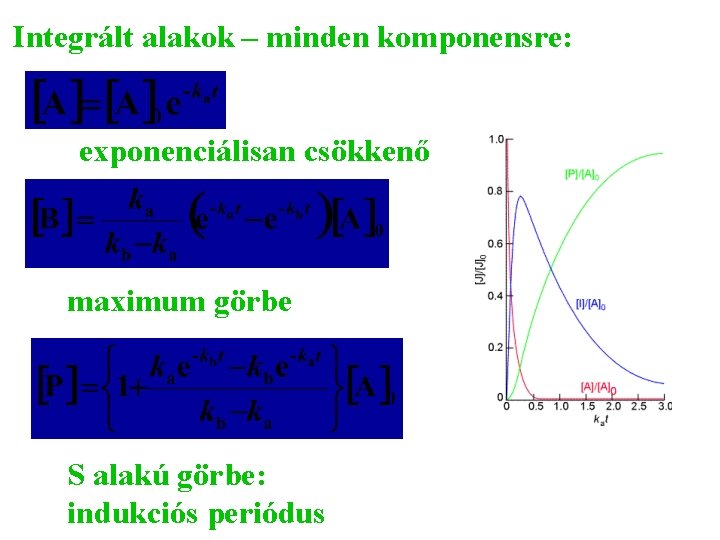
Többtagú sebesség egyenletek: sorozat, párhuzamos és megfordítható reakciók Sorozat (konszekutív) reakciók: Sztöchimetria: Klasszikus példák: a radioaktív bomlássorok Kinetikai egyenlet minden komponensre:

Integrált alakok – minden komponensre: exponenciálisan csökkenő maximum görbe S alakú görbe: indukciós periódus
![Párhuzamos reakciók egyszerű rendszer kezelése szinte magától adódik Sztöchiom dP 1dt k Párhuzamos reakciók: egyszerű rendszer (kezelése szinte magától adódik) Sztöchiom. : d[P 1]/dt = k](https://slidetodoc.com/presentation_image_h/0f98322a750cd71109c95786af823fc0/image-13.jpg)
Párhuzamos reakciók: egyszerű rendszer (kezelése szinte magától adódik) Sztöchiom. : d[P 1]/dt = k 1[A] d[P 2]/dt = k 2[A] d[P 3]/dt = k 3[A] Diff. egyenlet: -d[A]/dt = (k 1 + k 2 + ki) [A] Integrálva: exponenciális (elsőrendű) formulák

Megfordítható reakciók Oda-vissza másodrendű folyamat: Szt. m. : A + B ⇌ C + D Diff. egy. d[A]/dt = -k 2[A][B] + k-2[C][D] Integrálva: Fontos tanulság: egyensúlyban d[A]/dt = 0, azaz a ⇌ sebességek azonosak: k 2[A][B] = k-2[C][D] Ebből:

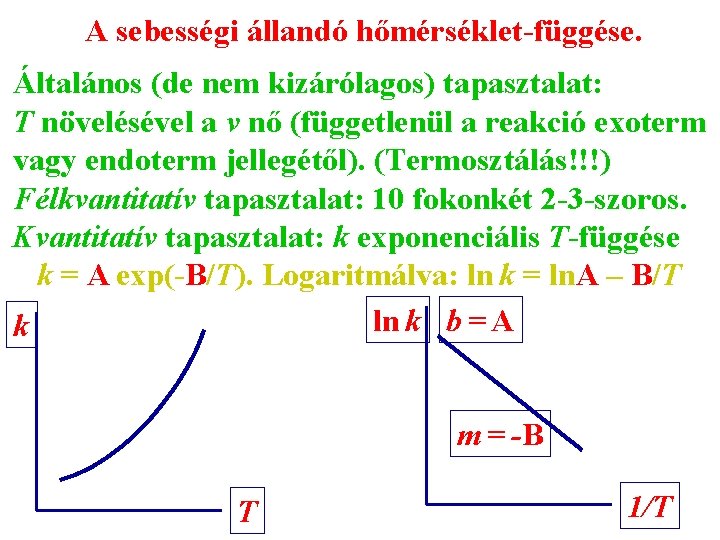
A reakciókörülmények hatása a k sebességi együtthatóra A k független a koncentrációktól és az időtől (ezek szerepelnek a sebességi egyenletben): ezért állandó Értéke függ több külső körülménytől. Ilyenek: - hőmérséklet (T) - nyomás (p) - ionerősség (I) - oldószer permittivitása (ε). Ezért együttható. A T hatása kiemelkedően fontos mind elméleti, mind gyakorlati szempontból. Mértéke általában jelentős és mindig figyelembe kell venni.

A sebességi állandó hőmérséklet-függése. Általános (de nem kizárólagos) tapasztalat: T növelésével a v nő (függetlenül a reakció exoterm vagy endoterm jellegétől). (Termosztálás!!!) Félkvantitatív tapasztalat: 10 fokonkét 2 -3 -szoros. Kvantitatív tapasztalat: k exponenciális T-függése k = A exp(-B/T). Logaritmálva: ln k = ln. A – B/T ln k b = A k m = -B T 1/T

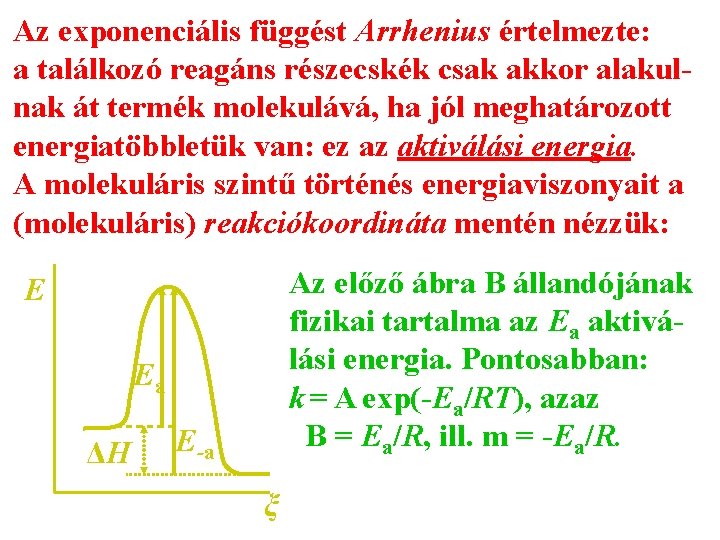
Az exponenciális függést Arrhenius értelmezte: a találkozó reagáns részecskék csak akkor alakulnak át termék molekulává, ha jól meghatározott energiatöbbletük van: ez az aktiválási energia. A molekuláris szintű történés energiaviszonyait a (molekuláris) reakciókoordináta mentén nézzük: Az előző ábra B állandójának fizikai tartalma az Ea aktiválási energia. Pontosabban: k = A exp(-Ea/RT), azaz B = Ea/R, ill. m = -Ea/R. E Ea ΔH E-a ξ

Az Arrhenius-ábrázolás rendszerint egyenest ad: meredeksége: -Ea/R, tengelymetszete, mindig csak extrapolálással: ln A A : preexponenciális tényező Később: ütközési konstans Tapasztaltható: a) elgörbülő vagy megtörő „egyenes”: ez összetett reakcióra utal; b) negatív Ea: exoterm előegyensúly van. Az Ea ált. def. :

A T függésből mért Ea rendszerint több elemi folyamat Ea-jából származó összetett érték. Az Ea profilok jól szemléltetnek. Pl. • Az aktivált komplex a görbe maximumán van, • a köztitermék pedig a minimumában. • Az ee ill. ss különbözősége jól látszik. • A – Ea is értelmezhető endoterm ee alapján. a) Ea(a) + Ea(b) > E’a(a) + b) Ea(a) + Ea(b) < E’a(a) – A többi reakciókörülmény hatását az aktivált (átmeneti) komplex elmélete kapcsán tárgyaljuk.

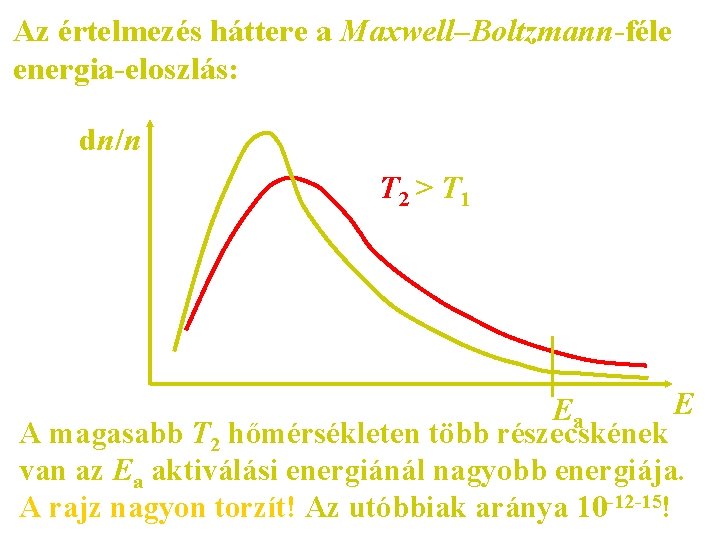
Az értelmezés háttere a Maxwell–Boltzmann-féle energia-eloszlás: dn/n T 2 > T 1 E Ea A magasabb T 2 hőmérsékleten több részecskének van az Ea aktiválási energiánál nagyobb energiája. A rajz nagyon torzít! Az utóbbiak aránya 10 -12 -15!

Kémiai egyensúly 1. Példa, Le chatelier elv 2. Az egyensúlyi állandó 3. Az egyensúlyi állandó és a szabadentalpia

Haber-Bosch szintézis: N 2 + 3 H 2 = 2 NH 3 Exoterm: ΔH=-92 k. J Le chatelier elv: Ha az egyensúlyban lévő rendszert külső hatás ér, az egyensúly olyan irányba tolódik el, amellyel a rendszer a külső hatást csökkenteni tudja

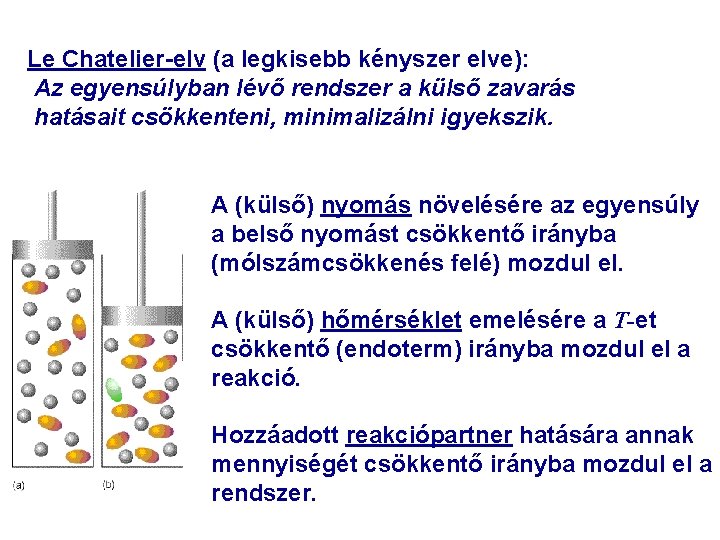
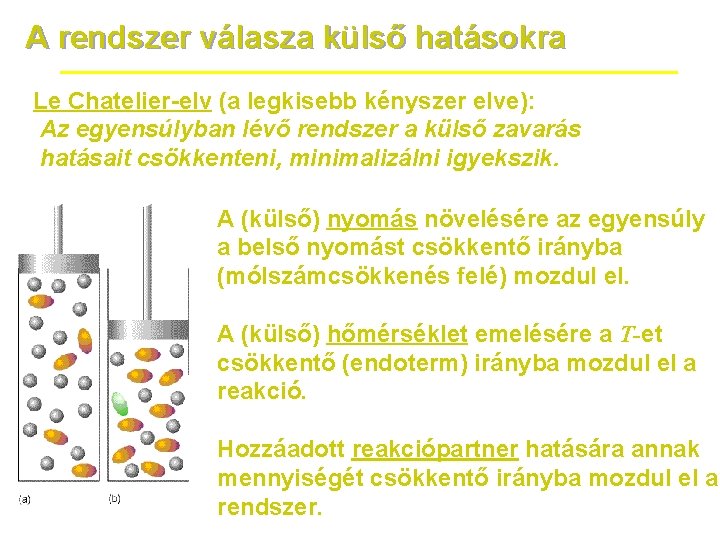
Le Chatelier-elv (a legkisebb kényszer elve): Az egyensúlyban lévő rendszer a külső zavarás hatásait csökkenteni, minimalizálni igyekszik. A (külső) nyomás növelésére az egyensúly a belső nyomást csökkentő irányba (mólszámcsökkenés felé) mozdul el. A (külső) hőmérséklet emelésére a T-et csökkentő (endoterm) irányba mozdul el a reakció. Hozzáadott reakciópartner hatására annak mennyiségét csökkentő irányba mozdul el a rendszer.

A kémiai reakciók iránya és a kémiai egyensúly A termodinamika alkalmazása kémia (reaktív) rendszerekre. 3 fontos kérdés: • a változás iránya: miből mi lesz? • a változás mértéke: hol van az egyensúly? • a változás hogyanja időben és térben (reakciókinetika és mechanizmus – jövő félévben)

A változás iránya Általános tapasztalat: a reakciók spontán csak az egyik irányba mennek végbe, fordítva nem. XIX. sz. : Berthelot–Thomson-szabály az exoterm reakciók (q < 0) mennek végbe spontán Ma: spontán folyamatokban (reakciókban) a Gibbs-féle szabadentalpia (Gp, T) csökken ΔG = ΔH - TΔS < 0 ( p, T – állandó)

Josiah Willard Gibbs Born: 11 Feb 1839 in New Haven, Connecticut, USA Died: 28 April 1903 in New Haven, Connecticut, USA J. W. Gibbs – pár évig tartó európai tanulmányútja kivételével – élete legnagyobb részét a Yale-en töltötte. Családot sohasem alapított; a nővérével élt közös háztartásban. Hosszú éveken keresztül töprengett következtetésein, majd rendkívül precízen kifejtve azokat, dolgozatait egy jelentéktelen folyóiratban (The Transaction of the Connecticut Academy of Sciences) publikálta. Barátai és diákjai nagy tisztelettel tekintettek a szerény emberre és a kiváló tanárra. A kortárs amerikai tudósok figyelmét túlságosan lekötötte a kémia gyakorlati kérdéseinek vizsgálata, így Gibbs életében nem ismerték fel elméletének kiemelkedő fontosságát. Ma azonban sokan úgy emlegetik, mint Amerika első nagy tudósainak egyikét.

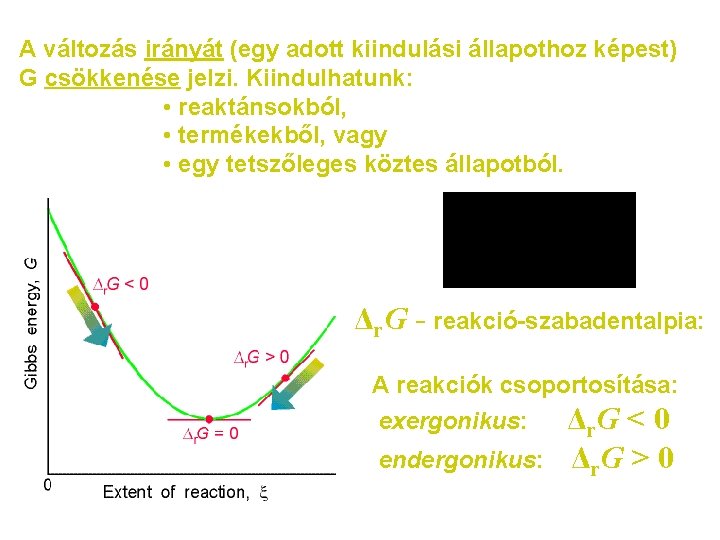
A szabadentalpia változása • G értéke a reakció előrehaladásával, azaz a pillanatnyi összetétel függvényében változik. • A tiszta reaktáns és tiszta termék állapotok között létezik egy minimális szabadenergiájú, ún. egyensúlyi állapot. • A reakció előrehaladásának mértéke: reakciókoordináta, ξ Kétféle értelmezésben használjuk: - makroszkópikus: 0 < ξ < 1 (0 ill. 100% konverzió) - molekuláris: a reaktánsok átalakulásának folyamata térben és időben (ún. aktivált komplexen keresztül).

A változás irányát (egy adott kiindulási állapothoz képest) G csökkenése jelzi. Kiindulhatunk: • reaktánsokból, • termékekből, vagy • egy tetszőleges köztes állapotból. Δr. G - reakció-szabadentalpia: A reakciók csoportosítása: exergonikus: Δr. G < 0 endergonikus: Δr. G > 0

Pl. izomerizáció: A B G változása a rendszerben: d. G = Vdp – Sd. T+ µA dn. A + µB dn. B reaktánsra dξ = – dn. A, termékre dξ = + dn. B. ha p, T = állandó: d. G = µAdn. A + µBdn. B = (µB – µA) dξ Ebből adódik az ún. reakció-szabadentalpia:

A spontán reakciók iránya Három megfogalmazásban: • a G csökkenésének irányába, • a kémiai potenciálok kiegyenlítődésének irányába: reaktánsoké csökken, termékeké növekszik! Pl. ha µA > µB, úgy az A –› B irányba és viszont; • az egyensúly felé. Az egyensúly jellemzése • A G minimuma ott, ahol a G vs. ξ függvény meredeksége 0. • a kémiai potenciálok azonosak, pl. µA = µB

Δr. G és ΔG⊖ kapcsolata Δr. G - reakció-szabadentalpia • G vs. ξ függvény meredeksége a reakcióelegy adott összetételénél, vagy • G változása, ha 1 mól reaktánsból 1 mól termék képződik az adott összetételnél. ΔG⊖ - standard reakció-szabadentalpia a Gibbs-függvény változása ha 1 mól standard állapotú reaktánsból 1 mól standard állapotú termék képződik.

Az egyensúlyi összetétel • Az egyensúlyi összetétel a td-i egyensúly előbbi megfogalmazásának és a kémiai potenciál kifejezésének kombinációjával számítható. • Pl. egyensúlyi gázreakció esetében: A(g) ⇌ B(g)

Egyensúlyban r. G = 0. Ekkor a Qp értéke a Kp egyensúlyi állandó: Azaz, egyensúlyban: G⊖ =- RT ln Kp Az ellentétes előjel fontos: • ha G⊖ < 0, akkor Kp > 1 termék van túlsúlyban, • ha G⊖ > 0, akkor Kp < 1 reaktáns van túlsúlyban.

Általános tárgyalás A reakció: a. A + b. B ⇌ c. C + d. D dξ előrehaladáskor: dn. A = -adξ … dn. C = +cdξ általánosan: dnj = vj dξ G változása: s így a reakció-szabadentalpia: Mivel µj = µj⊖ + RTln aj, ahol aj = fj /pj, ezért , ahol

A Q az ún. reakcióhányados: Egyensúlyban Δr. G = 0, ekkor Ez az ún. termodinamikai egyensúlyi állandó Ezekből a „végeredmény”: ΔG⊖ = – RT ln K

• Gázfázisban (fugacitással, ill nyomással): • Molalitásokkal (vagy móltörtekkel) kifejezve: • Disszociációfokkal: 0 < α < 1 HA ⇌H++AOstwald-féle higítási törvény

Mitől függ ΔG ⊖ értéke? ΔG⊖ – = + vagy – + = = = ΔH⊖ – – – + + TΔS⊖ + – spontán T-től függ nem spontán ΔH : a kötésviszonyok változását tükrözi ΔS : a rendezettség változását tükrözi (T növelése fontos!) A reakciók csatolása lehetséges, ezért egy exergonikus reakció „hajthat” egy endergonikusat, pl. az ATP hidrolízise „hajtja” a proteinek bioszintézisét.

ΔG ⊖ számítási módjai • termodinamikai adatokból: ΔG⊖ = ΔH⊖ – T ΔS⊖ • K egyensúlyi állandóból: ΔG⊖ = – RT ln K • elektrokémiai mérésekből: ΔG⊖ = – v. FE⊖

Az egyensúly klasszikus leírása Kísérleti tapasztalatok alapján – koncentrációkkal (Guldberg és Waage, 1863): a tömeghatás törvénye • A termodinamika kifejlesztése után vezették be az aktivitásokkal kifejezett K-t. • Híg oldatokban természetesen továbbra is lehet a koncentrációkkal számolni.

A K meghatározásának módszerei • Egyensúlyi koncentrációk kísérletes mérésével, az egyensúly megzavarása nélkül: a) a reakcióelegy “befagyasztásával” b) koncentrációval arányos mennyiségek mérése pl. fotometria, elektródpotenciál, nyomás, stb. • Galvánelem elektródpotenciáljának mérésével • Termodinamikai adatokból • Statisztikus mechanikai számításokkal spektroszkópiai mérésekből.

A reakcióegyenlet és a K kapcsolata • Egyértelmű sztöchiometria és • pontosan definiált standard állapotok kellenek. N 2 + 3 H 2 ⇌ 2 NH 3 K = 6, 8× 105, ΔGθ = -33, 2 k. J ½N 2 + 3/2 H 2 ⇌ NH 3 K’ = 8, 2× 102, ΔGθ’ = -16, 6 k. J NH 3 ⇌ 1/2 N 2 + 3/2 N 2 ‘K = 1, 2× 10 -3, ‘ΔGθ = +16, 6 k. J 2 NH 3⇌ N 2 + 3 N 2 K = 1, 5× 10 -6 ΔGθ = +33, 2 k. J

A körülmények hatása az egyensúlyra 3 „körülményt” (p, T, xj) vizsgálunk – két dologra: • a K egyensúlyi állandó értékére és • az egyensúly helyzetére. A hatások összegzése: A p nyomás: • nem befolyásolja K értékét, de • módosítja az egyensúly helyzetét (ha v 0) A T hőmérséklet: mindkettőt módosítja! Az xj koncentrációk: csak az egyensúly helyzetét változtatják meg, K értékét nem!

A rendszer válasza külső hatásokra Le Chatelier-elv (a legkisebb kényszer elve): Az egyensúlyban lévő rendszer a külső zavarás hatásait csökkenteni, minimalizálni igyekszik. A (külső) nyomás növelésére az egyensúly a belső nyomást csökkentő irányba (mólszámcsökkenés felé) mozdul el. A (külső) hőmérséklet emelésére a T-et csökkentő (endoterm) irányba mozdul el a reakció. Hozzáadott reakciópartner hatására annak mennyiségét csökkentő irányba mozdul el a rendszer.

A nyomás hatása az egyensúlyra (K-ra) • A K egyensúlyi állandó nem függ a nyomástól, mert a G⊖ értékét a standard nyomásra definiáltuk: ΔG⊖ = – RT ln K Vigyázat, oldatreakciókban speciális helyzet van: ΔV⊖ = a reakció standard térfogatváltozása. A nyomás változása megváltoztatja az egyensúlyi összetételt; a Le Chatelier-elvnek megfelelő irányba eltolódik az egyensúly, ha V⊖ 0 (pl. mólszámváltozás gázreakciókban).

A nyomás hatása az egyensúly helyzetére Le-Chatelier-elv: A rendszer a nyomás növelésére a mólszámcsökkenés irányába mozdul el: Reakciónk: A ⇌ 2 B. Kezdetben A= n, B=0 mol. Egyensúlyban: A = (1 - )n, B = 2 n. Az egyensúlyi móltörtek: és azaz Kp nem, de α függ p-től!

A p hatása általánosabban Korábban levezettük, hogy Mivel Kp független a p-től, ezért Kx és v fordított viszonyban vannak. • Ha v > 0, akkor p növelésére Kx csökken, több reaktáns képződik. • Ha v < 0, akkor p növelésére Kx nő, több kiindulási anyag képződik. • Ha v = 0, Kx = Kp, az egyensúlyi összetétel független a nyomástól.

A hőmérséklet hatása az egyensúlyra Kvalitatíven (Le Chatelier-elv): T növelésével a reakció az endoterm irányba tolódik el. Endoterm reakciók: T nő —› több termék Exoterm reakciók: T nő —› több reaktáns A T hatása az egyensúlyra: • K értéke változik és • ezzel az egyensúlyi összetétel is változik. A kvantitatív összefüggés: a van’t Hoff-egyenlet

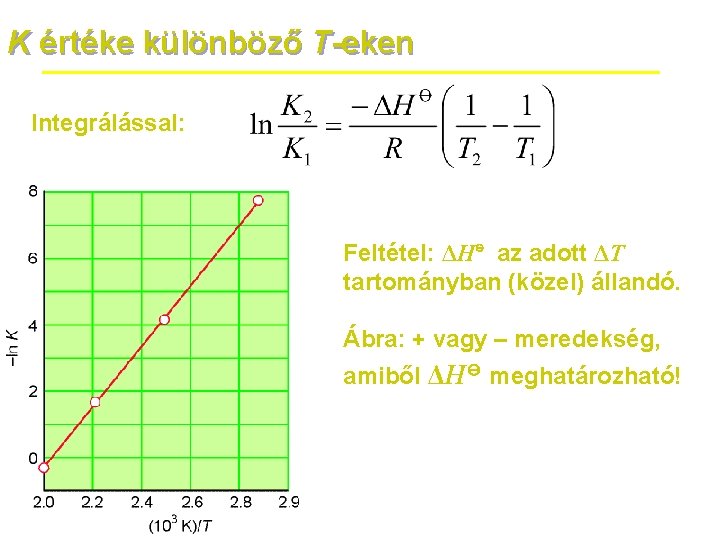
A T hatása a K értékére Levezettük: T szerinti deriválással (teljes differenciál) és a Gibbs–Helmholtz-egyenlet alkalmazásával: ΔH⊖ = standard reakcióentalpia Az endoterm/exoterm jelleg hatása itt világosan látszik. A van’t Hoff-egyenlet analóg a Clausius–Clapeyron-egyenlettel.

K értéke különböző T-eken Integrálással: Feltétel: ΔH⊖ az adott ΔT tartományban (közel) állandó. Ábra: + vagy – meredekség, amiből ΔH⊖ meghatározható!

Az egyensúly klasszikus leírása Kísérleti tapasztalatok alapján – koncentrációkkal (Guldberg és Waage, 1863): a tömeghatás törvénye • A termodinamika kifejlesztése után vezették be az aktivitásokkal kifejezett K-t. • Híg oldatokban természetesen továbbra is lehet a koncentrációkkal számolni.

Sav-bázis egyensúly 1. Sav-bázis elméletek (Arrhenius, Brönsted, Lewis) 2. A víz öndisszociációja, p. H 3. Disszociáció állandók 4. Hidrolízis 5. Pufferoldatok 6. Indikátorok 7. A p. H mérése 8. Titrálási görbék

Savak és bázisok „Legfontosabb” egyensúly típus, „mindenütt” van! Osztályozások: • egyszerű: H+-t, ill. OH- - t ad le disszociációkor • Brönsted–Lowry: a sav protondonor: HA –› H+ + Aa bázis protonakceptor: B + H+ –› BH+ • Lewis: elektronpár-akceptor, ill. donor Mindig konjugált sav-bázis párok alakulnak ki. Most egyensúlyt és nem szerkezetet tárgyalunk. Ez lényegében elektrolitos disszociáció. Leggyakoribbak a vizes oldatok (laboratórium, élőszervezet, természet, ipar, stb. )

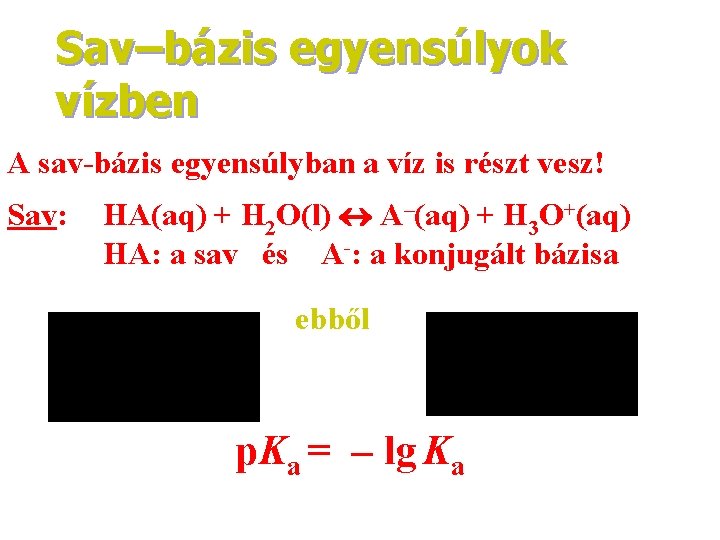
Sav–bázis egyensúlyok vízben A sav-bázis egyensúlyban a víz is részt vesz! Sav: HA(aq) + H 2 O(l) A–(aq) + H 3 O+(aq) HA: a sav és A-: a konjugált bázisa ebből p. Ka = – lg Ka

Bázisok: Értelemszerűen alkalmazzuk az előbbieket: B(aq) + H 2 O(l) BH+(aq) + OH–(aq) B: a bázis és BH+: a konjugált savja ebből p. Kb = – lg Kb Savak és bázisok osztályozása: • erős és gyenge savak/bázisok (szupersavak) • egy-, két-, háromértékű savak/bázisok • híg és tömény savak (Hammett-függvény)

p. H és p. OH Célszerű p. H-skála (Sörensen): p. H = – lg a(H 3 O+) Analóg p. OH-skála: p. OH = – lg a(OH-) tiszta vízben p. H = p. OH = ½ p. Kw 7, 00 bármilyen vizes oldatban: p. Kw = p. H + p. OH A víz p. Kw autoprotolitikus állandója kapcsolatot teremt egy sav p. Ka disszociációs (deprotonálódási) állandója és konjugált bázisa p. Kb (asszociációs) protonálódási állandója között: p. Ka + p. Kb = p. Kw

A víz öndisszociációja és a p. H A víz amfolit: lehet sav is, bázis is, sőt egyszerre mindkettő, ezért öndisszociációja van. H 2 O(l) + H 2 O(l) H 3 O+(aq) + OH–(aq) Kw = a. H 3 O+ a. OH– és p. Kw = – lg Kw Kw a víz autoprotolitikus állandója („ionszorzat”) 25 o. C-on: Kw = 1, 008 × 10 -14, azaz p. Kw = 14, 00 Tiszta vízben a H+ és OH- ionok aktivitása: 1× 10 -7, ez mol dm-3 koncentrációkkal is jól kifejezhető.

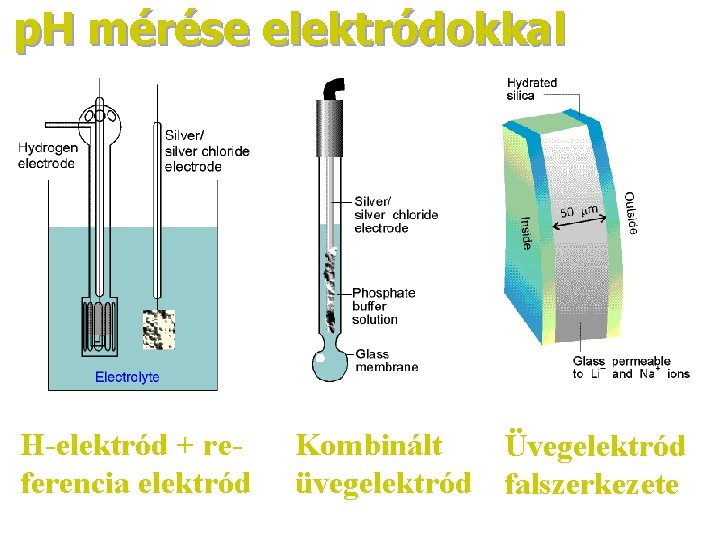
A p. H mérése Több módszert használunk: kalibrálás standard p. H-pufferekkel (IUPAC) • sav-bázis indikátorokkal – fotometriásan • elektrokémiai módszerekkel • hidrogén-elektróddal (pontos, körülményes) • kinhidron–Pt-elektróddal (elmúlóban) • üvegelektróddal (sima és kombinált, ipari-, mikroelektródok, bioszenzorok, stb. • sav-bázis katalízis mérésével (konc: ˜ 1 -20 M/l)

p. H mérése elektródokkal H-elektród + referencia elektród Kombinált Üvegelektród üvegelektród falszerkezete

Pufferek – indikátorok – amfolitok Pufferek (H-H-e): p. H = p. Ka – lg (A’/S) A p. H kevéssé változik az S 〜 A’ tartományban. A nagy kapacitású A’ forrás (só) „lenyeli” a H+-t, illetve HA forrás H+-ja semlegesíti az OH- -t. Indikátorok: színváltó elektrolitok (gyenge szerves savak vagy gyenge bázisok, erős kromofor csoport – színváltás az ekvivalenciapontban („végpont”) ha p. Kind p. Hekv. Amfoter elektrolitok (amfolitok): egyszerre sav és bázis: izoelektromos pont aminosavak, polipeptidek, fehérjék, enzimek biológiai jelentősége (biológiai p. H értékek)

Műveletek a p. H „körül” p. H számítások: • egyértékű sav vagy bázis disszociációja • több egyensúly együttes figyelembe vétele mindig egyensúlyi koncentrációkat veszünk figyelembe, (de a bemértekből indulunk ki) Egyértékű és többértékű • savak: egy, két vagy három H+ disszociál a p. Ki értékeke rendszerint különböznek • bázisok: egy vagy két OH- disszociál (H+-t köt meg)

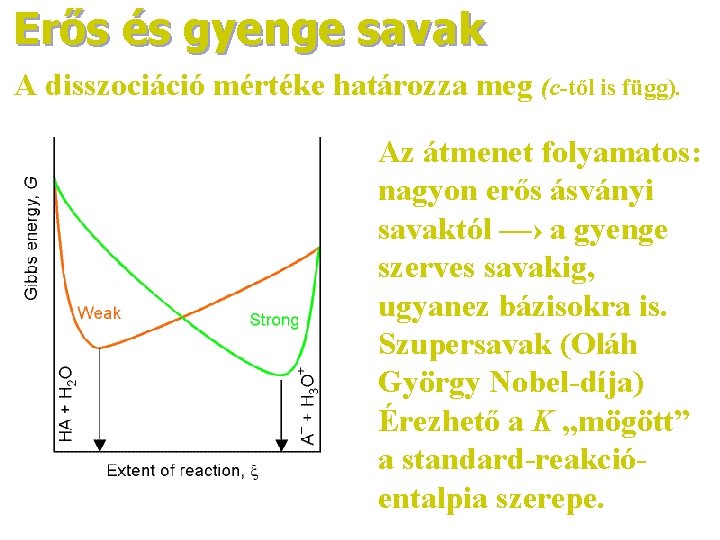
Erős és gyenge savak A disszociáció mértéke határozza meg (c-től is függ). Az átmenet folyamatos: nagyon erős ásványi savaktól —› a gyenge szerves savakig, ugyanez bázisokra is. Szupersavak (Oláh György Nobel-díja) Érezhető a K „mögött” a standard-reakcióentalpia szerepe.

Erős és gyenge savak K értékei Sav (– H+) konju- gált bázis HI IHCl Cl. H 2 SO 4 HSO 4 -ecetsav Ac. NH 4+ NH 3 szénsav HCO 3 foszforsav Ka p Ka 1 p Ka 2/3 1011 107 102 1, 2× 10 -2 – 11 – 7 – 2 1, 92 4, 75 9, 25 6, 37 10, 25 2, 12 7, 21 12, 67

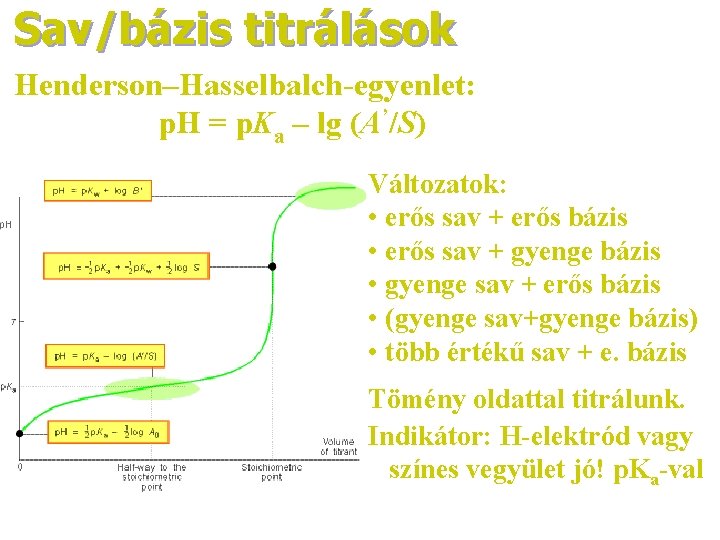
Sav/bázis titrálások Henderson–Hasselbalch-egyenlet: p. H = p. Ka – lg (A’/S) Változatok: • erős sav + erős bázis • erős sav + gyenge bázis • gyenge sav + erős bázis • (gyenge sav+gyenge bázis) • több értékű sav + e. bázis Tömény oldattal titrálunk. Indikátor: H-elektród vagy színes vegyület jó! p. Ka-val

Redoxi egyensúlyok és titrálások Formailag a sav-bázis egyensúlyokhoz hasonlóak – de itt nem proton, hanem elektron-átmenet van. Általánosan: Ared+ Box Aox + Bred Leírásukat az elektrokémiában tárgyaljuk a standard redoxipotenciálok segítségével. A redoxi titrálások végpontját elektród vagy színváltó redoxi-indikátor jelezheti (jó Eθ).

Komplex vegyületek egyensúlyai Fémkomplexek: központi fém ion + ligandumok (solv) • összetétel, sztöchiomeria (1: 1 ––› 1: 8) • egy- és többmagvú komplexek, akvakomplexek • vegyesligandum komplexek • egyensúlyi viszonyok • lépcsőzetes komplexképződés • szerkezet, kötésviszonyok • kristálytér- és ligandumtér elmélet • színek • mágneses sajátságok • kinetikai sajátságok • ligandumcsere, komplex-katalízis • jelentőségük (ipar, mezőgazd. , élőszervezet, stb. )

Komplex egyensúlyok Bruttó reakció (töltések: M m+, L – vagy 0) Me(H 2 O)6(aq) + 6 L(aq) Me. L 6(aq) + 6 H 2 O A termodinamikai egyensúlyi állandó: A víz aktivitása a K-ba beolvasztható. Az egyes ligandumok lépcsőzetes felvételére az egyensúlyok külön-külön is felírhatók:

Lépcsőzetes komplexképződés folyamat Me + L Me. L 2 Me. Li-1 + L Me. Li Me. LN-1 + L Me. LN stabilitási állandó: K

Komplex szorzat: β Az addigi lépcsőzetes stabilitási állandók szorzata: Me. L + i L Me. Li N = maximális koordinációs szám:

Átlagos koordinációs szám: Egy adott oldatban a lépcsőzetes komplexképződés előrehaladásának mértéke: c. L , c. M = teljes L, ill Me koncentráció, [L] = szabad ligandum koncentráció

Parciális móltört: α Az adott ligandumszámú komplexben lévő fémion és a teljes fémion-koncentráció hányadosa: 0< α<1 Komplex stabilitási állandók meghatározása: p. H-metriásan, fotometriásan, elektrokémiai módszerekkel, stb. A K értékek igen nagy skálán mozognak: 10 -2 < K < 1020 -30. Eszerint vannak kis és nagy stabilitású komplexek (gyenge és erős komplexképződés, teljes komplexálás).

Különböző egyensúlyok együtt Egy példa a sok változatból: I 2 + I- ‹=› I 3 - egyensúly K értékének meghatározása víz és széntetraklorid közötti jód-megoszlással. Csak I 2 megoszlása: P = [I 2]org/[I 2]víz I- jelenlétében: I 2 + I- ‹=› I 3 - K = [I 3 -]/[I 2][I-] (víz) Csak I 2 oldódik org-ban. A megváltozott megoszlás: P’ = [I 2]org/{[I 2]víz+[I 3 -] víz} mérendő több [I-]-nél P/P’ = 1 + K [I-] ábrázolásból kapjuk K-t.

További egyensúlyok Sok fontos példa van: • gázegyensúlyok, pl: N 2(g) + 3 H 2(g) 2 NH 3(g) SO 2 + ½O 2 SO 3 (g) • gáz-szilárd reakciók: Ca. CO 3(s) Ca. O(s) + CO 2(g) • oldódási egyensúlyok (oldhatósági szorzat) MX(s) M+(aq) + X-(aq) • szerves reakciók: pl. észterhidrolízis

A koncentrációk hatása az egyensúlyra A T és p változtatása mellett a reaktánsok x. J koncentrációinak változtatására is módosul az egyensúly – de csak a helyzete, és nem a K értéke. Le Chatelier-elv (mivel itt a K állandó marad): • további reaktáns hozzáadására több termék keletkezik és viszont, • termék elvonás hatására is több termék keletkezik és viszont. Gyakorlati hasznosítás: • termékelvonás (gáz, csapadék, extrahálás, stb. ) • komplexbe vitel L fölöslegben, maszkírozás A katalizátor nem módosítja az egyensúlyt!

Oldhatóság 1. Olhatósági szorzat 2. Alkalmazásai 3. Csapadékok oldódása
